Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.57 no.2 Ciudad de México mar./abr. 2005
Artículo especial
Trasplante de células hematopoyéticas en mieloma múltiple
Hematopoietic stem cell transplantation in multiple myeloma
Jorge Vela–Ojeda,* Miriam A. García Ruiz–Esparza*
* Hospital de Especialidades Centro Médico La Raza, IMSS.
Reimpresos:
Dr. Jorge Vela–Ojeda
07001, México, D.F.
Tel.: 57821088 Ext. 23–213. Fax: 55379392
Correo electrónico: vela12x@prodigy.net.mx
ABSTRACT
Multiple myeloma (MM) is the second most common hematologic malignancy, affecting approximately 14,000 new patients per year in the United States. For over four decades, the standard treatment for MM has been a regimen of melphalan combined with prednisone. Using this treatment modality, complete responses are rare, and 50% of patients have had disease that was resistant to chemotherapy. Attempts have been made to improve the outcome of MM by administering combinations of I. V. polichemotherapy, but these treatments are equivalent in terms of overall survival. High–dose therapy with peripheral blood stem cell support can be applied safely in these patients and achieves significantly higher complete remission rates as well as better event–free survival and overall survival. However, neither tumor–cell purging, positive selection, intensification of conditioning with additional chemotherapeutic agents, nor total body irradiation have been shown to improve outcome. The role of tandem transplantation with high–dose melphalan seems to be a good selection of treatment in hospitals having all resources. Future research will include the combination of the best remission–induction regimen with tandem transplants and maintenance treatments (thalidomide, idiotype or dendritic cell vaccination) that will sustain complete remission. Development of non–myeloablative allogeneic transplantation in order to exploit the graft–versus myeloma effect provides an alternative for patients who have a compatible donor. Combining all of these modalities with the new drugs developed few years ago (thalidomide, bortezomib, revlimid), we hope that MM will become a manageable chronic disease and perhaps a curable disease at least for 30% to 40% of the patients.
Key words. Stem cell transplantation. Multiple mieloma.
RESUMEN
El mieloma múltiple (MM) es la segunda patología oncohematológica más frecuente. En Estados Unidos son diagnosticados anualmente 14,000 casos nuevos. En las últimas cuatro décadas el tratamiento estándar ha sido la combinación de melfalán y prednisona. Con este régimen raramente se logran remisiones completas y 50% de los pacientes no responden a esta terapia. Se han hecho intentos de mejorar los resultados combinando poliquimioterapia, pero la sobrevida global ha sido la misma. Al aplicar quimioterapia a dosis altas y rescate con trasplante de células hematopoyéticas se logra un mayor porcentaje de remisiones completas, asimismo, una mayor sobrevida libre de enfermedad y sobrevida global. La purga de células hematopoyéticas, selección positiva, intensificación del régimen de acondicionamiento con otras drogas o irradiación corporal total, no han demostrado utilidad en términos de sobrevida global. El doble trasplante autólogo de células hematopoyéticas parece ser una opción útil para hospitales que cuentan con la infraestructura y los recursos necesarios para realizarlo. En un futuro, la investigación deberá incluir el uso del mejor régimen de inducción a la remisión más doble trasplante autólogo y terapia de mantenimiento (talidomida o vacunas con células dendríticas), con la finalidad de al menos prolongar la remisión completa. El uso del trasplante alogénico no mieloablativo para provocar el efecto injerto contra mieloma parece una buena alternativa para los pacientes que tengan donador. Al combinar todas estas modalidades de tratamiento con las nuevas drogas desarrolladas en los últimos años (talidomida, bortezomid, revlimid), se espera que en un futuro el MM se convierta en una enfermedad crónica y curable en al menos 30 a 40% de los enfermos.
Palabras clave. Trasplante de células hematopoyéticas. Mieloma múltiple.
INTRODUCCIÓN
El mieloma múltiple (MM) es la segunda patología oncohematológica más común cuya incidencia es de cuatro por cada 100,000 habitantes por año. Sin tratamiento, la expectativa de vida de los pacientes es menor a un año. La introducción de agentes alquilantes (melfalán) en combinación con glucocorticoides (prednisona) hace más de 40 años, ha ofrecido una buena opción terapéutica paliativa, con resolución de los síntomas y signos propios de la enfermedad y control de la misma durante aproximadamente 18 meses y una expectativa de vida en promedio de 30 meses.1 Posteriormente se intentó añadir otras drogas que no tienen resistencia cruzada con este esquema, lográndose mejorar los índices de respuesta antitumoral, pero sin incrementar la sobrevida global.2
A inicios de la década de los 80, McElwain y Powles reportaron por primera vez que dosis altas–intermedias de melfalán I.V. podían revertir la resistencia a drogas e inducir remisión completa en pacientes con MM previamente tratados.3 El mayor problema observado en este estudio fue que el régimen era excesivamente tóxico a la médula ósea y de ahí se tomó la idea para que en estudios posteriores se utilizara el rescate con médula ósea autóloga.
El melfalán es un agente alquilante bifuncional rápidamente hidrolizado a su forma inactiva en el plasma, con un tiempo medio de eliminación (t1/2β) de 30 a 120 minutos, por lo tanto, su vía de eliminación no depende del riñón, motivo por el cual se puede utilizar incluso en pacientes con falla renal.4 Este tiempo corto de eliminación permite su uso 24 horas antes de la infusión de las células hematopoyéticas sin riesgo de afectarlas. Utilizado en dosis intermedias (70–100 mg/m2), se requiere de soporte con factor estimulante de colonias de granulocitos (G–CSF)5 y dosis mayores a 100 mg/m2 requieren de soporte con trasplante de células hematopoyéticas para que la mortalidad relacionada con el tratamiento no sea mayor a 5%.6 En protocolos especiales se ha intentado usar el melfalán incluso a dosis de 220–240 mg/m2, siendo la toxicidad gastrointestinal y mucositis las principales complicaciones en estos casos.7
TRASPLANTE AUTÓLOGO DE CÉLULAS HEMATOPOYÉTICAS
El primer estudio aleatorizado en el que se comparó el tratamiento con poliquimioterapia y trasplante autólogo de células hematopoyéticas (TACH) fue el que realizó el Grupo Francés de Mieloma (IFM) en donde se demostró la superioridad del trasplante, obteniéndose mejores índices de respuestas (38 vs. 14%, p < 0.001) y mejor supervivencia libre de evento (p = 0.01) y supervivencia global (p = 0.03).8,9 Asimismo, el Grupo Británico de Investigación en Mieloma demostró mejor sobrevida para el grupo de TACH.10 También Palumbo, et al.11 compararon melfalán y prednisona contra dos cursos de melfalán 100 mg/m2 y TACH y demostraron mejores índices de remisión completa, sobrevida global y sobrevida libre de evento con TACH. Sin embargo, existen dos estudios (Fermand12 y Bladé13) en donde la sobrevida global con poliquimioterapia ha sido similar a la lograda con TACH. El estudio español de Bladé, et al. difiere de los previos en que solamente trasplantaron pacientes en los que se lograba remisión con el esquema de inducción, por lo cual ellos sugieren que el efecto benéfico del TACH solamente se observa en pacientes que no responden a esquemas de inducción. El Panel de Expertos en Mieloma Múltiple de la Sociedad Americana de Trasplante de Médula Ósea y Sangre Periférica (ASBMT) recomienda con nivel de evidencia 1, el uso del TACH en casos de reciente diagnóstico, en donde habitualmente se emplea inducción a la remisión con VAD, dexametasona o talidomida+dexametasona, posteriormente la movilización de células hematopoyéticas a sangre periférica y el TACH.14 Es importante señalar que en algunos centros la mortalidad relacionada con el TACH es de 1–2% y que 50% de los trasplantes pueden ser realizados incluso en forma ambulatoria.
Existen algunos estudios en los que después de lograr la remisión de la enfermedad se pueden extraer células hematopoyéticas para congelarlas para su uso posterior cuando el paciente tenga recaída de la enfermedad. Con esta estrategia se ha demostrado que no existe diferencia en sobrevida global en comparación con los pacientes trasplantados al inicio de la enfermedad.15 Sin embargo, existen varios inconvenientes al utilizar este abordaje:
1. El uso de quimioterapia por tiempo indefinido.
2. El riesgo de síndrome mielodisplásico y/o leucemia aguda con el uso prolongado de alquilantes.
3. Se ha demostrado mejor calidad de vida y menos complicaciones cuando se realiza el trasplante en forma temprana.16
¿Cuál es la mejor forma de colectar células hematopoyéticas para TACH en mieloma múltiple: médula ósea o sangre periférica?
Actualmente es preferible utilizar las células hematopoyéticas de sangre periférica, ya que el injerto (sobre todo de plaquetas) es más rápido y, en teoría, existe menor contaminación de células tumorales.17 Además, se ha demostrado que el utilizar células obtenidas por aféresis reduce la toxicidad relacionada con el trasplante.18
¿Cuál es el mejor método para movilizar células hematopoyéticas de la médula ósea hacia la sangre periférica en mieloma múltiple?
Existen dos métodos principales para la movilización de células hematopoyéticas. El más utilizado es combinar quimioterapia (ciclofosfamida 4–6 g/m2) más G–CSF 10 µg/kg y el otro es utilizar únicamente G–CSF sin quimioterapia. Con el uso de la ciclofosfamida se obtiene la ventaja de reducción de la carga tumoral de la enfermedad previo al trasplante, sin embargo, se asocia con mayor toxicidad, mayor costo (internar al paciente más de dos semanas) y algunos estudios han demostrado que no mejora la sobrevida global.19
¿Es útil la purga de las células hematopoyéticas o la selección positiva de células CD34+?
En la mayoría de los casos las células hematopoyéticas extraídas del paciente, en mayor o menor grado, se encuentran contaminadas con células tumorales, motivo por el cual al igual que en otras enfermedades, se ha estudiado el papel que juega la purga de las células hematopoyéticas en el TACH para pacientes con MM. Hasta el momento no se ha demostrado alguna ventaja en sobrevida libre de enfermedad o sobrevida global con el uso de selección positiva de células CD34+.20 Algunas técnicas nuevas de purga como el aislamiento de células hematopoyéticas basados en la expresión por estas células de la enzima aldehído–deshidrogenasa (ALDH)21 merecen un estudio individual.
¿Cuál es el mejor régimen de acondicionamiento usado en trasplante autólogo en pacientes con mieloma múltiple?
El melfalán I.V. solo o combinado con irradiación corporal total (ICT) es el esquema más utilizado en TACH en MM. Cuando se combina con ICT se reduce la dosis de melfalán a 140 mg/m2, sin embargo, este esquema produce mayor mortalidad relacionada con el tratamiento sin ningún beneficio en el índice de respuestas22 por lo que hoy en día el esquema más aceptado es melfalán I.V. (200 mg/m2). En México y en la mayor parte de Latinoamérica no existe hasta la fecha el melfalán I.V. y en pocos centros se tiene disponible la ICT, por lo que ha sido necesaria la utilización de esquemas basados en melfalán vía oral en combinación con BCNU y etopósido (BEM) o bien recurrir a la ciclofosfamida, busulfán y etopósido,23 esquema que hemos utilizado en nuestro servicio con resultados parecidos a los observados en todo el mundo, los cuales se muestran más adelante.
Doble trasplante autólogo
Con la idea de mejorar los resultados del TACH, Harousseau, et al. fueron los primeros en reportar el doble trasplante autólogo en 97 pacientes.24 Después del primer trasplante usando melfalán 140 mg/ m2, las respuestas global y completa fueron de 71 y 25%, respectivamente, y la mortalidad relacionada con el trasplante de 8%. De los 69 pacientes que respondieron al primer trasplante, en sólo 35 se pudo realizar el segundo. La mitad de los pacientes recibieron nuevamente las mismas dosis de melfalán y la otra mitad melfalán más ICT. Al final, 24 pacientes (69%) estaban en remisión completa y en ellos la sobrevida global media fue de 41 meses.
Barlogie, et al. 25 investigaron la utilidad de la "terapia total I" que incluía inducción a la remisión con 3–4 ciclos de VAD, movilización con ciclofosfamida + G–CSF, doble TACH y mantenimiento con interferón alfa. Observaron un aumento progresivo en la frecuencia de remisión completa de 15% después de inducción, 26% después del primer trasplante y 41% posterior al segundo. La supervivencia libre de eventos y la global fue de 43 meses y 68 meses, respectivamente.
Posteriormente el Grupo SWOG de Estados Unidos reportó los resultados de un análisis pareado comparando doble trasplante contra terapia estándar. El doble trasplante mostró superioridad en sobrevida libre de eventos (49 meses vs. 22 meses; p = 0.0001) y sobrevida global (> 62 meses vs. 48 meses; p = 0.001) 26.
El grupo Francés para el Estudio de Mieloma Múltiple (IFM) realizó un estudio entre 1994 y 1997 donde incluyó 405 pacientes con diagnóstico reciente, a los que se les administró VAD como quimioterapia de inducción. Posteriormente se aleatorizaron dos veces, primero para recibir uno vs. dos trasplantes y luego para recibir células de la médula ósea o de la sangre periférica. La supervivencia media libre de eventos fue superior con doble trasplante (37 meses vs. 31 meses; p = 0.03), así como la sobrevida global (58 meses vs. 50 meses; p = 0.02).27 Parece ser que sólo los pacientes en quienes no se logra una respuesta completa después del primer trasplante son los que se benefician del segundo.
Terapia total II
Una vez que se demostró que la talidomida es efectiva en pacientes con MM en fase avanzada,28 se han iniciado estudios usando esta droga durante la inducción a la remisión. Con base en esto, la terapia total II incluye un régimen de inducción más intenso en donde se combina talidomida con ciclos alternos en el siguiente orden: (VAD ]vincristina, adriamicina y dexametasona], DCEP ]dexametasona, ciclofosfamida, etopósido y cisplatinum], CAD ]ciclofosfamida, adriamicina y dexametasona], DCEP) seguido de dos TACH utilizando melfalán 200 mg/m2. Posteriormente se aplica un año de quimioterapia de consolidación con DCEP o DCEP alternando con CAD y como mantenimiento interferón alfa.29 Después de los dos trasplantes la frecuencia de remisión completa + remisión casi completa fue de 65% comparado con 41% en la terapia total I. La mortalidad relacionada con el trasplante fue de 1% y a dos años 78% de los pacientes se encuentran libres de evento y 83% vivo. En este estudio y en el previo (terapia total I) se encontraron dos factores de mal pronóstico que son: anormalidad en el cromosoma 13 y DHL elevada. La sobrevida libre de eventos y la sobrevida global en los pacientes con estos factores de mal pronóstico (25% de los casos) fue de 50 y 60%, respectivamente. En este último grupo de enfermos de alto riesgo no existen diferencias entre los resultados de la terapia total I y la II.
TRASPLANTE SINGÉNICO
Gahrton, et al. reportaron retrospectivamente los resultados del Registro Europeo de Trasplante de Médula Ósea comparando en forma pareada 25 trasplantes singénicos con 125 trasplantes autólogos. Los pacientes con trasplante singénico tuvieron una mejor sobrevida global (73 meses vs. 44 meses), mejor sobrevida libre de progresión (72 meses vs. 25 meses; p = 0.008) y menor riesgo de recaída (36 vs. 78% a 48 meses; p = 0.009). De la misma forma, se obtuvieron mejores resultados con trasplante singénico que con alogénico. La mortalidad relacionada con el trasplante fue 8%.30
TRASPLANTE ALOGÉNICO
Este tipo de trasplante tiene algunas ventajas sobre el auto logo:
1. Las células del donador habitualmente son normales y no contienen células tumorales, por lo que la posibilidad de recaída de la enfermedad es menor.
2. Las células transfundidas son inmunológicamente competentes y ejercen un "efecto injerto contra mieloma". Sin embargo, su principal problema es la alta toxicidad del procedimiento, enfermedad injerto contra hospedero (GVHD) e infecciones oportunistas (principalmente neumonía) y como consecuencia una elevada mortalidad relacionada con el trasplante que oscila entre 40 y 50%.31 El porcentaje de remisiones completas obtenidas con el uso del trasplante alogénico en pacientes con MM es de 22 a 67% (en 50% de ellos se observa remisión molecular) y algunos de estos pacientes logran la curación.32 La sobrevida libre de evento y la sobrevida global a cinco años son de 14 y 22%, respectivamente.
Otra limitante del trasplante alogénico es la falta de donador. Tan sólo 20–25% de los pacientes tiene un donador compatible y, por otro lado, muchos de los pacientes tienen edad avanzada o alguna patología concomitante, lo cual contraindica el trasplante o incrementa el riesgo de GVHD y de otras complicaciones. Una estrategia para disminuir la morbimortalidad observada con este tipo de trasplante es la eliminación de los linfocitos T de las células del donador, lo cual disminuye la frecuencia de GVHD.33
Actualmente el trasplante alogénico convencional (mieloablativo) no se recomienda en MM.
Infusión de linfocitos del donador original
Tricot, et al.34 demostraron clínicamente que el efecto injerto contra mieloma era una realidad al tratar a 13 pacientes con infusión de linfocitos del donador original que habían recaído posterior a trasplante alogénico. De los 13 pacientes, ocho respondieron en forma favorable y en cuatro se logró remisión completa. Posteriormente, en un grupo mayor de enfermos y con un periodo de seguimiento mayor, Lokhorst, et al.35 reportaron algunos factores que se correlacionan con buena respuesta a la infusión de linfocitos:
• Dosis de células T infundidas > 1x108/kg.
• Presentar buena respuesta a la terapia de reinducción.
• Enfermedad sensible a la quimioterapia antes del trasplante.
Salama, et al.36 estudiaron la efectividad de la infusión de linfocitos en 25 enfermos de 15 centros de Estados Unidos. Diez pacientes respondieron en forma favorable (cuatro con remisión completa y seis con remisión parcial). Se observó GVHD aguda en 13 de 25 pacientes (52%) y GVHD crónica en 11 de 21 pacientes (52%) evaluables. En la mayoría de los estudios realizados se ha observado asociación entre la presencia de GVHD y la respuesta antitumoral.
Trasplante alogénico no mieloablativo (TNM)
Otra estrategia para disminuir la toxicidad observada con el uso de trasplante alogénico convencional, es utilizar regímenes de quimioterapia de acondicionamiento no mieloablativos. Einsele, et al.37 estudiaron a 22 pacientes con MM quienes habían recibido un TACH previo y habían recaído. Se les trató con TNM y se observó quimerismo total en leucocitos en 20 de 22 enfermos estudiados al día +30 posterior al trasplante. Ochos pacientes desarrollaron GVHD aguda y siete GVHD crónica. La mortalidad relacionada con el trasplante fue de 23%. En 13 de 22 pacientes (59%) se logró remisión completa o parcial y la supervivencia media libre de eventos fue de 24 meses. En este estudio hubo dos variables asociadas con una pobre supervivencia libre de enfermedad:
1. Refractariedad a la quimioterapia previa al trasplante.
2. Ausencia de GVHD crónica.
Badros, et al.38 reportaron su experiencia en 31 pacientes, de los cuales 19 tuvieron una buena respuesta al tratamiento, incluidos 12 pacientes (39%) en remisión completa. Dieciocho pacientes (58%) desarrollaron GVHD aguda y diez (32%) GVHD crónica. La supervivencia media libre de evento y la sobrevida media global fueron de 15 meses. El mejor pronóstico lo tuvieron aquellos pacientes que habían recibido un solo trasplante autólogo previamente. Esta experiencia inicial con TNM en MM fue la base para crear una nueva estrategia utilizada sobre todo en pacientes de mal pronóstico (alteración de cromosoma 13 y (32 microglobulina elevada). Inicialmente se realiza un trasplante autólogo para reducir la carga tumoral y después se lleva a cabo el TNM con la idea de inducir efecto de injerto contra mieloma. Kroger, et al.39 reportaron sus resultados en 17 enfermos tratados con trasplante autólogo y luego TNM (utilizando fludarabina–melfalán y globulina antitimocito). Trece pacientes (76%) estaban vivos y doce (70%) libres de progresión tumoral después de 13 meses del último trasplante con una mortalidad relacionada con el trasplante de 11%. Asimismo, Maloney, et al.40 utilizaron una estrategia similar en 54 pacientes y reportaron una mortalidad relacionada con el trasplante de 16%, GVHD aguda en 38% y GVHD crónica en 46%. En 57% de los pacientes se logró remisión completa de la enfermedad y la respuesta global se observó en 83%. La sobrevida global fue de 78% a 18 meses. En un futuro, conoceremos los resultados de estudios comparativos entre doble trasplante autólogo contra trasplante autólogo + TNM.
TRATAMIENTO DE MANTENIMIENTO DESPUÉS DE TRASPLANTE
En la mayoría de los centros que realizan trasplante en MM el medicamento más utilizado como tratamiento de mantenimiento es el interferón alfa. Cunningham, et al.41 realizaron un estudio aleatorizado en 85 pacientes en donde se usó el interferón alfa a dosis de 3 MU/m2 tres veces por semana y en el grupo control no se administró tratamiento. La sobrevida media libre de progresión en el grupo de interferón fue de 46 meses comparada con 26 meses del grupo control (p < 0.02), sin embargo, posterior a 77 meses de seguimiento, no hubo diferencia en la sobrevida global. Por otro lado, el Grupo Europeo de Trasplante de Médula Ósea (EBMTR)42 comparó en forma pareada a 473 pacientes que habían recibido interferón como mantenimiento contra 419 pacientes sin tratamiento. La sobrevida global fue mejor en el grupo de interferón (78 meses vs. 47 meses; p = 0.007).
Otras formas de inmunoterapia que pudieran ser útiles en el mantenimiento son la terapia con anticuerpos monoclonales y las vacunas contra el MM.
En la superficie de las células del MM, solamente 25% de los pacientes expresan la molécula CD20 y con el uso de rituximab, se ha demostrado respuesta antitumoral en menos de 30% de los enfermos.43 Otra molécula de interés es CD52, la cual se encuentra expresada en la mayoría de las células B y T. Las células de MM pueden expresar este antígeno,44,45 por lo que el anticuerpo monoclonal contra CD52 (alentuzumab–CamPath–lH) pudiera ser de utilidad en algunos casos.
En trasplante alogénico, se pueden extraer células de MM del paciente y aplicarlas al donador para que de esta forma éste produzca células T alorreactivas capaces de destruir a las células tumorales selectivamente.46 Otra forma de vacuna es la de células dendríticas. Estas células son las que tienen mayor capacidad y eficiencia en cuanto a presentación de antígeno se refiere y cuando se pulsan con antígenos derivados de las células tumorales, pueden ser capaces de generar una respuesta de células T específica para ese antígeno.47,48
Tratamiento de recaída posterior a trasplante en mieloma múltiple
Un paciente que recae posterior a trasplante es un paciente de mal pronóstico, sin embargo, hoy en día, con los nuevos medicamentos que se encuentran ya disponibles en el comercio (talidomida, bortezomib) o en etapa de investigación (CC–5013 revlimid) el pronóstico es mejor, llegando a responder aproximadamente 30% de ellos.49,50
EXPERIENCIA EN EL HOSPITAL DE ESPECIALIDADES CENTRO MÉDICO LA RAZA, IMSS
Trasplante autólogo
De febrero de 1995 a agosto de 2004 realizamos 27 trasplantes autólogos en pacientes con MM, todos ellos de células hematopoyéticas de sangre periférica. Veintidós pacientes fueron hombres y cinco mujeres, con una media de edad de 47 años (28–65 años). Veintitrés pacientes (85%) se encontraban en la. o 2a. remisión parcial al momento del trasplante y cuatro (15%) tenían actividad tumoral. El intervalo entre el diagnóstico y el TACH fue de 18 meses (6–98) y la media de ciclos recibidos de quimioterapia antes del trasplante fue de 8 (2–19). En todos los pacientes se aplicó el esquema de acondicionamiento BEM (BCNU 450 mg/m2, etopósido 1,600 mg/m2 y melfalán oral 140 mg/m2). Veintidós pacientes (81%) recibieron G–CSF posterior al trasplante. La cantidad de células mononucleares aplicada en promedio fue 2.9 x 108/kg (0.7–7.5), y de CD34 5.2 x 106/kg (0.2–27.2). El injerto en neutrófilos, eritrocitos y plaquetas se observó en promedio a los días 13 (8–22), 16 (9–33) y 15 (7–33), respectivamente. La media de transfusiones después del trasplante fue de dos (0–6) concentrados eritrocitarios y de cuatro (0–13) donaciones de plaquetas por aféresis.
• Complicaciones. La complicación más frecuente fue la infección bacteriana en 42% de los pacientes, predominando la infección del catéter central en la mayoría de los casos. 8% tuvo infección por aspergilus durante los primeros dos meses del tratamiento. Otra complicación frecuente fue la mucositis (grado III–IV en 32% de los casos). La mediana de sobrevida libre de enfermedad fue de 20 meses (IC 0.5–40.8) (Figura 1) y la mediana de sobrevida global fue de 34 meses (IC 23.6–44.4) (Figura 2). El análisis de regresión de Cox mostró tres variables predictoras de mal pronóstico:


1. Actividad tumoral al momento del trasplante (RR 1.95, p < 0.02).
2. Infusión de células CD34 + menor a 4x106/kg (RR 1.54, p< 0.04).
3. Presencia de infección postrasplante (RR 2.1, p < 0.01).
Trasplante alogénico
De noviembre de 1991 a octubre de 2002 se realizaron 10 trasplantes alogénicos en nueve hombres y una mujer. La edad promedio fue de 35 años (20–48). Siete pacientes se encontraban con actividad tumoral al momento del trasplante y en dos pacientes el donador no era totalmente compatible (5/6 antígenos). Cinco trasplantes fueron de médula ósea y cinco de sangre periférica (tres de éstos TNM). El régimen de preparación fue BuCy en siete pacientes y busulfán–fludarabina en tres. En la mitad de los pacientes se usó G–CSF posterior al trasplante. La cantidad promedio de células infundidas fue de: células mononucleares 2.0 x 108/kg (0.6–4.4) y CD34 5.2 x 106/kg (1.7–9.0). El injerto de neutrófilos, eritrocitos y plaquetas se observó en promedio en los días 12 (10–16), 12 (0–23) y 10 (0–19), respectivamente. Hubo necesidad de utilizar en promedio tres (0–15) concentrados eritrocitarios y seis (0–21) unidades de plaquetas de aféresis. Tres (30%) pacientes tuvieron GVHD aguda, sólo uno de ellos grado IV y en cuatro de ocho (50%) de los pacientes evaluables se observó GVHD crónica. Un paciente tuvo infección bacteriana y tres (30%) aspergilosis pulmonar. Otro paciente tuvo enfermedad grave venooclusiva del hígado. Como se muestra en la figura 3, el 30% de los pacientes se encuentran vivos a cuatro años.
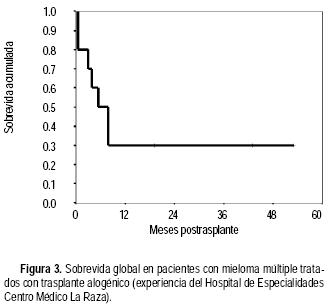
En conclusión, el trasplante de células hematopoyéticas es una opción terapéutica con la que se pueden obtener mejores resultados en supervivencia libre de enfermedad y supervivencia global, en comparación con el tratamiento con quimioterapia convencional en los pacientes con MM. El doble trasplante autólogo es una buena opción terapéutica, sin embargo, hacen falta estudios de farmacoeconomía y de calidad de vida para que este tipo de tratamiento sea aceptado de manera universal. El trasplante alogénico convencional está contraindicado en el tratamiento de esta enfermedad, no obstante, el trasplante alogénico no mieloablativo pudiera ser una buena opción terapéutica, sobre todo cuando se combina con trasplante autólogo. En México, es posible reproducir los resultados obtenidos en pacientes con MM con los diversos tipos de trasplante.
Es posible que la utilización combinada de drogas de reciente uso en MM (talidomida, bortezomib, revlimid) con trasplante de células hematopoyéticas, mejoren los resultados de este último y tal vez en algunos pacientes se logre al fin la curación de esta enfermedad.
REFERENCIAS
1. Bergsagel DE, Sprage CC, Austin C, Griffith KM. Evaluation of new chemotherapeutic agents in the treatment of multiple myeloma: IV. L–phenylalanine mustard (NSC–8806). Cancer Chemother Rep 1962; 21: 87. [ Links ]
2. Myeloma Trialists' Collaborative Group. Combination chemotherapy versus melphalan plus prednisone as treatment for multiple myeloma: an overview of 6,633 patients from 27 randomized trials. J Clin Oncol 1998; 16: 3832–42. [ Links ]
3. McElwain TJ, Powles RL. High–dose intravenous melphalan for plasma–cell leukemia and myeloma. Lancet 1983; 2: 822–4. [ Links ]
4. Tricot G, Alberts DS, Johnson C. Safety of autotransplants with high–dose melphalan in renal failure: a pharmacokinetic and toxicity study. Clin Cancer Res 1996; 2: 947–52. [ Links ]
5. Vela–Ojeda J, García–Ruiz Esparza MA, Rosas–Cabral A, Padilla–González Y, García–Chávez J. Intermediate doses of melphalan and dexamethasone are better than vincristine, adryamicin, and dexamethasone (VAD) and polychemotherapy for the treatment of primary plasma cell leukemia. Ann Hematol 2002; 81: 362–7. [ Links ]
6. Jagannath S, Vesole DH, Tricot G. Hemopoietic stem cell transplants for multiple myeloma. Oncology 1994; 8: 89–103. [ Links ]
7. Moreau P, Milpied N, Mahe B. Melphalan 200 mg/m2 followed by peripheral blood stem cell transplantation in 27 patients with advanced multiple myeloma. Bone Marrow Transplant 1999; 23: 1003–6. [ Links ]
8. Attal M, Harousseau JL, Stoppa AM. Prospective randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med 1996; 355: 91–7. [ Links ]
9. Attal M, Harousseau JL. Randomized trial experience of the Intergroup Francophone du Myelome. Semin Hematol 2001; 38: 226–30. [ Links ]
10. Child JA, Morgan GJ, Davies FE. High–dose chemotherapy with hematopoietic stem–cell rescue for multiple myeloma. N Engl J Med 2003; 348: 1875–83. [ Links ]
11. Palumbo A, Bringhen S, Petrucci MT. A prospective randomized trial of intermediate dose melphalan (100 mg/m2) vs. oral melphalan/prednisone. Blood 2003; 102: 984a. [ Links ]
12. Fermand JP, Ravaud P, Kateshian S. High–dose therapy (HDT) and autologous blood stem cell (ABSC) transplantation vs. conventional therapy in multiple myeloma (MM): results of a randomized trial in 190 patients 55–65 years of age. Blood 1999; 94: 396a. [ Links ]
13. Bladé J, Sureda A, Ribera JM. High dose therapy autotransplantation/intensification versus continued conventional chemotherapy in multiple myeloma patients responding to initial chemotherapy: definitive results from PETHEMA after a median follow–up of 66 months. Blood 2003; 102: 42a. [ Links ]
14. Hahn T, Wingard JR, Anderson KC, Bensinger WI, Berenson JR, Brozeit G, Carver JR, Kyle RA, McCarthy PL. The role of cytotoxic therapy with hematopoietic stem cell transplantation in the therapy of multiple myeloma: An evidence–based review. Biol Blood Marrow Transplant 2003; 9: 4–37. [ Links ]
15. Fermand JP, Ravaud P, Chevret S. High–dose therapy and autologous peripheral blood stem cell transplantation in multiple myeloma: up–front or rescue treatment? Results of a multicenter sequential randomized clinical trial. Blood 1998; 92: 3131–6. [ Links ]
16. Hawkins T, Horvat N, Rawling C. An incremental response to high–dose therapy in multiple myeloma. Bone Marrow Transplant 1996; 17: 929–35. [ Links ]
17. Harousseau JL, Attal M, Divine M. Comparison of autologous bone marrow transplantation and peripheral blood stem cell transplantation after first remission induction treatment in multiple myeloma. Bone Marrow Transplant 1995; 15: 963–9. [ Links ]
18. Vescio RA, Han EJ, Schiller GJ. Quantitative comparison of multiple myeloma tumor contamination in bone marrow harvest and leukapheresis autograft. Bone Marrow Transplant 1996; 18: 103–10. [ Links ]
19. Alegre A, Tomas JF, Martinez–Chamorro C. Comparison of peripheral blood progenitor cell mobilization in patients with multiple myeloma: high–dose cyclophpsphamide plus GM–CSF vs. G–CSF alone. Bone Marrow Transplant 1997; 20: 211–17. [ Links ]
20. Galimberti S, Morabito F, Guerrini F. Peripheral blood stem cell contamination evaluated by a highly sensitive molecular method fails to predict outcome of autotransplanted multiple myeloma patients. Br J Haematol 2003; 120: 405–12. [ Links ]
21. Fallón P, Gentry T, Balber AE. Mobilized peripheral blood SS–CIoALDHbr cells have the phenotypic and functional properties of primitive haematopoietic cells and their number correlates with engraftment following autologous transplantation. Br J Haematol 2003; 122: 99–108. [ Links ]
22. Moreau P, Facon T, Attal M, Hulin C, Michalet M, Maloisel F, Sotto JJ. Comparison of 200 mg/m2 melphalan and 8 Gy total body irradiation plus 140 mg/m2 melphalan as conditioning regimens for peripheral blood stem cell transplantation in patients with newly diagnosed multiple myeloma: final analysis of the Intergroupe Francophone du Myélome 9502 randomized trial. Blood 2002; 99: 731–5. [ Links ]
23. Cogle CR, Moreb JS, Leather HL. Busulfan, cyclophosphamide, and etoposide as conditioning for autologous stem cell transplantation in multiple myeloma. Am J Hematol 2003; 73: 169–75. [ Links ]
24. Harousseau JL, Milpied N, Laporte JP. Double–intensive therapy in high–risk multiple myeloma. Blood 1992; 79: 2827–33. [ Links ]
25. Barlogie B, Jagannath S, Desikan KR. Total therapy with tandem transplants for newly diagnosed multiple myeloma. Blood 1999; 93: 55–65. [ Links ]
26. Barlogie B, Jagannath S, Vesole DH. Superiority of tandem autologous transplantation over standard therapy for previously untreated multiple myeloma. Blood 1997; 89: 789–93. [ Links ]
27. Attal M, Harousseau JL, Facon T. Single versus double autologous stem cell transplantation for multiple myeloma. N Engl J Med 2003; 349: 2495–2502. [ Links ]
28. Singhal S, Metha J, Desikan R. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341: 1565–71. [ Links ]
29. Barlogie B, Zangari M, Spencer T. Thalidomide in the management of multiple myeloma. Semin Hematol 2001; 38: 250–9. [ Links ]
30. Gahrton G, Svensson H, Bjorkstrand B. Syngeneic transplantation in multiple myeloma: a case matched comparison with autologous and allogeneic transplantation. European Group for Blood and Marrow Transplantation. Bone Marrow Transplant 1999; 24: 741–5. [ Links ]
31. Bensinger W, Maloney D, Storb R. Allogeneic hematopoietic cell transplantation for multiple myeloma. Semin Hematol 2001; 38: 242–9. [ Links ]
32. Gahrton G, Svensson H, Cavo M. Progress in allogeneic bone marrow and peripheral blood stem cell transplantation for multiple myeloma: a comparison between transplants performed 1983–93 and 1994–98 at European Group for Blood and Marrow Transplantation Centres. Br J Haematol 2001; 113: 209–16. [ Links ]
33. Lokhorst HM, Segreen CM, Verdonk LE. Partially T cell depleted allogeneic stem–cell transplantation for first line treatment of multiple myeloma: a prospective evaluation of patients treated in the phase III study HOVON 24 MM. J Clin Oncol 2003; 21: 1728–33. [ Links ]
34. Tricot G, Vesole DH, Jagannath S, Hilton J, Munshi N, Barlogie B. Graft versus myeloma effect: proof of principle. Blood 1996; 87: 1196–8. [ Links ]
35. Lokhorst HM, Schattemberg A, Cornelissen JJ, Van Oers MH, Fibbe W, Russel I, Donk NW, Verdonck LF. Donor lymphocyte infusions for relapsed multiple myeloma after allogeneic stem cell transplantation: predictive factors for response and long term outcome. J Clin Oncol 2000; 18: 3031–7. [ Links ]
36. Salama M, Nevill T, Marcellus D. Donor leukocyte infusions for multiple myeloma. Bone Marrow Transplant 2000; 26: 1179–84. [ Links ]
37. Einsele H, Schafer HJ, Hebart H. Follow–up of patients with progressive multiple myeloma undergoing allografts after reduced intensity conditioning. Br J Haematol 2003; 121: 411–18. [ Links ]
38. Badros A, Barlogie B, Siegel E. Improved outcome of allogeneic transplantation in high–risk multiple myeloma patients after non–myeloablative conditioning. J Clin Oncol 2002; 20: 1295–1303. [ Links ]
39. Kroger N, Schwerdtfeger R, Kiehl M. Autologous stem cell transplantation followed by a dose–reduced allograft induces high complete remission rate in multiple myeloma. Blood 2002; 100: 755–60. [ Links ]
40. Maloney DG, Molina AJ, Sahebi F. Allografting with non–myeloablative conditioning following cytoreductive autografts for the treatment of patients with multiple myeloma. Blood 2003; 102: 3447–54. [ Links ]
41. Cunningham D, Powles R, Malpas J, Raje N, Milan S, Viner C, Montes A. A randomized trial of maintenance interferon following high–dose chemotherapy in multiple myeloma: long–term follow–up results. Br J Haematol 1998; 102: 495–502. [ Links ]
42. Mandelli F, Marcus R, Boogaerts M, Alegre A, Remes K, Cornelissen JJ, Blade J, Lenhoff S. Alpha–interferon maintenance treatment is associated with improved survival after high–dose treatment and autologous stem cell transplantation in patients with multiple myeloma: a retrospective registry study from the European Group for Blood and Marrow Transplantation (EBMT). Bone Marrow Transplant 2001; 27: 511–15. [ Links ]
43. Treon SP, Pilarski LM, Belch AR. CD20–directed serotherapy in patients with multiple myeloma: biologic considerations and therapeutic applications. J Immunother 2002; 25: 72–81. [ Links ]
44. Kumar S, Kimlinger TK, Lust JA. Expression of CD52 on plasma cells in plasma cell proliferative disorders. Blood 2003; 102: 1075–7. [ Links ]
45. Gasparetto C, Rooney R, Rooney B. Multiple myeloma cells express CD52 and are sensitive to treatment with Campath–1H. Blood 2002; 3210a. [ Links ]
46. Massaia M, Borrione P, Battaglio S. Idiotype vaccination in human myeloma: generation of tumor–specific immune response after high–dose chemotherapy. Blood 1999; 94: 673–83. [ Links ]
47. Kim SB, Baskar S, Kwak LW. In vitro priming of myeloma antigen–specific allogeneic donor T cells with idiotype pulsed dendritic cells. Leuk Lymphoma 2003; 44: 1201–8. [ Links ]
48. Titzer S, Christensen O, Manzke O. Vaccination of multiple myeloma patients with idiotype–pulsed dentritic cells: immunological and clinical aspects. Br J Haematol 2000; 108: 805–16 [ Links ]
49. Richardson PG, Schlossman RJ, Weller E. Immunomodulatory drug CC–5013 overcomes drug resistance and is well tolerated in patients with relapsed multiple myeloma. Blood 2002; 100: 3063–7. [ Links ]
50. Mitsiades N, Mitsiades CS, Richardson PG. The proteasome inhibitor PS–341 potentiates sensitivity of multiple myeloma cells to conventional chemotherapeutic agents: therapeutic applications. Blood 2003; 101: 2377–80. [ Links ]














