Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.57 no.2 Ciudad de México mar./abr. 2005
Artículo especial
Perspectivas de las células tallo en infartos del miocardio
Stem cell perspectives in myocardial infarctions
José Luis Aceves,* Abel Archundia,* Guillermo Díaz,* Araceli Páez,** Felipe Masso,** Martha Alvarado,* Manuel López,* Rocío Aceves,* Carlos Ixcamparij,* Adriana Puente,* Rafael Vilchis,* Luis Felipe Montaño***
* División de Cirugía Cardiaca y Cardiología, Hematología, Ecocardiografía y Medicina Nuclear del CMN 20 de Noviembre ISSSTE.
** Laboratorio de Biología Celular del Instituto Nacional de Cardiología Ignacio Chávez.
*** Laboratorio de Inmunología, Departamento de Bioquímica, Facultad de Medicina, UNAM.
ABSTRACT
Myocardial infarction is the leading cause of congestive heart failure and death in industrializated countries. The cellular cardiomyoplasty has emerged as an alternative treatment in the regeneration of infarted myocardial tissue. In animals' models, differents cellular lines such as cardiomyocites, sheletal myoblast, embryonic stem cells and adult mesenchymal stem cells has been used, resulting in an improvement in ventricular function and decrease in amount of infarted tissue. The first three cells line have disvantages as they are allogenics and are difficult to obtain. The adult mesenchymal stem cells are autologous and can be obtained throught the aspiration of bone marrow or from peripherical circulation, prior to stimulating with cytokines (G–CSF). The implantation in humans with recent and old myocardial infarction have shown improvements similar to those shown in animal models. These findings encourage the continued investigation in the mechanism of cellular differentiation and implantation metods in infarted myocardial tissue.
Key words. Stem cell. Myocardial infarctions. Cellular cardiomyoplasty.
RESUMEN
El infarto del miocardio es la principal causa de falla cardiaca y muerte en países industrializados. A la fecha, la cardiomioplastia celular ha emergido como una alternativa en la regeneración de infartos miocárdicos. En modelos animales se han utilizado diferentes líneas celulares como cardiomiocitos fetales, mioblastos de músculo esquelético, células tallo embrionarias y células tallo mesenquimales del adulto, con mejoría en la función ventricular y disminución del área de tejido infartado. Las tres primeras líneas celulares tienen desventajas porque son alogénicas y difíciles de obtener. Las células tallo mesenquimales del adulto son autólogas y se pueden obtener de aspirados de médula ósea o de la circulación periférica previa estimulación con citocinas (G–CSF). La implantación de estas células en seres humanos con infartos del miocardio recientes y antiguos han mostrado mejorías similares a los reportes con modelos animales. Estos hallazgos alientan a continuar la investigación clínica y básica en busca de los mecanismos de diferenciación celular y selección de vías de implantación, en tejido miocárdico infartado.
Palabras clave. Células tallo. Infartos miocárdicos. Cardiomioplastia celular.
INTRODUCCIÓN
Los infartos del miocardio son la principal causa de insuficiencia cardiaca y muerte en países industrializados, reportándose más de 400,000 nuevos casos por año en los Estados Unidos. En muchos casos, el tratamiento farmacológico es insuficiente, recurriéndose a procedimientos de revascularización como la angioplastia con implantación de dispositivos intracoronarios y hemoductos aortocoronarios mediante cirugía a corazón abierto. Estos procedimientos han demostrado su eficacia en la paliación o desaparición de los episodios de angina de pecho y en la mejora de la calidad de vida de los pacientes, sin embargo, estos procedimientos no están pensados para regenerar el tejido lesionado por el infarto.
Existe debate sobre la capacidad del cardiomiocito para regenerarse y si esto es posible debe ser insuficiente en casos de infartos amplios, pues la cicatriz secundaria al infarto del miocardio persiste durante toda la vida de la persona que lo ha sufrido, afectando su capacidad para desarrollar su actividad física.2,3 Por otro lado, se ha informado liberación de células tallo multipotenciales de la médula ósea a la circulación sanguínea, en el momento en que la persona sufre un infarto del miocardio, sugiriendo esto que el organismo intenta regenerar el corazón lesionado, aunque probablemente éstas llegan en cantidad insuficiente al sitio de la lesión.3 Barbash, en un modelo animal, indica que más de 90% de las células tallo que son aplicadas por infusión en sangre periférica son atrapadas en el lecho pulmonar y 5% en el bazo, llegando menos de 5% al tejido miocárdico infartado, contrastando con la aplicación de las células en el ventrículo izquierdo del corazón en donde más de 90% se alojan en el área lesionada.4
Si se considera lo anterior, en este documento hacemos una revisión de la literatura sobre las perspectivas y utilidad que tienen las diferentes líneas de células tallo mesenquimales en la regeneración de tejido miocárdico infartado, que en años recientes se le ha denominado como ventriculoplastia celular.
CÉLULAS TALLO
La explicación de las células tallo se puede realizar mejor en el contexto de la reproducción humana normal. Con la fertilización del ovocito se inicia la división celular con información genética suficiente para originar un feto, a estas células se les denomina tutipotenciales.5–7 Después de varios ciclos de división, estas células tutipotentes se diferencian formando el blastocisto, cuyas células centrales tienen la capacidad de originar diferentes órganos, excepto placenta y estructuras de nutrición del feto, a estas células se les denomina pluripotenciales.3–7 La especialización de estas células origina tres tipos de líneas celulares denominadas como multipotenciales: Endodérmicas, ectodérmicas y mesodérmicas, estas ultimas se diferencian en células hematopoyéticas, monocitos, condrocitos, adipositos, células endoteliales, musculares, etc.3–12
Alexander Fridestein, desde hace 30 años, caracterizó a las células del estroma de la médula ósea y en conjunto con Pittenger y Mackay describieron la capacidad de las células tallo mesenquimales para diferenciarse en tejido adiposo, muscular y óseo, discutiendo su aplicación en la regeneración de tejidos.13,14 Posteriormente muchos investigadores han caracterizado los diferentes tipos de líneas celulares y sus diferentes capacidades de diferenciación in vitro e in vivo, describiendo la plasticidad de la célula tallo mesenquimal para proliferar, implantarse en tejido vivo y diferenciarse en múltiples tipos celulares, propiciando así la posibilidad de regeneración de tejidos lesionados.2,16,17
De esta manera, se distinguen células tallo multipotenciales embrionarias y del adulto, las primeras se pueden aislar de embriones y del cordón umbilical de recién nacidos con la información necesaria para originar un feto.18–21 Diferentes autores han reportado en pacientes adultos, la existencia de células tallo multipotenciales en diferentes tejidos como el hígado, músculo estriado, músculo liso del intestino delgado y útero, cerebro y piel, considerándose que se encuentran en estos sitios en espera de muerte celular por apoptosis o lesión para iniciar la regeneración celular, sin embargo, también reportan que existe una gran movilización de células tallo de la médula ósea hacia la circulación sanguínea cuando se produce una lesión en algún órgano, suponiendo que esta movilización tiene la intención de hacer llegar estas células al área dañada para iniciar la regeneración tisular.17–29
Se define a la célula tallo multipotencial como aquella célula indiferenciada que puede proliferar, tiene capacidad de autorregenerarse y conserva su plasticidad para modularse en diferentes tejidos.21–24
CARDIOMIOPLASTIA CELULAR
La cardiomioplastia celular consiste en la implantación de células con capacidad de diferenciarse al tejido en donde se implantaron, sustituyendo a las células muertas, regenerando así el tejido dañado. Se han implantado en diferentes modelos animales, varios tipos de células, como cardiomiocitos fetales, mioblastos de músculo esquelético, células tallo multipotenciales embrionarias y células tallo multipotenciales.15
Los cardiomiocitos fetales pueden sobrevivir, proliferar y formar discos intercalados en el miocardio huésped, atenuando la dilatación y disfunción ventricular, así como el adelgazamiento del tejido infartado, promoviendo la angiogénesis mediante factores cardioprotectores como el factor de crecimiento endotelial vascular, sin embargo, el uso de estas células está limitado por ser alogénicos, además que son difíciles de obtener en cantidad suficiente.30–34
Los mioblastos esqueléticos funcionan como un precursor celular con la capacidad de proliferar y formar sincitio y finalmente formar nuevos miocitos esqueléticos, pero no cardiomiocitos. En modelos animales, la implantación de estas células en miocardio infartado ha mostrado disminuir la dilatación y adelgazamiento del área lesionada, mejorando la función global del ventrículo izquierdo. Sin embargo, también han mostrado una estimulación contráctil discordante con el resto de tejido miocárdico, manifestando su función con focos ventriculares ectópicos, incrementando así el riesgo de arritmias cardiacas.35–42
Las células progenituras endoteliales residen en la médula ósea, tienen la capacidad de producir neovascularización y son liberadas a la circulación después de un infarto del miocardio, tienen la ventaja de ser autólogas y no requieren de inmunosupresión. En modelos murinos, han mostrado su utilidad en la disminución de las dimensiones del infarto en la fase aguda, mejorando la función miocárdica, disminuyendo las alteraciones en la geometría y remodelación ventricular. Muy pocas células son capaces de diferenciarse en cardiomiocitos, por lo que su función de promover neovascularización es muy útil en infartos con tejido residual viable.43–52
Las células tallo embrionarias se encuentran en la médula ósea y en cordón umbilical de recién nacidos, son pluripotentes, con capacidad de diferenciarse en cualquier tipo de célula del organismo, incluso de formar nuevos organismos o fetos, pudiéndose obtener a partir de estas células embrionarias, clones de la especie donadora, por esto, es indispensable considerar aspectos éticos en su implantación. Actualmente se encuentra legislado a nivel mundial y son muy pocos los países en vías de desarrollo en donde se podrían utilizar estas células en investigación humana. En países desarrollados, en años recientes han iniciado actividades bancos de cordón umbilical para ser utilizados únicamente por la persona donadora en algún momento de su vida, con fines terapéuticos.53–57
Las células tallo mesenquimales están disponibles en la médula ósea y en la circulación sanguínea periférica, son multipotenciales, con capacidad de diferenciarse en tejido especializado, incluidos cardiomiocitos, células endoteliales y células de músculo liso.58–61 Si se utilizan células tallo mesenquimales autólogas no se requiere el uso de inmunosupresores. Su implantación en modelos animales ha mostrado su transformación a cardiomiocitos funcionales, disminuyendo el área de tejido infartado, manteniendo el grosor de la pared ventrículo, reduciendo la remodelación ventricular y mejorando la función contráctil del tejido dañado.62–65
Células tallo obtenidas de médula ósea, cultivadas sobre matrices de miocardio, se diferencian en cardiomiocitos y al agregar 5–azatidina al cultivo se ha logrado el latido sincrónico de las células diferenciadas.66,67 La implantación de cardiomiocitos funcionales se presenta como una alternativa interesante en la regeneración de tejido miocárdico infartado, sin embargo, se requiere de infraestructura de cultivos celulares y la cantidad de células que se podrían obtener posiblemente no serían suficientes para cubrir áreas amplias de miocardio dañado.
ENSAYOS CLÍNICOS
En años recientes, la cardiomioplastia celular ha sido considerada en la regeneración de tejido miocárdico dañado por infartos; este concepto consiste en el reemplazo o regeneración de cardiomiocitos dañados a través de:
1. Trasplante celular, que puede ser intentado mediante la implantación de células tallo multipotenciales directamente en el tejido miocárdico lesionado, para que se diferencien en cardiomiocitos funcionales y además promuevan la angiogénesis en el área infartada.15
2. Movilización de células tallo a la circulación sanguínea mediante la aplicación de citocinas como el factor estimulante de colonias de granulocitos (G–CEF).30
3. Aplicación local de factores de crecimiento como la insulina y factor de crecimiento del hepatocito.31
La evidencia de la diferenciación de las células tallo mesenquimales a cardiomiocitos funcionales ha sido bien documentada en modelos animales30–64 y en seres humanos se reporta la presencia de cromosomas Y en cardiomiocitos de corazones donados del género femenino, que fueron implantados en pacientes del género masculino, quienes fallecieron después de nueve meses de haber sido trasplantados. Los cardiomiocitos positivos a cromosoma Y fueron detectados en zonas lesionadas por rechazo inmunológico agudo, indicando un quimerismo de las células tallo de origen extracardiaco del paciente receptor para reparar las lesiones del órgano donado, con esto, se demuestra la capacidad de migración de estas células hacia el miocardio dañado, aunque este proceso ocurre a muy bajos niveles.68–70
En el estudio TOPCARE–AMI los pacientes se aleatorizaron para recibir células de médula ósea (BMCs) o células progenituras endoteliales (EPCs). Las BMCs se aislaron de 50 mL de aspirados de médula ósea mediante centrifugación con gradiente de Ficoll. Las EPCs se obtuvieron de sangre periférica.
Las BMCs y EPCs se infundieron por vía endovascular directamente en las coronarias, combinando esta infusión con angioplastia coronaria, en pacientes con infartos del miocardio recientes (cinco días), mejorando significativamente la fracción de expulsión en comparación con pacientes a quienes no se les aplicaron estas células. Lo anterior sugiere que estas líneas celulares tienen la capacidad de incrementar la regeneración cardiaca.71,74
Wollert infundió por vía intracoronaria BMCs en 60 pacientes con infartos agudos y los comparó con pacientes a quienes les infundió placebo, reportando un incremento en la fracción de expulsión y una reducción en el volumen diastólico del ventrículo izquierdo en el grupo de pacientes que recibieron BMCs.74
Perin57 y Tze75 utilizaron un catéter de NOGA para realizar la inyección de células de la médula ósea (BMCs) en el endocardio del tejido infartado, guiándose por mapeo electromecánico, demostrando Perin mejoría en la fracción de expulsión y del volumen diastólico en 14 pacientes con falla cardiaca crónica de tipo isquémico y Tze reporta mejoría en el engrosamiento sistólico y en la perfusión del área infartada, 90 días después de la infusión de las células, en ocho pacientes con cardiopatía isquémica crónica.
Stamm obtuvo las células en forma similar a los autores previos y las inyectó directamente en el miocardio de pacientes con infartos recientes (seis semanas) , combinando la implantación con procedimiento de revascularización a corazón abierto, reportando igualmente mejoría en la función ventricular y disminución del área infartada.76
Existe controversia sobre los resultados reportados en los estudios mencionados, argumentándose que la mejoría clínica de los pacientes y del ventrículo infartado posiblemente fue consecuencia de la existencia de tejido viable que mejoró con el procedimiento de revascularización que se realizó en los pacientes y no propiamente a la diferenciación de las células tallo a cardiomiocitos funcionales.71–76
Archundia y Aceves estimularon la médula ósea con G–CSF para incrementar la liberación de células tallo a la circulación periférica, cosechándolas mediante un procedimiento de citaféresis cerrada y posteriormente las inyectaron en la zona del miocardio lesionado de pacientes con infartos antiguos, con ausencia de tejido viable y función ventricular deprimida, reportando mejoría de la función ventricular a parámetros hemodinámicos normales, reducción del área infartada y mejoría en la clase funcional de los pacientes (en revisión en la revista médica Lancet).
DISCUSIÓN
La terapéutica farmacológica, revascularización con intervencionismo y cirugía a corazón abierto han sido una herramienta útil en el tratamiento de pacientes con cardiopatía isquémica, sin embargo, en la regeneración del tejido infartado es poco lo que han contribuido. En años recientes, la ventriculoplastia celular ha surgido como una modalidad en el tratamiento del tejido miocárdico infartado, utilizando diferentes tipos de líneas celulares, cada una de ellas con ventajas y desventajas.31–77
Las células embrionarias obtenidas del cordón umbilical son una alternativa poco viable, por ser alogénicas y con un alto potencial para desencadenar una respuesta inmunológica de rechazo en el receptor. La utilización de células tallo del adulto que se encuentran quiescentes en diferentes órganos como el hígado, células dendríticas, tejido adiposo, etc., tienen el inconveniente de requerir biopsias de tejido y realizar cultivos in vitro para promover una diferenciación previa a su implantación, incrementando el riesgo de infección y costos de operación.16–29
Las células tallo obtenidas mediante aspiración de la médula ósea tienen un mejor potencial en su utilización, pues pueden diferenciarse directamente en el tejido implantado, sin embargo, tienen el inconveniente de requerir de un procedimiento muy invasivo y con alto riesgo de infección.57,71–76 Esto se puede resolver al estimular la liberación de estas células de la médula ósea a la circulación periférica, mediante la aplicación de citocinas como G–CSF y cosechándolas mediante un procedimiento de citaféresis cerrada. Este procedimiento está estandarizado en pacientes con trastornos hematológicos y representa menor invasividad.
Las evidencias reportadas en los diferentes estudios animales indican que las posibilidades de regeneración del tejido infartado por los diferentes tipos de líneas celulares, al diferenciarse en cardiomiocitos funcionales, son viables y alentadoras. Los resultados reportados en seres humanos sugieren posibilidades similares, aunque a la fecha no se ha podido demostrar que realmente existe una diferenciación de las células implantadas a cardiomiocitos funcionales. También es posible que esta mejoría en la función ventricular se pueda atribuir a los siguientes factores:
1. Mecánica: Disminuyendo el estrés en la pared ventricular del área infartada y de la remodelación ventricular.30–67
2. Promoviendo neoangiogénesis en el sitio de implantación de las células.45,46,52,69
3. Diferenciándose las células implantadas en cardiomiocitos funcionales e invadiendo la escara del infarto.68–76
La mejoría en la función y disminución del área del tejido infartado, posterior a la implantación de las células tallo en pacientes con infartos recientes, es discutible, debido a la existencia de tejido viable que mejora con el procedimiento de revascularización y no a la diferenciación de las células a cardiomiocitos.71–76 Archundia y Aceves las inyectaron en infartos sin tejido viable, reportando resultados alentadores, aumentando las posibilidades de que la mejoría observada sea atribuible a la diferenciación de las células tallo a cardiomiocitos funcionales.
De las diferentes líneas celulares, las células tallo mesenquimales autólogas presentan mayores ventajas, su obtención de la circulación periférica posterior a la estimulación de la médula ósea es segura y menos invasiva que el aspirado de médula ósea.
Las diferentes vías de implantación utilizadas por los investigadores mencionados han mostrado buenos resultados, Strauer reporta que los resultados dependerán de la vía de administración y la concentración de células implantadas77 (Figura 1). Sin embargo, los estudios reportados en la literatura médica incluyen pocos pacientes, por lo que tendremos que esperar estudios con mayor población y discernir cuál es la mejor vía de implantación, esperando la prueba del tiempo para la cardiomioplastia celular.
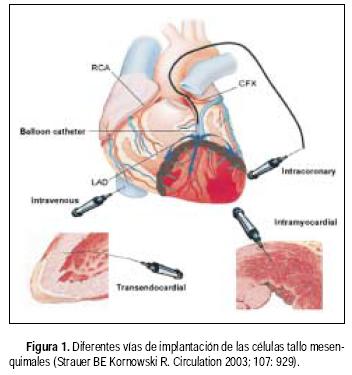
La investigación está activa en diferentes grupos en el mundo y seguramente en años venideros se conocerán mejor los mecanismos de acción de las células implantadas, los criterios de selección y los alcances del procedimiento de la cardiomioplastia celular.
REFERENCIAS
1. Lee MS, Makkar BR. Stem–cell transplantation in myocardial infarction: A status report. Ann Internal Med 2004; 140(9): 729–37. [ Links ]
2. Mallory GK, White PD, Salcedo–Salgar J. The speed of healing of myocardial infarction: a study of pathologic anatomy in 72 cases. Am Heart J 1939; 18: 647–71. [ Links ]
3. Soonpaa MH, Field LJ. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circ Res 1998; 83: 15–26. [ Links ]
4. Barbash IM, Chouraqui P, Baron J, Feinberg MS, Etzion S, Tessone S. Systemic delivery of bone marrow–derived mesenchymal stem cells to the infarcted myocardium: Feasibility, cell migration, and body distribution. Circulation 2003; 108(7): 863–8. [ Links ]
5. Korbling M, Estrov Z. Medical progress: Adult stem cells for tissue repair – A new therapeutic concept? N Engl J Med 2003; 349(6): 570–82. [ Links ]
6. Slack JMW. Stem cells in epithelial tissues. Science 2000; 287: 1431–3. [ Links ]
7. Weissman IL. Stem cells: units of development, units of regeneration, and units in evolution. Cell 2000; 100: 157–68. [ Links ]
8. Blau HM, Brazelton TR, Weimann JM. The evolving concept of a stem cell: entity or function? Cell 2001; 105: 829–41. [ Links ]
9. Quesenberry PJ, Colvin GA, Lambert JF. The chiaroscuro stem cell: a unified stem cell theory. Blood 2002; 100: 4266–71. [ Links ]
10. Graf T. Differentiation plasticity of hematopoietic cells. Blood 2002; 99: 3089–101. [ Links ]
11. Ferrari G, Cusella–De Angelis G, Coletta M. Muscle regeneration by bone marrow–derived myogenic progenitors. Science 1998; 279: 1528–30. [ Links ]
12. Jiang Y, Jahagirda BN, Reinhardt RL. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002; 418: 41–9. [ Links ]
13. Bartolomew A. Mesencgymal stem cells. Grafo 2000; 3(6): 277–9. [ Links ]
14. Pittenger MF, Mackay AM. Multipotential human mesenchymal stem cells. Graft 2000; 3(6): 288–93. [ Links ]
15. Verfaillie CM. Stem cell plasticity. Graft 2000; 3(6): 296–7. [ Links ]
16. Pereira RF, O'Hara, Laptev AV. Marrow stromal cells as a source of progenitor cells for nonhematopoietic tissues in transgenic mice with a phenotype of osteogenesis imperfect. Proc Nati Acad Sci 1998; 95: 1142–7. [ Links ]
17. Gussoni E, Soneoka Y, Strockland C. Dystrophin expression in the mdx mouse restored by item cells transplantation. Nature 1999; 401: 390–4. [ Links ]
18. Jackson A, MI T, Goodell MA. Hematopoietic potential of stem cells isolated from murine skeletal muscle. Prot Nati Acad Sci USA 1999; 96: 482–6. [ Links ]
19. Petersen BE, Bowen WC, Patrene KD. Bone marrow as a potential source of hepatic oval cells. Science 1999; 284: 1168–70. [ Links ]
20. Takahashi T, Kalka C, Masuda H. Ischemia and citikine induced mobilization of bone marrow derived endothelial progenitor cells for neovascularization. Nat Med 1999; 5: 454–8. [ Links ]
21. Bishop AE, Buttery LD, Polak JM. Embryonic stem cells. J Pathol 2002; 197: 424–9. [ Links ]
22. Theise ND, Nimmakayalu M, Gardner R, et al. Liver from bone marrow in humans. Hepatology 2000; 32: 11–16. [ Links ]
23. Alison MR, Poulsom R, Jeffery R. Hepatocytes from non–hepatic adult stem cells. Nature 2000; 406: 257. [ Links ]
24. Kleeberger W, Rothamel T, Glockner S, Flemming P, Lehmann U, Kreipe H. High frequency of epithelial chimerism in liver transplants demonstrated by microdissection and STR–analysis. Hepatology 2002; 35: 110–16. [ Links ]
25. Okamoto R, Yajima T, Yamazaki M. Damaged epithelia regenerated by bone marrow–derived cells in the human gastrointestinal tract. Nat Med 2002; 8: 1011–7. [ Links ]
26. Mezey E, Key S, Vogelsang G, Szalayova I, Lange GD, Crain B. Transplanted bone marrow generates new neurons in human brains. Proc Nati Acad Sci USA 2003; 100: 1364–9. [ Links ]
27. Weimann JM, Charlton GA, Brazelton TR, Hackman RC, Blau H. Contribution of transplanted bone marrow cells to purkinje neurons in human adult brains. Proc Nati Acad Sci USA 2003; 100: 2088–93. [ Links ]
28. Grant MB, May WS, Caballero S. Adult hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization. Nat Med 2002; 8: 607–12. [ Links ]
29. Masuya M, Drake CJ, Fleming PA. Hematopoietic origin of glomerular mesangial cells. Blood 2003; 101: 2215–8. [ Links ]
30. Orlic D, Kajstura J, Chimenti S, Limana F, Jakoniuk I, Quaini F. Mobilized bone marrow cells repair the infarcted heart, improving function and survival. Proc Nati Acad Sci USA 2001; 98: 10344–9. [ Links ]
31. Welch S, Plank D, Witt S, Glascock B, Schaefer E, Chimenti S. Cardiac–specific IGF–1 expression attenuates dilated cardiomyopathy in tropomodulin–overexpressing transgenic mice, Circ Res 2002; 90: 641–8. [ Links ]
32. Soonpaa MH, Koh GY, Klug MG, Field LJ. Formation of nascent intercalated disks between grafted fetal cardiomyocytes and host myocardium. Science 1994; 264: 98–101. [ Links ]
33. Scorsin M, Marotte F, Sabri A, Le Dref O, Demirag M, Samuel JL. Can grafted cardiomyocytes colonize peri–infarct myocardial areas? Circulation 1996; 94: 11337–40. [ Links ]
34. Li RK, Jia ZQ, Weisel RD, Mickle DA, Zhang J, Mohabeer MK. Cardiomyocyte transplantation improves heart function. Ann Thorac Surg 1996; 62: 654–60; discussion 660–1. [ Links ]
35. Etzion S, Battler A, Barbash IM, Cagnano E, Zarin P, Granot Y. Influence of embryonic cardiomyocyte transplantation on the progression of heart failure in a rat model of extensive myocardial infarction. J Mol Cell Cardiol 2001; 33: 1321–30. [ Links ]
36. Van Meter CH Jr., Claycomb WC, Delcarpio JB, Smith DM, de–Gruiter H, Smart F, Myoblast transplantation in the porcine model: a potential technique for myocardial repair. J Thorac Cardiovasc Surg 1995; 110: 1442–8. [ Links ]
37. Hughes S. Cardiac stem cells. J Pathol 2002; 197: 468–78. [ Links ]
38. Leor J, Prentice H, Sartorelli V, Quiñones MJ, Patterson M, Kedes LK. Gene transfer and cell transplant: an experimental approach to repair a 'broken heart'. Cardiovasc Res 1997; 35: 431–41. [ Links ]
39. Jain M, DerSimonian H, Brenner DA, Ngoy S, Teller P, Edge AS. Cell therapy attenuates deleterious ventricular remodeling and improves cardiac performance after myocardial infarction. Circulation 2001; 103: 1920–7. [ Links ]
40. Ghostine S, Carrion C, Souza LC, Richard P, Bruneval P, Vilquin JT. Long–term efficacy of myoblast transplantation on regional structure and function after myocardial infarction. Circulation 2002; 106: 1131–6. [ Links ]
41. Pouzet B, Vilquin JT, Hagége AA, Scorsin M, Messas E, Fiszman M. Intramyocardial transplantation of autologous myoblasts: can tissue processing be optimized? Circulation 2000; 102: III210–5. [ Links ]
42. Robinson SW, Cho PW, Levitsky HI, Olson JL, Hruban RH, Acker MA. Arterial delivery of genetically labelled skeletal myoblasts to the murine heart: long–term survival and phenotypic modification of implanted myoblasts. Cell Transplant 1996; 5: 77–91. [ Links ]
43. Shintani S, Murohara T, Ikeda H, Ueno T, Honma T, Katoh A. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction. Circulation 2001; 103: 2776–9. [ Links ]
44. Asahara T, Masuda H, Takahashi T, Kalka C, Pastore C, Silver M. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization. Circ Res 1999; 85: 221–8. [ Links ]
45. Takahashi T, Kalka C, Masuda H, Chen D, Silver M, Kearney M. Ischemia– and cytokine–induced mobilization of bone marrow–derived endothelial progenitor cells for neovascularization. Nat Med 1999; 5: 434–8. [ Links ]
46. Kawamoto A, Gwon HC, Iwaguro H, Yamaguchi JI, Uchida S, Masuda H. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation 2001; 103: 634–7. [ Links ]
47. Kocher AA, Schuster MD, Szabolcs MJ, Takuma S, Burkhoff D, Wang J. Neovascularization of ischemic myocardium by human bone–marrow–derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function. Nat Med 2001; 7: 430–6. [ Links ]
48. Condorelli G, Borello U, De Angelis L, Latronico M, Sirabella D, Coletta M. Cardiomyocytes induce endothelial cells to transdifferentiate into cardiac muscle: implications for myocardium regeneration. Proc Nati Acad Sci USA 2001; 98: 10733–8. [ Links ]
49. Badorff C, Brandes RP, Popp R, Rupp S, Urbich C, Aicher A. Transdifferentiation of blood–derived human adult endothelial progenitor cells into functionally active cardiomyocytes. Circulation 2003; 107: 1024–32. [ Links ]
50. Szilvassy SJ, Bass MJ, Van Zant G, Grimes B. Organ–selective homing defines engraftment kinetics of murine hematopoietic stem cells and is compromised by ex vivo expansion. Blood 1999; 93: 1557–66. [ Links ]
51. Vasa M, Fichtlscherer S, Adler K, Aicher A, Martin H, Zeiher AM. Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease. Circulation 2001; 103: 2885–90. [ Links ]
52. Fuchs S, Baffour R, Zhou YF, Shou M, Pierre A, Tio FO. Transendocardial delivery of autologous bone marrow enhances collateral perfusión and regional function in pigs with chronic experimental myocardial ischemia. J Am Coll Cardiol 2001; 37: 1726–32. [ Links ]
53. Hescheler J, Fleischmann BK. Indispensable tools: embryonic stem cells yield insights into the human heart. J Clin Invest 2001; 108: 363–4. [ Links ]
54. Kehat I, Kenyagin–Karsenti D, Snir M, Segev H, Amit M, Gepstein A. Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cardiomyocytes. J Clin Invest 2001; 108: 407–14. [ Links ]
55. Min JY, Yang Y, Converso KL, Liu L, Huang Q, Morgan JP. Transplantation of embryonic stem cells improves cardiac function in postinfarcted rats. J Appl Physiol 2002; 92: 288–96. [ Links ]
56. O'Shea KS. Embryonic stem cell models of development. Anat Rec 1999; 257: 32–41. [ Links ]
57. Perin EC, Geng YJ, Willerson JT. Adult stem cell therapy in perspective. Circulation 2003; 107: 935–8. [ Links ]
58. Ferrari G, Cusella–De Angelis G, Coletta M, Paolucci E, Stor–naiuolo A, Cossu G. Muscle regeneration by bone marrow–derived myogenic progenitors. Science 1998; 279: 1528–30. [ Links ]
59. Wang JS, Shum–Tim D, Galipeau J, Chedrawy E, Eliopoulos N, Chiu RC. Marrow stromal cells for cellular cardiomyoplasty: feasibility and potential clinical advantages. J Thorac Cardiovasc Surg 2000; 120: 999–1005. [ Links ]
60. Makino S, Fukuda K, Miyoshi S, Konishi F, Kodama H, Pan J. Cardiomyocytes can be generated from marrow stromal cells in vitro. J Clin Invest 1999; 103: 697–705. [ Links ]
61. Toma C, Pittenger PF, Cahill KS, Byrne BJ, Kessler PD. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart. Circulation 2002; 105: 93–8. [ Links ]
62. Shake JG, Gruber PJ, Baumgartner WA, Senechal G, Meyers J, Redmond JM. Mesenchymal stem cell implantation in a swine myocardial infarct model: engraftment and functional effects. Ann Thorac Surg 2002; 73: 1919–25; discussion 1926. [ Links ]
63. Makkar RR, Price MJ, Lili M, Takizawa K, Frantzen M, Fishbein MC. Multilineage differentiation of transplanted allogenic mesenchymal stem cells injected in a porcine model of recent myocardial infarction improves left ventricular function. Circulation 2002; 106: 1134. [ Links ]
64. Qayyum MS, Takizawa K, Frantzen M, MacLellan R, Lili M, Fishbein MC. Mesenchymal stem cell therapy prevents deterioration of left ventricular function in a porcine myocardial infarction model. J Am Coll Cardiol 2002; 39: 169A. [ Links ]
65. Min JY, Sullivan MF, Yang Y, Zhang JP, Converso KL, Morgan JP. Significant improvement of heart function by cotransplantation of human mesenchymal stem cells and fetal cardiomyocytes in postinfarcted pigs. Ann Thorac Surg 2002; 74: 1568–75. [ Links ]
66. Rangappa S, Fen C, Lee EH, Bongso A, Wei ES. Transformation of adult mesenchymal stem cells isolated from the fatty tissue into cardiomyocytes. Ann Thorac Surg 2003; 75: 775–9. [ Links ]
67. Tomita S, Li RK, Weisel RD, Mickle DA, Kim EJ, Sakai T. Autologous transplantation of bone marrow cells improves damaged heart function. Circulation 1999; 100: 11247–56. [ Links ]
68. Laflamme MA, Myerson D, Saffitz JE, Murry CE. Evidence for cardiomyocyte repopulation by extracardiac progenitors in transplanted human hearts. Circulation Res 2002; 90(6): 634–40. [ Links ]
69. Jackson KA, Majka SM, Wang H, Pocius J, Hartley CJ, Majesky MW, Entman ML, Michael LH, Hirschi KK, Goodell MA. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest 2001; 107: 1395–1402. [ Links ]
70. Quaini F, Urbanek K, Beltrami AP, Finato N, Beltrami CA, Nadal–Ginard B, Kajstura J, Leri A, Anversa P. Chimerism of the transplanted heart. N Engl J Med 2002; 346: 5–15. [ Links ]
71. Strauer BE, Brehm M, Zeus T, Kostering M, Hernandez A, Sorg RV. Repair infarted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 2002. [ Links ]
72. Assmus B, Schachinger V, Teupe C, Britten M, Lehmann R, Dobert N. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction (TOPCARE–AMI). Circulation 2002; 106: 3009–17. [ Links ]
73. Britten MB, Abolmaali ND, Assmus B. Infarct remodeling after intracoronary progenitor cell treatment in patients with acute myocardial infarction (TOPCARE–AMI). Mechanistic insights from serial contrast–enhanced magnetic resonance imaging. Circulation 2003. [ Links ]
74. Wollert KC, Meyer GP, Lotz J. Randomized controlled clinical trial of intracoronary autologous bone marrow cell transfer post myocardial infarction. Circulation 2003; 108: 272. [ Links ]
75. Tse HF, Kwong YL, Chan JK, Lo G, Ho CL, Lau CP. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation. Lancet 2003; 361: 47–9. [ Links ]
76. Stam C, Westphal B, Klein HD, Petzsch M, Kittner C, Klinge H. Autologous bone marrow stem cell transplantation for myocardial regeneration. Lancet 2003; 361: 45–6. [ Links ]
77. Strauer BE, Kornowky R. Stem cell therapy in perspective. Circulation 2003; 107: 929. [ Links ]














