Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de investigación clínica
On-line version ISSN 2564-8896Print version ISSN 0034-8376
Rev. invest. clín. vol.57 n.1 Ciudad de México Jan./Feb. 2005
Artículo original
Farmacocinética poblacional de carbamacepina en pacientes epilépticos adultos
Population pharmacokinetics of carbamazepine in adults with epilepsy
Silvia Romano–Moreno,* Eréndida Lizbeth Medina–Rojas,* Ana Luisa Salas–Ortiz,* Juan Manuel Vargas–Morales,* José Trinidad Pérez–Urizar,* Idelfonso Rodríguez–Leyva**
* Facultad de Ciencias Químicas. UASLP.
** Clínica de Epilepsia. Hospital Central Ignacio Morones Prieto. San Luis Potosí, SLP.
Reimpresos:
Dra. Silvia Romano Moreno
Calle 5 No. 310
Fraccionamiento Industrial Aviación.
78140, San Luis Potosí, S.L.P.
Tels.: (444) 813–3536, (444) 826–2440, Ext. 513, Fax: (444) 826–2372.
E–mail: srm@uaslp.mx
Recibido el 6 de noviembre de 2003.
Aceptado el 15 de noviembre de 2004.
ABSTRACT
The aim of the present study was to determinate the factors affecting carbamazepine (CBZ) clearance (CL) in adults with epilepsy using a mixed–effect model and sparse data collected during routine clinical care. The patient population comprised 104 adults receiving CBZ. A total of 161 CBZ steady state serum concentration samples were analyzed. Population CL was calculated by using NONMEM with a one compartment model with first–order absorption and elimination. The following covariates were tested for their influence on clearance (CL): total body weight, age, dose/day, sex, surface area (SA) and comedication with primidone (PRIM), valproic acid or phenytoin (DFH). The final regression model for carbamazepine clearance found best to describe the data was: CL = (0.614 SA + 0.0016 dose/day)(1 + 0.278 DFH)(1 + 0.326 PRIM)
Key words. Carbamazepine. Pharmacokinetics. Adults. Population. NONMEM.
RESUMEN
El objetivo de este trabajo es determinar los factores que influyen en el aclaramiento (CL) de carbamacepina (CBZ) en pacientes epilépticos adultos usando un modelo de efectos mixtos y datos de concentraciones séricas de CBZ generados del cuidado rutinario de los pacientes. El número de pacientes incluidos en el estudio fue de 104. Se analizaron un total de 161 concentraciones séricas de CBZ en el estado estacionario. El aclaramiento poblacional se determinó con el programa NONMEM aplicando un modelo monocompartimental con absorción y eliminación de primer orden. Se analizó la influencia de las siguientes covariables sobre el CL: peso corporal total, edad, dosis/día, sexo, superficie corporal (SC) y la comedicación con primidona (PRIM), ácido valproico o difenilhidantoína (DFH). El modelo final de regresión obtenido es el siguiente: CL = (0.614 SC + 0.0016 dosis/día)( 1+ 0.278 DFH)(1 + 0.326 PRIM).
Palabras clave. Carbamacepina. Farmacocinética. Adultos. NONMEM. Poblacional.
INTRODUCCIÓN
La carbamacepina (CBZ) es en la actualidad el fármaco más utilizado en el tratamiento de las epilepsias que cursan con crisis parciales, simples o complejas, y generalizadas tónico–clónicas, tanto en adultos como en niños. La principal ventaja de este fármaco frente a otros antiepilépticos tradicionales, es la menor incidencia de efectos indeseables de tipo cognitivo y conductual. Además, la CBZ se utiliza en el tratamiento de la neuralgia del trigémino y de algunos trastornos afectivos y de conducta.1
No obstante que existe una buena relación entre las concentraciones sanguíneas de CBZ y el efecto farmacológico, el grado de correlación entre las dosis administradas de CBZ y las concentraciones séricas alcanzadas es bajo como consecuencia de la gran variabilidad interindividual en la biotransformación del fármaco. Esta variabilidad puede ser atribuida a un fenómeno de autoinducción del metabolismo, posiblemente influido por la magnitud de la dosis, por las características fisiopatológicas del paciente, o bien como consecuencia de las interacciones causadas por la acción de otros fármacos que se tienen que asociar frecuentemente en caso de epilepsias refractarias para conseguir un mejor control de las crisis.2 Este hecho unido a la estrecha ventana terapéutica de la CBZ (4–12 mg/L) dificulta el establecimiento a priori de pautas de dosificación que permitan obtener una respuesta óptima en el paciente, evitando riesgos innecesarios de infra o sobredosificación.3
Existen numerosos estudios sobre el comportamiento cinético de la CBZ y los factores que pueden modificarlo, pero en su mayoría fueron realizados aplicando metodologías tradicionales sobre pequeños grupos de voluntarios sanos o pacientes con características fisiopatológicas muy definidas. En ellos se pone de manifiesto la influencia significativa de ciertas variables, tales como el peso y la edad, mientras que persiste la controversia sobre la influencia de otros factores tales como la autoinducción dosis dependiente, el sexo, la asociación con inductores del metabolismo de CBZ como fenitoína y fenobarbital o de inhibidores metabólicos como el ácido valproico.4–9 Sin embargo, son muy escasos los estudios realizados en grupos amplios de pacientes representativos de toda la población que recibe el fármaco, debido a las objeciones éticas que plantea la realización de un estudio cinético de tipo tradicional, dado que precisa la obtención de un número elevado de muestras por paciente.
Para superar los inconvenientes derivados de los estudios cinéticos clásicos, en los últimos años se han desarrollado métodos de estimación de parámetros farmacocinéticos basados en modelos de efectos mixtos, los cuales permiten analizar conjuntamente información clínica y farmacocinética procedente de un amplio número de individuos incluso cuando el número de datos de concentración disponibles por cada individuo es reducido.10,11 Esta información puede ser la obtenida en el curso de la monitorización por lo que, al ser generada como parte del cuidado del paciente, no supone un costo adicional y la población de interés está mejor representada que en los estudios tradicionales. No obstante, la aplicación de estas nuevas estrategias requiere la utilización de métodos matemático–estadísticos complejos que permitan la integración de datos de distinta naturaleza (concentraciones en fluidos biológicos, dosis–respuesta, características demográficas y patológicas de los pacientes y tratamientos asociados, entre otros). Estos métodos han sido implantados en diferentes programas informáticos, siendo el más difundido NONMEM, con el cual se han realizado diversos estudios de cinética poblacional de algunos fármacos, como aminoglucósidos, vancomicina, teofilina, fenitoína y digoxina, que avalan su utilidad y confirman su validez en el tratamiento de datos procedentes de la práctica clínica.12–14
Una revisión exhaustiva referente a la farmacocinética de CBZ en distintas bases de datos pone de manifiesto el escaso número de estudios dirigidos a establecer la farmacocinética poblacional de este antiepiléptico. Los trabajos encontrados corresponden a estudios realizados con NONMEM en niños,15 en poblaciones mixtas (niños, adolescentes y adultos)7,16,17 y en adultos de EUA,18 Arabia19 y China.20 No se ha encontrado ningún estudio de farmacocinética poblacional de CBZ realizado con modelos de efectos mixtos en adultos de poblaciones latinas.
Actualmente, los criterios farmacocinéticos utilizados para la dosificación de CBZ están basados en los parámetros obtenidos mediante estudios tradicionales llevados a cabo en otros países y, como consecuencia, en poblaciones que pueden no ser representativas de la mexicana.16,18,19 Además, las pautas de dosificación recomendadas sólo tienen en consideración el grupo de edad al que pertenece el paciente, adulto o niño, y el peso corporal únicamente en este último grupo, ignorando su cinética dosis–dependiente y la influencia de los tratamientos asociados con otros fármacos, antiepilépticos o no. Esta situación pone de manifiesto el indudable interés que tiene el caracterizar en la población mexicana el comportamiento cinético de este fármaco, el cual se encuentra incluido en el Cuadro Básico de Medicamentos del Sector Salud21 y es considerado de primera línea en el tratamiento de la epilepsia por su amplía utilización en la clínica.
Por lo anteriormente señalado, el objetivo de este trabajo es determinar el modelo poblacional de efectos mixtos que describe el comportamiento fármaco–cinético en el aclaramiento de CBZ en pacientes epilépticos adultos monitorizados en el Hospital Central "Ignacio Morones Prieto" de la ciudad de San Luis Potosí.
MATERIAL Y MÉTODOS
Pacientes
Para la realización de este estudio de tipo retrospectivo se utilizaron datos procedentes de pacientes epilépticos adultos (edad entre 18 y 60 años) del Hospital Central "Ignacio Morones Prieto" de la ciudad de San Luis Potosí, ingresados o ambulatorios, que estuvieron en tratamiento crónico con comprimidos de CBZ (Tegretol®), durante el periodo enero 2000–marzo 2002 y que en su historia clínica contaban con registros de niveles sanguíneos de CBZ en el estado estacionario e información completa sobre dosis administrada, tiempo de muestreo, hora de la última administración, así como de las características antropométricas (edad, peso, altura, sexo) y de comedicación (administración simultánea de fenitoína, fenobarbital, ácido valproico, primidona, etc.). Fueron excluidos del estudio los pacientes en los que la información era incompleta, mujeres embarazadas y pacientes con insuficiencia hepática.
Los pacientes seleccionados recibieron la dosificación de CBZ por vía oral en una única toma diaria o, en la mayoría de los casos, dos o tres veces al día fraccionando la dosis/día de acuerdo con la prescripción médica. Los intervalos de administración fueron irregulares al estar asociada la toma del medicamento con los horarios de las comidas. La extracción de muestras de sangre para la determinación de las concentraciones séricas del fármaco se realizó transcurridas por lo menos tres semanas posteriores al inicio del tratamiento o al cambio de dosis, habitualmente por las mañanas, antes de la administración de la primera dosis del día, por lo que normalmente la determinación corresponde a la concentración mínima en el estado de equilibrio.
El método analítico empleado para la determinación de las concentraciones plasmáticas de CBZ fue inmunoensayo de fluorescencia polarizada (Axsym® Abbott) con coeficientes de variación inter e intraensayo inferiores al 10%.
Análisis farmacoestadístico
Los datos de concentración–tiempo de los pacientes se ajustaron a un modelo farmacoestadístico utilizando el método denominado de primer orden, implantado en el programa NONMEM versión V y aplicando las subrutinas ADVAN2, TRANS2 y SS2. En este tipo de análisis, los datos de todos los pacientes que integran el estudio son analizados de manera simultánea aunque preservando su individualidad, estimándose parámetros farmacocinéticos típicos (medios) de la población, así como los valores de variabilidad interindividual y variabilidad residual (intraindividual).
Modelo farmacocinético
El modelo farmacocinético seleccionado para el ajuste de las concentraciones de CBZ obtenidas a partir de la administración oral del fármaco, fue el modelo monocompartimental abierto con absorción y eliminación de primer orden.
La constante de absorción (Ka) de la CBZ y la biodisponibilidad (F) del fármaco se fijaron a los valores bibliográficos 0.65 h–1 y 0.85, respectivamente.3,22 Debido a la naturaleza de los datos (concentraciones mínimas en el estado de equilibrio), que no permite la correcta estimación del volumen de distribución (Vd),23,24 éste también se fijó con base en el rango de valores de Vd/F referidos en la bibliografía (1.2 a 1.9 L/kg).22,25 Para ello se obtuvo el modelo básico con diferentes valores de Vd/F dentro del rango anteriormente señalado con intervalos de 0.1, eligiéndose aquel valor que proporcionó un mejor ajuste de los datos y el menor error de estimación para los parámetros. El valor de Vd utilizado en la construcción del modelo farmacocinético poblacional fue de 1.5 L/kg (Vd/F = 1.76). Por lo tanto, en el modelo poblacional únicamente se estimó el valor del aclaramiento (CL) de CBZ.
Modelo de regresión
En la construcción del modelo de regresión se analizó la influencia de las siguientes variables sobre el CL de CBZ: peso corporal total (PCT), edad (EDAD), superficie corporal (SC) (calculada con la fórmula de Mosteller:  26 dosis/día (DOSIS), sexo (SEXO) y terapia concomitante con ácido valproico (AV), difenilhidantoína (DFH), primidona (PRIM), por ser los fármacos que se administran en forma simultánea a CBZ en más de 15% de los pacientes incluidos en el estudio.
26 dosis/día (DOSIS), sexo (SEXO) y terapia concomitante con ácido valproico (AV), difenilhidantoína (DFH), primidona (PRIM), por ser los fármacos que se administran en forma simultánea a CBZ en más de 15% de los pacientes incluidos en el estudio.
La incorporación de las variables se llevó a cabo de forma progresiva (paso a paso) a partir del modelo básico (CL = 8j) para desarrollar el modelo intermedio con la incorporación de variables continuas y uno completo en el que se incluyeron las variables categóricas. En un último paso se obtuvo el modelo final, en el que sólo se incluyeron las variables continuas y categóricas que demostraron influencia significativa sobre el CL de CBZ, utilizando criterios estadísticos más restrictivos que los utilizados en la construcción del modelo completo. En la figura 1 aparece representado el esquema general seguido en la construcción del modelo de regresión con cada uno de los pasos anteriormente mencionados.
Se analizó la inclusión de las variables continuas: PCT, DOSIS, EDAD y SC de acuerdo con funciones lineales y no lineales, según la siguiente expresión:
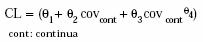
Las variables discretas o categóricas (SEXO, AV, DFH, PRIM) se asumió que tomaban el valor cero cuando estaban ausentes en un individuo o cuando se trataba del sexo femenino y tomaban el valor uno en caso contrario. Estas variables fueron introducidas en el modelo en forma multiplicativa:
Modelo estadístico
En la construcción del modelo estadístico, para la determinación de la variabilidad interindividual en el CL de CBZ y la variabilidad residual, se probaron diferentes combinaciones de modelos de error: aditivo y proporcional (coeficiente de variación constante):


Donde CLj es el CL específico del individuo j. CL'j es el CL predicho por el modelo poblacional, ηCLj representa la diferencia entre el CL del individuo y el valor predicho por el modelo, la cual tiene una distribución con media igual a cero y una varianza ω2. Cij es la concentración observada para el individuo j al tiempo i, C'ij es la concentración plasmática predicha por el modelo farmacocinético para el individuo j al tiempo i y εij es el error residual que tiene una distribución con media cero y varianza σ2.
La combinación de modelos de error más adecuada para la construcción del modelo farmacocinético se determinó mediante un análisis preliminar con el modelo básico. Posteriormente se confirmó con el modelo final.
Criterios de selección de modelos
La discriminación entre los distintos modelos farmacoestadísticos evaluados se basó, en primer lugar, en el valor mínimo de la función objetivo (Fobj). Al ajustar los datos, NONMEM calcula el valor de dicho estadístico, que corresponde a –2Lmax, siendo Lmax la función de máxima probabilidad de los datos. La elección entre dos posibles modelos se basa en la diferencia existente entre los respectivos valores de sus Fobj, admitiéndose que el valor de esa diferencia presenta, aproximadamente, una distribución chi–cuadrada ( ), con un número de grados de libertad igual a la diferencia que existe en el número de parámetros de los dos modelos que se desean discriminar.
), con un número de grados de libertad igual a la diferencia que existe en el número de parámetros de los dos modelos que se desean discriminar.
En la construcción del modelo de regresión completo, se adoptó para modelos restrictivos (aquellos que se diferencian en un solo parámetro) una diferencia en el valor de la función objetivo (DFobj) de al menos 3.8 unidades (valor asociado a una probabilidad de 0.05 para un grado de libertad), como indicativa de que el modelo con más bajo valor de función objetivo era probablemente superior al otro. En modelos no restrictivos, en los que los modelos comparados presentan el mismo número de parámetros, no puede adoptarse el criterio anterior, aceptándose como más probable aquel con menor valor de la función objetivo, si la DFobj era de al menos 10 unidades.27
Una vez definido el modelo completo, se procedió a aplicar un criterio estadístico más estricto. Se eliminaron, una a una, las variables del modelo para demostrar si tienen influencia o no sobre el CL de CBZ. Así, se admitió una diferencia mínima de 6.6 unidades, asociada a un valor de p < 0.01, para un grado de libertad, como criterio necesario para mantenerlas en el modelo final.
Puesto que NONMEM proporciona también estimadas de los parámetros de variabilidad interindividual y residual, errores estándar de los parámetros de efectos fijos y aleatorios, matrices de correlación de las estimadas y gráficas de distintos tipos, se deben tener en cuenta otros criterios en el momento de discriminar entre modelos. El descenso en el coeficiente de variación del CL a medida que se van incluyendo las posibles variables predictoras en el modelo, el error estimado de cada parámetro (< 25% para parámetros de efectos fijos y < 50% para los efectos aleatorios) y los intervalos de confianza correspondientes a cada uno de ellos (IC95% = Valor estimado ± 2 Error estándar), que no deben contener el valor nulo, son criterios que fueron considerados en la selección del modelo farmacoestadístico. Además, se utilizó como criterio de selección complementario un análisis minucioso de las gráficas de residuales ponderados (WRES) frente a los distintos parámetros y a los valores predichos de las concentraciones, exigiéndose que tales gráficas mostraran una distribución aleatoria de los datos representados.
RESULTADOS
La población incluida en el estudio estuvo conformada por 104 pacientes, con un total de 161 concentraciones séricas de CBZ. El cuadro 1 muestra la información detallada de las características de la población de pacientes epilépticos estudiada.
De acuerdo con el análisis preliminar desarrollado con el modelo farmacocinético básico [CL = 8J combinando los diferentes modelos de error, se obtuvo un mejor ajuste aplicando a la variabilidad interindividual asociada al aclaramiento plasmático de CBZ un modelo proporcional [CLj = CL'j (1+ηCLj)] y a la variabilidad residual un modelo aditivo [Cij = C'ij + εij] Por lo tanto, esta combinación de modelos estadísticos se aplicó en los análisis subsecuentes.
El proceso de construcción del modelo farmacoestadístico que caracteriza el comportamiento farmacocinético del CL de CBZ en la población de pacientes epilépticos estudiada se muestra en el cuadro 2.
El modelo básico establece el valor medio del CL de CBZ en 2.56 L/h con una varianza de 0.075 (CV = 27.4%) y una variabilidad residual de 3.63 (o = 1.88 mg/L). La figura 2A muestra la representación gráfica de los residuales ponderados (WRES) frente a las concentraciones predichas (PRED) para el modelo inicial. Se aprecia una marcada dispersión de los datos, lo que indica la deficiente bondad en el ajuste de los datos que proporciona dicho modelo. El análisis preliminar de las representaciones gráficas obtenidas con el modelo básico de WRES frente a cada una de las covariables analizadas permitió observar la influencia del PCT, la SC, la DOSIS y la administración concomitante de DFH, PRIM y AV en el CL del CBZ. Las covariables continuas (PCT, SC y DOSIS) fueron incorporadas al modelo básico para construir el modelo intermedio; sólo la SC y la DOSIS demostraron una influencia significativa en el comportamiento farmacocinético del CL de CBZ al conseguir disminuir la función objetivo (FObj) en más de 40 puntos con respecto a la FObj obtenida en el modelo básico.

El modelo completo se obtuvo mediante la incorporación de las covariables categóricas (SEXO, PRIM, DFH, AV) al modelo intermedio. La asociación con AV no demostró ser una covariable que influye significativamente en el CL de CBZ en la población estudiada. De esta manera el modelo completo incluye únicamente como covariables predictoras del comportamiento cinético del CL de CBZ la asociación de DFH y PRIM al tratamiento con este antiepiléptico (Cuadro 2). El modelo final se estableció mediante la exclusión progresiva de las covariables incluidas en el modelo completo, aplicando criterios más estrictos a los empleados en el proceso de inclusión de las mismas al modelo, con la finalidad de mantener en el modelo final sólo las covariables que mostraran una mayor influencia en el CL de CBZ. Este último análisis no excluyó ninguna covariable incluida en el modelo completo por lo que éste correspondió al modelo final.
El cuadro 3 muestra los parámetros obtenidos en el modelo final [CL = (θ1SC + θ2 Dosis/día) (1 + θ3 DFH)(1 + θ4 PRIM)], así como los errores estándar de los mismos. El modelo final permite explicar un 37.5% de la variabilidad interindividual determinada para el CL con el modelo básico al obtenerse un CV de 17.1% para este parámetro. La variabilidad residual de las concentraciones con el modelo final se redujo 7.4% teniendo un valor de 1.74 mg/L para una concentración de CBZ de 8 mg/L, que corresponde al valor medio del margen terapéutico de CBZ (4–12 mg/L).
En la representación gráfica de los WRES frente a las concentraciones predichas (PRED) para el modelo final (Figura 2B), se aprecia una disminución en la dispersión de los datos en relación con la mostrada en la figura 2A correspondiente al modelo básico, lo que indica una mejoría sustancial en el ajuste de los datos obtenido con el modelo final. La figura 3 muestra las representaciones gráficas de las concentraciones séricas observadas de CBZ frente a las concentraciones predichas por el modelo básico y el modelo final; en ellas se aprecia una mejoría notable en la predicción de las concentraciones obtenida con el modelo final.

DISCUSIÓN
Una de las principales aplicaciones de los estudios de farmacocinética de poblaciones es identificar factores intrínsecos y extrínsecos que puedan influir sobre el comportamiento cinético de los fármacos analizados. El parámetro farmacocinético de mayor interés es, habitualmente, el aclaramiento plasmático (CL) sobre el cual suelen influir un mayor número de variables que sobre otros parámetros farmacocinéticos y determina en gran medida las necesidades de dosificación.
Los resultados obtenidos en los estudios de población y su interpretación pueden verse influidos por factores relacionados con el diseño del estudio. De acuerdo con los criterios establecidos por Grasela28 y Lee,29 el presente trabajo permite una fiabilidad adecuada de los resultados, ya que: 1) el número total de individuos del estudio es de 104 y las diferentes variables categóricas analizadas se encuentran bien representadas en su mayoría en una proporción superior a 15% (las variables con representación inferior a 15% no fueron incluidas en el estudio), 2) el número medio de muestras por paciente fue de 1.54 ± 0.5, las cuales se obtuvieron de acuerdo con una estrategia más o menos fija, que corresponde aproximadamente a la hora inmediatamente anterior a la administración de la siguiente dosis (concentraciones mínimas). No obstante que no se disponía de perfiles cinéticos completos de ningún paciente, el número de muestras por paciente se aproxima al número de parámetros estimados, es decir 1 (CL).
Los resultados obtenidos muestran que el CL de CBZ se incrementa linealmente con la superficie corporal del paciente y la dosis diaria administrada, así como con la administración concomitante de fenitoína y primidona.
El proceso seguido en la elaboración del modelo final, a partir del modelo básico inicialmente establecido, realizando el ajuste de los datos a un modelo monocompartimental, ha dado lugar a una reducción superior al 35% en la variabilidad interindividual del CL. La variabilidad del modelo inicial, expresada como CV resultó ser de 27.4%, mientras que el CV del CL en el modelo final fue sólo de 17.15%. Estos resultados sugieren que se han incorporado en el modelo final factores de influencia importante en la variabilidad interindividual del CL de CBZ en la población de adultos epilépticos.
Esta magnitud de la variabilidad del CL en el modelo final es mucho menor que la observada en otros estudios realizados en adultos,7,18–20 en los que no se toman en consideración las covariables incluidas en el modelo propuesto. Los errores de estas estimaciones, junto con la no consideración de factores como la superficie corporal, dosis/kg y fármacos asociados, constituyen causas importantes de la posible sobreestimación de la magnitud de la variabilidad interindividual encontrada en estudios previos.
Sin embargo, el descenso observado desde el modelo básico al final en la variabilidad residual, expresada como desviación estándar, fue más moderado, ya que disminuye de 1.88 mg/L a 1.74 mg/L, lo que supone una reducción de 7.4%. El intervalo de confianza de 95% para este último error residual está comprendido entre 1.34 y 2.06. La variabilidad residual en el modelo final, expresada como CV, equivale a 43, 21 y 14.5% para concentraciones de 4, 8 y 12 mg/L, correspondientes a las concentraciones mínima, media y máxima del margen terapéutico de CBZ, respectivamente. Este error residual presenta una elevada magnitud que supera incluso la encontrada para la variabilidad interindividual del CL y es superior al encontrado por Martin y cois.,6 quienes, al utilizar también un modelo aditivo, determinaron una desviación estándar de 1.32 mg/L para la variabilidad residual, en una población de pacientes adultos. Es preciso considerar que dicho error cuantifica todas las posibles fuentes de variabilidad de las concentraciones observadas respecto a las predichas con el modelo propuesto, e incluye no sólo la variabilidad intraindividual biológica y los errores analíticos en la medida de las concentraciones plasmáticas del fármaco, sino también otros errores atribuidos al incumplimiento, al registro incorrecto en el tiempo de muestreo o de la historia de dosificación, etc., e incluso a las inexactitudes de los parámetros fármaco–cinéticos, tanto los estimados por el modelo (CL) como aquellos a los que se asignan valores bibliográficos (F, Ka, Vd).6 Estas razones podrían justificar que la magnitud del error residual supere ampliamente la variabilidad establecida para la técnica analítica, que resultó ser de 10% en el margen de concentraciones medidas.
La mayoría de los estudios realizados previamente sobre la farmacocinética de CBZ en adultos, con metodologías tradicionales y poblacionales, han puesto de manifiesto que el CL de este fármaco depende de los factores que han sido identificados en este estudio a excepción de la primidona, que no aparece como tal en los modelos poblacionales descritos.
Los resultados obtenidos señalan una correlación positiva entre CL y la dosis de CBZ. Este factor demuestra ser el que consigue un mejor ajuste de los datos, lo que sugiere un fenómeno de autoinducción dosis–dependiente en el metabolismo de este fármaco. Este tipo de relación también ha sido encontrada por otros autores, tanto en niños como en adultos 5,8,9,30–32 Se han propuesto diferentes teorías para justificar la influencia de la dosis/kg sobre el índice nivel plasmático de CBZ/dosis de CBZ (N/D) de este fármaco: a) cambios en la velocidad de eliminación, b) modificaciones en el volumen aparente de distribución y c) una absorción insuficiente al incrementarse la dosis de fármaco. Kumps31 rechaza la posibilidad de que incrementos en Vd sean los responsables de las modificaciones observadas y concluye que la explicación más probable sea una absorción dosis–dependiente, aunque no descarta la posibilidad de una eliminación dosis–dependiente, puesto que la CBZ se elimina fundamentalmente por biotransformación, vía el epóxidodiol, y ambos, absorción y eliminación dosis–dependiente, producirían efectos relacionados con las dosis en el índice N/D del metabolito. Por otro lado, Yukawa y cois.17 señalan que es más factible que la fracción de CBZ absorbida disminuya con el incremento de la dosis, lo que se refleja como un aumento en el CL de CBZ; esto podría deberse a una disolución muy lenta de altas dosis de CBZ en el fluido gastrointestinal debido a su baja solubilidad en agua y al efecto limitante de la disolución en la velocidad de absorción.
Existe controversia acerca de la adecuación de considerar la influencia de la dosis/kg sobre el valor del CL. Martin y cols.6 sugieren la existencia de un sesgo inducido para esta influencia puesto que las dosis, en general, se ajustan para alcanzar concentraciones dentro del margen terapéutico, de forma que los pacientes con CL más elevados recibirán dosis más altas. Sin embargo, un estudio longitudinal sobre la evolución intraindividual de los índices N/ D, realizado en niños en los que se disponía de diferentes pares de datos dosis–concentración, indica que este es un hecho real, al observarse una disminución del N/D al aumentar las dosis administradas.9
Este tipo de cinética dosis–dependiente tiene importantes implicaciones clínicas porque da lugar a una relación no lineal entre las concentraciones medias de equilibrio de CBZ y las dosis administradas; en consecuencia, el incremento en las concentraciones plasmáticas es más pequeño que el esperado cuando las dosis de CBZ se incrementan. A pesar de ello debe señalarse que el modelo admite o presupone que en todos los pacientes el CL es inducido por la dosis, sin tener en consideración a aquellos pacientes que presentan un CL intrínsecamente elevado.
La variable continua superficie corporal (SC) demostró un efecto significativo en el CL de CBZ. La asociación del incremento de este parámetro con la SC sólo ha sido reportada por Reith y cois.,7 en un trabajo realizado en una población conformada por niños, adolescentes y adultos. No obstante que ha sido común establecer las dosis de diversos fármacos usando la superficie corporal en lugar del peso corporal, las bases para esta práctica no han sido validadas.33 Dado que el CL de CBZ se realiza fundamentalmente por metabolismo hepático y no en la piel, la incorporación al modelo de la SC podría representar una confusión en lugar de una asociación directa con el parámetro farmacocinético. Sin embargo, la conocida asociación de la SC con el volumen del hígado permite suponer que en realidad es este último, y no la SC, el que determina los cambios en el CL hepático de CBZ.34,35
En la construcción de nuestro modelo poblacional las variables continuas peso y edad no mostraron un efecto significativo en el CL de CBZ, no obstante que otros autores,5,8,9,36 han señalado que ambas variables muestran una relación inversa con el CL puesto que la eliminación de CBZ disminuye con el incremento en la edad y el peso, relación que es más evidente en estudios realizados en niños; este efecto es difícil de apreciar en población adulta debido a que las principales características farmacocinéticas prácticamente no varían en este grupo de pacientes debido a que la capacidad metabólica del hígado permanece relativamente constante.36
En relación con las variables categóricas analizadas en el modelo farmacocinético, se puede señalar que no se encontró una influencia significativa del SEXO sobre el CL de CBZ. Este resultado está de acuerdo con los aportados por otros autores9,37 que no encontraron diferencias con significación estadística en el CL de este fármaco observado en pacientes de diferente sexo. Por el contrario, otros investigadores58 han encontrado que las mujeres tienen un CL de CBZ más bajo que los hombres; probablemente esto es debido a que las mujeres tienen una elevada secreción de estrógenos, los cuales son capaces de inhibir a las enzimas microsomales.
Estudios previos han demostrado que la asociación de CBZ con otros fármacos antiepilépticos da lugar a un descenso de los niveles plasmáticos de CBZ, mientras que algunos de sus metabolitos, tales como la 10–11–epoxi–CBZ se incrementan cuando la CBZ se administra en régimen de monoterapia.5,17,38 La interacción de la CBZ con otros anticonvulsivantes, como fenobarbital y fenitoína, se manifiesta pri–mordialmente como un incremento en la biotrans–formación enzimática de CBZ; en el caso del AV la interacción involucra tanto un desplazamiento de CBZ en su unión a proteínas como una inhibición en su metabolismo, por lo tanto la concentración plasmática de CBZ podrá estar disminuida, aumentada o permanecer inalterada dependiendo del efecto que prevalezca tras la coadministración de AV y CBZ.17
La variable categórica, asociación con fenitoína (DFH), introducida en el modelo de forma multiplicativa, produce una mejoría en el ajuste que se pone de manifiesto en un descenso en la función objetivo de más de 15 unidades. El CL final del modelo de regresión mostró que DFH produce un incremento de 27.8% en este parámetro, lo cual, en principio, implicaría la administración de dosis de CBZ más elevadas para alcanzar concentraciones terapéuticas. Este resultado es similar a otros reportes8,39 y se han observado reducciones de las concentraciones plasmáticas de CBZ hasta en 40% en la asociación de DFH con CBZ.40
De acuerdo con el modelo final, la administración conjunta de CBZ y PRIM incrementa el CL de CBZ en 31%. La PRIM se metaboliza en 15 a 25% a fenobarbital, por lo tanto las interacciones de este último fármaco también rigen para PRIM. El fenobarbital es un inductor enzimático que incrementa el CL de CBZ tanto en adultos como en niños8,38,40 y no obstante que la administración concomitante de PRIM haría necesaria la administración de mayores dosis de CBZ, algunos autores han sugerido que en estas situaciones, el margen terapéutico de CBZ sería inferior (4–8 mg/L) al establecido cuando el fármaco se administra en monoterapia (4–12 mg/L), debido a que la relación epoxi–CBZ/CBZ se incrementa y este me–tabolito contribuye tanto al efecto antiepiléptico como a la toxicidad de CBZ.4142 Por tanto, cuando se recurre a la asociación con fenobarbital o PRIM, es probable que no se requieran aumentos en la dosis de fármaco a ser administrada. La influencia directa de fenobarbital en el modelo poblacional no se determinó dado que sólo a 1% de los pacientes incluidos en el estudio se les coadministró dicho fármaco.
No obstante a los resultados aportados por otros autores,43,44 en este trabajo la asociación de AV a los tratamientos con CBZ no mostró influencia significativa sobre el CL de este último fármaco. En este aspecto es preciso destacar la baja proporción de pacientes tratados simultáneamente con CBZ y AV (14%) en la población estudiada, lo cual unido al hecho de que esta influencia, cuando ha sido observada, es moderada, podría constituir la causa por la que no se hace evidente la interacción en este estudio. En el estudio realizado por Zheng y cois.,20 en una población de 585 chinos epilépticos, se demostró que la influencia del AV en el CL de CBZ está determinada por la dosis de AV administrada y proponen un modelo farmacocinético poblacional que prevé que el CL de CBZ está incrementado en 21% únicamente en pacientes a los que se les haya administrado en forma concomitante AV en dosis superiores a 18 mg/kg/día. Estos autores atribuyen este comportamiento al desplazamiento en la unión a proteínas de CBZ provocado por AV en altas concentraciones plasmáticas, lo cual incrementa la fracción libre de CBZ favoreciendo un aumento en la velocidad de eliminación de este fármaco. Sin embargo, este tipo de comportamiento no se caracterizó en nuestro trabajo debido a que la proporción de pacientes incluidos en el estudio que recibieron dosis de AV mayores de 18 mg/kg/día fue menor de 5%, lo cual no permite evaluar de manera estadísticamente confiable la influencia de esta covariable en función de la dosis administrada.
Los resultados obtenidos muestran que la dosis diaria, la superficie corporal y el tratamiento concomitante con DFH y PRIM, son factores que afectan significativamente la cinética de disposición de CBZ y, en consecuencia, deberían ser tenidos en cuenta en el establecimiento de un régimen de dosificación para este antiepiléptico en población adulta.
El modelo final propuesto permite estimar el CL de CBZ para diferentes pacientes adultos en función de dichos factores y ello hace posible predecir con cierto margen de confianza las concentraciones que alcanzará el fármaco en cada paciente o bien establecer el régimen de dosificación más adecuado para un paciente determinado de acuerdo con su superficie corporal y a la comedicación administrada (DFH o PRIM). El cuadro 4 muestra las dosis recomendadas de CBZ en función del peso corporal para un paciente promedio de 30 años de edad y altura de 1.65 m, determinadas para alcanzar una concentración plasmática media de CBZ de 8 mg/L en régimen de monoterapia y calculadas en función de CL obtenido en el modelo poblacional final.
Estos resultados pueden tener importantes implicaciones prácticas para la optimización de la terapia antiepiléptica en adultos dado que su utilización debería hacer posible la reducción de los requerimientos de monitorizar las concentraciones plasmáticas de este fármaco si la dosis se ajusta a priori de acuerdo con las características del paciente.
CONCLUSIONES
Este estudio realizado en una población apropiada de pacientes y con una metodología adecuada, permitió desarrollar un modelo farmacoestadístico poblacional que describe la influencia de las variables que afectan directamente y de manera significativa al CL de CBZ en pacientes epilépticos adultos mexicanos. La aplicación en la práctica clínica de este modelo deberá ir precedida de una correcta validación que garantice su adecuación a la población sobre la que va a ser utilizado. No obstante, se puede prever que el modelo final presentará una mejor capacidad predictiva en nuestra población que los parámetros descritos en la bibliografía. Por lo tanto, la implantación del modelo final propuesto adecuadamente validado permitirá su aplicación en la estimación a priori de la evolución de las concentraciones plasmáticas de CBZ en un paciente determinado, así como la monitorización de este fármaco utilizando estrategias basadas en algoritmos bayesianos.
AGRADECIMIENTOS
Este trabajo ha sido realizado con apoyo del Fondo de Apoyo a la Investigación (FAI) de la Universidad Autónoma de San Luis Potosí.
REFERENCIAS
1. Goodman GA. Las bases farmacológicas de la terapéutica. Vol. 1. 9a. edición. España: Editorial Panamericana; 2000, p. 491–506. [ Links ]
2. Spina E, Pisani F, Perucca E. Clinically significant pharmacokinetic drug interactions with carbamazepine. An update. Clin Pharmacokinet 1996; 31: 198–214. [ Links ]
3. MacKichan JJ. Carbamazepine. In: Taylor WJ, Diers Caviness MH (Ed). A textbook for the clinical application of therapeutic drug monitoring. Irving, Texas: Abbott Laboratories, Diagnostic Division; 1986, p. 211–22. [ Links ]
4. Battino D, Estienne M, Avanzini G. Clinical pharmacokinetics of antiepileptic drugs in paediatric patients. Part II: Phenytoin, Carbamazepine, Sultiame, Lamotrigine, Vigabatrin, Oxcarbamazepine and Felbamate. Clin Pharmacokinet 1995; 29: 341–69. [ Links ]
5. Liu H, Delgado MR. Influence of sex, age, weight and carbamazepine dose on serum concentrations, concentration ratio and level/dose ratios of carbamazepine and its metabolites. Ther Drug Monit 1994; 16: 469–76. [ Links ]
6. Martin ES, Crismon ML, Godley PJ. Postinduction carbamazepine clearance in adult psychiatric population. Pharmacotherapy 1991; 11: 296–302. [ Links ]
7. Reith DM, Hooper W, Parke J, Charles B. Population pharmacokinetic modeling of steady state carbamazepine clearance in children, adolescents and adults. J Pharmacokinet Biopharm 2001; 28: 79–92. [ Links ]
8. Summers B, Summers RS. Carbamazepine clearance in paediatric epilepsy patients: Influence of body mass, dose, sex and co–medication. Clin Pharmacokinet 1989; 17: 208–16. [ Links ]
9. Suzuki Y, Cox S, Hayes J, Walson PD. Carbamazepine age–dose ratio relationship in children. Ther Drug Monit 1991; 13: 201–8. [ Links ]
10. Sheiner LB, Grasela TH. An introduction to mixed effect modeling: concepts, definitions and justification. J Pharmacokinet Biopharm 1991; 19: 11S–24S. [ Links ]
11. Grasela TH, Sheiner LB. Pharmacostatistical modelling for observational data. J Pharmacokin Biopharm 1991; 19: 25S–36S. [ Links ]
12. Karlsson MO, Thomson AH, McGovern EM, Chow P, Evan TJ, Kelman AW. Population pharmacokinetics of rectal theophylline in neonates. Ther Drug Monit 1991; 13: 1995–2000. [ Links ]
13. Romano S, Fernández de Gatta MM, Calvo V, Méndez E, Dominguez–Gil A, Lanao JM. Population pharmacokinetics of amikacin in patients with haematological malignancies. J Antimic Chemother 1999; 44: 235–42. [ Links ]
14. Serrano BB, García–Sánchez MJ, Otero MJ, Buelga DS, Serrano J, Domínguez–Gil A. Valproate population pharmacokinetics in children. J Clin Pharm Ther 1999; 24: 73–80. [ Links ]
15. Delgado I, Santos B, García MJ, Otero MJ, Falcao AC, Domínguez–Gil A. Carbamazepine population pharmacokinetics in children: Mixed–Effect Models. Ther Drug Monit 1997; 19: 132–9. [ Links ]
16. Chan E. Population pharmacokinetics of carbamazepine in Singapore epileptic patients. Br J Clin Pharmacol 2001; 51: 567–76. [ Links ]
17. Yukawa E, Aoyama T. Detection of carbamazepine drug interaction by multiple peak approach screening using routine clinical pharmacokinetic data. J Clin Pharmacol 1996; 36: 752–9. [ Links ]
18. Graves NM. Population pharmacokinetics of carbamazepine in adults with epilepsy. Pharmacotherapy 1998; 18: 273–81. [ Links ]
19. Deleu D, Aarons L, Ahmed IA. Population pharmacokinetics of free carbamazepine in adult Omani epileptic patients. Eur J Clin Pharmacol 2001; 57: 243–8. [ Links ]
20. Zheng JZ, Zhong MK, Shi XJ, Hu M, Zhang JH. Population pharmacokinetics of carbamazepine in Chinese epilepsy patients. Ther Drug Monitor 2003; 25: 279–86. [ Links ]
21. Secretaría de Salud. Cuadro Básico y Catálogo de Medicamentos. Comisión Interinstitucional del Cuadro Básico de Insumos del Sector Salud, www.salud.gob.mx/unidades/csg/cuads_bas_cat2002/medica_2004.htm; 2004, p. 14–22. [ Links ]
22. Morselli PJ. Carbamazepine. Absorption, distribution and excretion. In: Levy RH, Dreifuss LE, Mattson RH, Meldrum BS, Penry JK, eds. Antiepileptic Drugs. Third Edition. New York (USA): Raven Press. Ltd.; 1989 p. 473–90. [ Links ]
23. Sheiner LB, Beal SL. Evaluation of methods for estimating population pharmacokinetic parameters. III. Monoexponential model: routine clinical pharmacokinetic data. J Pharmacokinet Bipharm 1983; 11: 303–19. [ Links ]
24. Whiting B, Kelman AW, Grevel J. Population pharmacokinetics. Theory and clinical application. Clin Pharmacokinet 1986; 11: 387–401. [ Links ]
25. Pynnonen S. Pharmacokinetics of carbamazepine in man: A review. Ther Drug Monitor 1979; 1: 409–31. [ Links ]
26. Mosteller RD. Simplified calculation of body–surface area. New Engl J Med 1987; p. 1098. [ Links ]
27. Beal SL, Sheiner LB. NONMEM User's Guide, Part V: Introductory Guide. NONMEM Project Group. San Francisco: University of California; 1992. [ Links ]
28. Grasela TH. Population pharmacokinetics: application to clinical trials. In: Smith RB. Kroboth PD, Juhl RP, eds. Pharmacokinetics and pharmacodynamics. Research design and analysis. Cincinnati: Harvey Witney Books (USA); 1986, p. 85–103 [ Links ]
29. Lee P. Design and power of a population pharmacokinetic study. Pharmaceutical Research 2001; 18: 75–82. [ Links ]
30. Hartley R, Lucock MD, Forsythe WI, McLain B. Factors influencing plasma level/dose ratios of carbamazepine and its major metabolites in epileptic children. Ther Drug Monit 1990; 12: 438–44. [ Links ]
31. Kumps A. Dose dependency between carbamazepine serum levels and dosage in patients with epilepsy. Ther Drug Monit 1981; 3: 271–4. [ Links ]
32. Sánchez A, Duran JA, Serrano JS. Steady–state carbamazepine plasma concentration–dose ratios in epileptic patients. Clin Pharmacokinet 1986; 11: 283–6. [ Links ]
33. Lack JA, Stuart ME. Calculation of drug dosage and body surface area of children. Br J Anaesth 1997; 78: 601–5. [ Links ]
34. Carles J, Kohen E, Midy D, Saric J, Videau J. Appreciation du volume hépatique en function de la morphologie de l'individu. Bull Assoc Anatom 1993; 77: 9–13. [ Links ]
35. De Land FH, North WA. Relationship between liver size and body size. Radiology 1968; 91: 1195–8. [ Links ]
36. Battino D, Bossi L, Croci D, Francechetti S, Gomeni C. Carbamazepine plasma levels in children and adults: Influence of age, dose, and asociated therapy. Ther Drug Monit 1980; 2: 315–22. [ Links ]
37. Lanchote V, Bonato P, Campo G, Rodrigues E. Factors influencing plasma concentrations of carbamazepine and carbamazepine–10–11–epoxide in epileptic children and adults. Ther Drug Monit 1995; 17: 47–52. [ Links ]
38. Bertilsson L, Tomson T. Clinical pharmacokinetics and pharmacological effects of carbamazepine and carbamazepine–10,11–epoxide. Clin Pharmacokinet 1986; 11: 177–98. [ Links ]
39. Eichelbaum M, Kothe KW, Hoffman F, Van Unruh G. Kinetic and metabolism of carbamazepine during combined antiepileptic drug therapy. Clin Pharmacol Ther 1979; 26: 366–71. [ Links ]
40. Rambeck B, May T, Juergens U. Serum concentrations of carbamazepine and its epoxide and diol metabolites in epileptic patients: the influence of dose and co–medications. Ther Drug Monit 1987; 9: 198–203. [ Links ]
41. Riva A, Contin M, Albani F. Free concentration of carbamazepine and carbamazepine–10–11–epoxide in children and adults: influence of age and phenobarbitone co–medication. Clin Pharmacokin 1985; 10: 524–31. [ Links ]
42. Levy RH, Bradley MK. Clinical pharmacokinetics of carbamazepine. J Clin Psychiatry 1988; 49(Suppl.4): 58–62. [ Links ]
43. Baciewicz AM. Carbamazepine drug interaction. Ther Drug Monit 1986; 8: 305–17. [ Links ]
44. Chang SL, Levy RH. Inhibitory effect of valproic acid on the disposition of carbamazepine and carbamazepine–10–11–epoxide in the rate. Drug Metabol Dispos 1986; 14: 281–6. [ Links ]















