Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.57 no.1 Ciudad de México ene./feb. 2005
Editorial
Actitud ante los inhibidores selectivos de COX–2
Attitude before COX–2 selective inhibitors
José Luis López–Zaragoza Alfonso Gulias–Herrero Carlos Gutiérrez–Cirios Ma. del Carmen Cárdenas–Cortés Eduardo Carrillo–Maravilla Hiram Terrazas–Solís Andrés Catzin–Kuhlmann Armando Flores–Rebollar Armando Villegas–Jiménez
José Luis López–Zaragoza
Dirección de Medicina
Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán
Correo electrónico: jllz@quetzal.innsz.mx
Recibido el 23 de febrero de 2005.
Aceptado el 23 de febrero de 2005.
Los inhibidores selectivos de ciclooxigenasa–2 (COX–2) o coxibs como una nueva clase de antiinflamatorios no esteroideos (AINES) se introdujeron en el mercado a partir de 1999 y desde entonces se han comercializado para uso clínico: celecoxib, etoricoxib, lumiracoxib, parecoxib y rofecoxib.
Su mecanismo de acción se basa en la inhibición selectiva y eficiente de conversión del ácido araquidónico a prostaglandina H2 por la COX–2, la cual se sobreexpresa en tejidos inflamados, sin inhibir los efectos citoprotectores y fisiológicos de la COX–1 en la mucosa gástrica y otros órganos. Los estudios de equivalencia han demostrado que para el control de la analgesia e inflamación son equiparables a las dosis terapéuticas de naproxeno, diclofenaco e ibuprofeno, sin embargo, se les reconoce una menor toxicidad gástrica. Y ésta ha sido el principal estímulo para la investigación, el uso clínico y la mercadotecnia que durante estos años ha constituido una esperanza en relación con los AINES no selectivos. Sin embargo, el futuro promisorio, ofrecido por estos inhibidores selectivos ha terminado. 1–4
En septiembre 30 de 2004, Merck & Co., Inc., anunció el retiro voluntario de rofecoxib (Vioxx®) del mercado de Estados Unidos y del mundo entero debido al incremento de casos de infarto agudo del miocardio (IAM) y enfermedad vascular cerebral (EVC) después de 18 meses de consumo continuo.5 A partir de entonces, se ha informado en la literatura médica y revisado de forma retrospectiva el riesgo cardiovascular (CV) que representan.6
MECANISMOS DE LA TROMBOSIS
Aunque de manera reciente se haya suspendido el uso de rofecoxib, a partir de 1999 se han postulado diversas hipótesis acerca de los mecanismos de los coxibs para promover la aterotrombosis. Por una parte inhiben la formación de prostaciclina (PGI2) –vía isoenzimas COX–2 en células endoteliales macrovasculares–, esta prostaglandina es un vasodilatador potente e inhibe a las células musculares lisas y la agregación plaquetaria. Sin embargo, los coxibs no inhiben la formación de tromboxano A2 (TXA2) –vía isoenzimas COX–1– y favorecen la agregación plaquetaria al inhibir PGI2. Estos dos mecanismos condicionan vasoconstricción, la activación plaquetaria y la proliferación celular de músculo liso.
Se ha postulado que la ateroesclerosis es una enfermedad inflamatoria. Los mediadores proinflamatorios de ésta inducen la sobreexpresión de COX–2 en monocitos, células endoteliales, músculo liso y macrófagos de la placa ateroesclerótica. Esta sobreestimulación aumenta la producción de eicosanoides, incluida la prostaglandina E2, la cual promueve la liberación y activación de metaloproteinasas de matriz extracelular que favorecen la migración de macrófagos, el desarrollo de placas ateroescleróticas y posteriormente su ruptura (Figura 1).
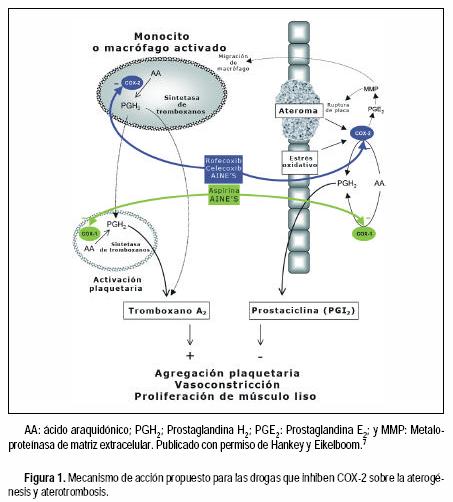
La sobreexpresión de la COX–2 condiciona la producción de TXA2, dado el gran contenido de sintetasa de tromboxanos y, por lo tanto, puede predisponer al desarrollo de aterotrombosis y eventualmente a la muerte. De manera alterna, la prostaglandina H2 producida por monocitos, macrófagos y células endoteliales puede ser utilizada por la sintetasa de tromboxanos plaquetaria, a través de un mecanismo de "metabolismo transcelular" y de ese modo no se requiere de la actividad de la COX–1 plaquetaria bloqueada por la aspirina. La COX–2 está presente en plaquetas y puede representar un mecanismo adicional en síntesis de tromboxanos y por lo tanto de trombogénesis.7
En el año 2000 se informó del desarrollo de trombosis en cuatro pacientes con enfermedad del tejido conectivo que recibían tratamiento con coxibs8 y en resultados de múltiples estudios de laboratorio se ha mostrado que la PGI2 modula las acciones cardiovasculares de TXA2; que la COX–2 regula la capacidad de las células cardiacas de sobrevivir a isquemia repetida en conejos y existen estudios donde se ha demostrado que la administración de celecoxib incrementa el riesgo de trombosis en coronarias caninas. Se ha informado que la inactivación irreversible de la aspirina sobre la COX–1 puede ser antagonizada por ibuprofeno y los coxibs. El orden de potencia para este proceso inhibitorio es ibuprofeno > celecoxib > valdecoxib > rofecoxib > etoricoxib. Al parecer el antagonismo involucra la competencia por el sitio enzimático activo.9
La seguridad cardiovascular de esta clase farmacoterapéutica ha sido cuestionada a la luz de diversas publicaciones recientes y que a continuación se detallan, con el fin de conocer el riesgo que conlleva su administración.
ESTUDIO VIGOR
La teoría trombogénica relacionada con los coxibs surgió con los resultados del estudio Vioxx Gastrointestinal Outcomes Research (VIGOR) realizado entre 1999–2000,10 el cual se diseñó para comparar la toxicidad gastrointestinal de rofecoxib y naproxeno en 8,076 pacientes con artritis reumatoide (AR). Se utilizaron dosis altas de ambos fármacos (50 mg vs. 1,000 mg al día, respectivamente) y con un periodo de seguimiento promedio de nueve meses. Se informó un incremento de 2.38 veces el riesgo relativo (RR), (IC 95%, 1.4 a 4.0, P = 0.0016) de eventos cardiovasculares trombóticos en los pacientes tratados con rofecoxib. El uso de aspirina no fue permitido a pesar que en 4% de la muestra incluida existía una indicación clara para ello, al final, estos pacientes constituyeron 38% de los complicados con IAM y presentaron eventos CV con mayor frecuencia, RR 4.9 (IC 95%, 1.4 a 16.9) probablemente debido a la existencia de aterotrombosis previa y sintomática. No se demostró asociación entre hipertensión e IAM. Efectivamente hubo un menor número de efectos gastrointestinales adversos en el grupo de rofecoxib que en el de naproxeno (3.5 vs. 4.9%) y la tasa de suspensión del tratamiento fue menor en el grupo de rofecoxib que en el de naproxeno (7.8 vs. 10.6%). De este estudio hay que resaltar que las dosis utilizadas fueron superiores a las empleadas de manera habitual, que si bien los efectos gastrointestinales fueron mínimos para el rofecoxib, tampoco fueron tan importantes en el grupo tratado con naproxeno, que los eventos CV se presentaron en un periodo relativamente corto de administración y que como conclusión se argumentó que el naproxeno proporcionaba un efecto "cardioprotector" que el rofecoxib no ofrecía y que esto fue dado por la inhibición selectiva de la COX–2 a dosis terapéuticas altas y que la menor tasa de IAM en el grupo tratado con naproxeno necesitaba confirmaciones futuras.
ESTUDIO CLASS
En el año 2000, el estudio CLASS comparó celecoxib contra ibuprofeno o diclofenaco en pacientes con osteoartrosis o AR y no demostró diferencias en IAM, sin embargo, se postuló un efecto protrombótico en pacientes que utilizaron celecoxib 11.
En una revisión posterior de este mismo informe se llevó a cabo una comparación con cuatro estudios más y paradójicamente concedió al celecoxib el no tener efecto en el número absoluto de IAM.12 Cleland, et al. postularon que las diferencias entre el estudio CLASS y el estudio VIGOR pudieron ser dadas por las dosis bajas de aspirina empleadas en el estudio CLASS y a la falta de aspirina en 4% de los pacientes con factores de riesgo CV del estudio VIGOR. Sin embargo, esa hipótesis puede ser falsa dado que en el estudio CLASS todos los pacientes que utilizaron aspirina presentaron tasas de IAM más elevadas que los pacientes que no la tomaron y este número de IAM en pacientes que ingieren aspirina puede ser considerado como un marcador de pacientes con riesgo CV elevado. Aunque en el estudio CLASS los eventos CV no se observaron con una frecuencia alta, su diseño no fue óptimo para la detección de estos eventos y se informó que el riesgo CV era probablemente un efecto de todos los coxibs.
Eric Topol, et al., en la Clínica Cleveland de Ohio realizaron un metaanálisis tomando en cuenta los estudios comparativos de los inhibidores selectivos de COX–2 VIGOR –8,076 pacientes–, CLASS –8,059 pacientes– y dos ensayos menores que comparan rofecoxib con nabumetona (1,000 pacientes en cada estudio) y se encontró que los pacientes que tomaban rofecoxib tenían más riesgo de desarrollar eventos CV mayores tales como angina inestable, IAM y EVC en comparación con el grupo que ingería naproxeno, RR 2.38 (IC 95% 1.39–4.0, P = 0.002) o placebo.13 Estos autores hicieron hincapié en la necesidad de caracterizar y determinar el riesgo verdadero mediante un ensayo prospectivo diseñado específicamente para ello.
ESTUDIO APPROVe
En el estudio multicéntrico, aleatorizado, controlado con placebo y doble ciego Adenomatous Polyp Prevention on Vioxx, (APPROVe), se investigó el efecto del tratamiento a tres años con rofecoxib en la recurrencia de pólipos neoplásicos del colon en pacientes con historia de adenomas colónicos. El estudio inició en el año 2000, ingresaron 2,586 pacientes y se compararon 25 mg de rofecoxib vs. placebo. Se estratificó por centro y uso o no uso de aspirina. Después de 18 meses de seguimiento, 26 pacientes del grupo que recibió placebo y 46 que tomaban rofecoxib habían presentado un evento tromboembólico grave, sin embargo, hay que resaltar que los pacientes en el grupo de rofecoxib utilizaron una mayor cantidad de antihipertensivos, hipolipemiantes y otros antiagregantes plaquetarios, lo cual de manera indirecta señala que estos pacientes tenían un mayor riesgo cardiovascular.
Las tasas de eventos absolutos fueron 0.78 eventos por 100 años–paciente para el placebo y 1.5 eventos por 100 años–paciente para el rofecoxib. Comparado con el placebo el grupo de rofecoxib presentó un mayor riesgo de eventos CV confirmados (riesgo relativo, 1.92: IC 95% 1.19–3.II).14 Este estudio se publicó recientemente y con sus resultados Merck® decidió retirar del mercado a rofecoxib.
ESTUDIO TARGET
El estudio The Therapeutic Artritis Research and Gastrointestinal Event Trial (TARGET) realizado en 18,325 pacientes con osteoartritis, de 50 años de edad o más, fueron aleatorizados a lumiracoxib 400 mg una vez al día, naproxeno 500 mg dos veces al día, o ibuprofeno 800 mg tres veces al día. Se estratificó para el uso de dosis bajas de aspirina y por edad. Se presentaron 18 eventos de IAM en los pacientes que ingerían lumiracoxib contra otros 10 casos de IAM en el grupo tratado con naproxeno; cuando se comparó lumiracoxib vs. ibuprofeno tampoco se demostraron diferencias significativas. Este estudio demostró una razón de riesgo no significativa de 1.77 (IC 95%, 0.82–3.84) para el desarrollo de IAM en pacientes asignados a los diferentes grupos y de forma independiente de la ingestión de aspirina. Se concluyó que la ingestión de lumiracoxib era un tratamiento apropiado para los pacientes con osteoartrosis, quienes tenían un riesgo CV elevado y quienes tomaban dosis bajas de aspirina. Sin embargo, el estudio presenta algunas limitantes, entre ellas la de tener un gran número de pérdidas en el seguimiento (> 20%) y el que los pacientes con enfermedad vascular establecida, que podrían ser los pacientes más vulnerables, fueron excluidos de este estudio al igual que en el estudio CLASS.15
ESTUDIO CORONARY–ARTERY BYPASS GRAFTING (CABG) SURGERY
Entre 2003 y 2004 un ensayo clínico controlado, comparó parecoxib y valdecoxib contra placebo para el control de dolor postoperatorio en pacientes a quienes se les realizó cirugía de revascularización cardiaca y mostró un mayor número de IAM y EVC en aquellos pacientes asignados a los coxibs –oral y parenteral–, con tan sólo 10 días de tratamiento total y a un mes de seguimiento. Los pacientes con al menos un evento adverso confirmado se presentaron en 7.4% en cada grupo coxib vs. 4.0% en el grupo placebo, con una razónde riesgo de 1.9 (IC 95% 1.1 a 3.2; P = 0.02), para cada comparación contra el grupo placebo. Los eventos CV (incluidos IAM, muerte de origen cardiaco, EVC y embolismo pulmonar) fueron más frecuentes entre los pacientes tratados con parecoxib y valdecoxib: 2.0% vs. 0.5%; razón de riesgo, 3.7 (IC 95%, 1.0 a 13.5; P = 0.03). Los eventos CV se presentaron a pesar de la administración de aspirina. Tomando como conclusión que su uso se asocia con una incidencia mayor de eventos CV y cuestionando su utilidad en tales circunstancias.16
En mayo de 2004 se publicó un estudio de casos y controles que incluyó 54,475 pacientes de seis años de edad en adelante y que investigó la asociación de IAM y la ingestión de diversos AINES, se encontraron 10,895 casos de IAM y a continuación se parearon con cuatro controles con base en la edad, género y mes de aparición del IAM. Se encontró que la ingestión habitual de rofecoxib estaba asociada con una razón de momios (OR) mayor de padecer IAM en comparación con celecoxib (1.24; IC 95%: 1.05 – 1.46, P = 0.011) y comparando con otros AINES (1.14; IC 95% 1.00–1.31; P = 0.054). Se realizó un ajuste por la dosis ingerida y por los días de tratamiento y se encontró que a mayor dosis ingerida mayor era la razón de momios y que el riesgo CV del uso de rofecoxib entre uno y 90 días era mayor comparado con celecoxib, pero que después de 90 días el riesgo de desarrollar IAM no mostraba diferencias (0.96; IC 95%, 0.72 a 1.25). El uso de celecoxib no se asoció con un aumento de casos de IAM y sugirió que el uso de rofecoxib por un periodo aún más corto que en el estudio VIGOR era también un factor de riesgo.17
Posteriormente fue publicado otro análisis que comparó cohortes diferentes y poblaciones no relacionadas, con observaciones indirectas y no aleatorizadas donde se mostró que los riesgos relativos para la comparación entre celecoxib y otros AINES no era significativa ni para la población entera ni para el subgrupo de pacientes que no tomaba aspirina.18 Dado el diseño de este estudio, es por lo que las conclusiones deben tomarse con reserva.
ESTUDIO APC
Con base en lo anterior, la seguridad de celecoxib fue cuestionada por el Instituto Nacional de Cáncer de Estados Unidos que de manera reciente suspendió el estudio Adenoma Prevention with Celecoxib (APC). Los pacientes que ingerían 400 mg y 800 mg al día y con una duración promedio del tratamiento de 33 meses, mostraron tener un riesgo 2.5 veces mayor para el desarrollo de un evento CV grave comparado con el grupo placebo. La incidencia anual de muerte de origen CV, EVC, IAM o insuficiencia cardiaca fue de 3.4 eventos por 1,000 años–paciente en el grupo placebo, 7.8 eventos por 1,000 años–paciente en el grupo de celecoxib a 200 mg dos veces al día y de 11.4 eventos en el grupo que se le administró 400 mg dos veces al día.19
De este estudio se desprende que las dosis empleadas fueron mayores a las recomendadas para el control del dolor y de la inflamación, que el tiempo de administración fue prolongado y que los eventos CV se presentaron a pesar de la administración concomitante de aspirina. Aunque éstos son hallazgos importantes que podrían culminar con la suspensión del mercado de celecoxib, FDA analizará los resultados disponibles, para llevar a cabo una acción reguladora en las próximas semanas.
ESTUDIO KAISER PERMANENTE
En el estudio de casos y controles de la cohorte Kaiser Permanente de California, entre 1999 y 2001, se estudiaron a todos los consumidores de AINES, con edades entre 18 y 84 años. Los pacientes con IAM y con muerte súbita cardiaca fueron identificados y pareados con cuatro controles para edad, género y plan de salud por región y se comparó el uso habitual de coxibs y AINES no selectivos contra la exposición remota a cualquier AINE y de forma adicional se comparó rofecoxib vs. celecoxib. Se obtuvieron 2.302,029 años–persona de seguimiento, con 8,143 casos de enfermedad coronaria, de los cuales 2,210 (27.1%) fueron letales. La razón de momios multivariada de rofecoxib contra celecoxib para todas las dosis, fue de 1.59 (IC 95%, 1.10–2.32, P = 0.015); para rofecoxib 25 mg/día o menos, 1.47 (IC 95%, 0.99–2.17, P = 0.054); y para rofecoxib más de 25 mg/día, 3.58 (IC 95%, 1.27–10.11, P = 0.016). Para naproxeno contra el uso remoto de AINES la razón de momios ajustada fue de 1.14 (IC 95%, 1.00–1.30, P = 0.05) y se concluyó que el uso de rofecoxib añadió riesgo de enfermedad coronaria grave cuando se comparó contra el uso de celecoxib. A diferencia del estudio VIGOR el uso de naproxeno no protegió de enfermedad coronaria grave. Con base en estos resultados, la interpretación brindada al público fue que rofecoxib pudo ser responsable de un total de 88,000 a 140,000 casos adicionales de enfermedad cardiaca tan sólo en Estados Unidos entre 1999 y 2004.20
NAPROXENO Y RIESGO CARDIOVASCULAR
El efecto antiagregante plaquetario del naproxeno está basado en la revisión sistemática de todos los estudios de rofecoxib conducidos por Merck® (menos efectos cardiovasculares en el grupo de naproxeno) y tres estudios recientes de casos y controles que encontraron que éste se asocia con una reducción modesta (16 a 39%) para el desarrollo de arteriopatía coronaria grave. Sin embargo, no todos los estudios han demostrado este efecto cardioprotector.
A partir del año 2000 en la literatura médica se ha manifestado el interés del efecto benéfico de los AINES en la enfermedad de Alzheimer. Su uso fue promovido por resultados de estudios previos donde se ha argumentado que existen mecanismos inflamatorios que contribuyen con la progresión de esta enfermedad.21 Dado que al inicio existían efectos promisorios en el uso de AINES fueron diseñados ensayos clínicos controlados con el fin de demostrar tal efecto.22 Aisen, et al. demostraron que tras un año de tratamiento y seguimiento, el rofecoxib y las dosis bajas de naproxeno no disminuyen la progresión del deterioro cognitivo en esta enfermedad.23 Sin embargo, en otra revisión se encontraron datos que sugerían que los AINES podrían mejorar dicho deterioro.24 Con el empleo de rofecoxib o placebo, se apreció que en hombres con Alzheimer las tasas de eventos CV trombóticos eran similares y que debido a que la totalidad de los datos no era consistente con un aumento en el riesgo CV en pacientes que ingerían rofecoxib, los Institutos Nacionales de Salud de Estados Unidos (NIH) financiaron el Alzheimer's Disease Anti–Inflammatory Prevention Trial (ADAPT) para comprobar este efecto. Sin embargo, este estudio fue suspendido en diciembre de 2004 debido al número "elevado" de eventos cardiovasculares. La información emitida por los NIH (http://www.nih.gov/news/pr/dec2004/od-20.htm) no es precisa, debido a que no se brindan detalles de los casos que se presentaron en el grupo asignado a naproxeno, a celecoxib y al grupo placebo. Se informó que el número de eventos cardiovasculares fue 50% mayor en el grupo tratado con naproxeno que en el grupo placebo. De acuerdo con los autores, los eventos adversos ocurrieron solamente en 3.7% del grupo que recibió naproxeno, comparado con 2.5% de eventos presentes en el grupo placebo, riesgo pequeño, tomando en cuenta que los participantes eran mayores de 70 años de edad (http://www.acponline.org/weekly/2005/2/8/index.html).
OTROS EVENTOS ADVERSOS
Al igual que todos los AINES no selectivos, en el rubro de los eventos adversos se han informado casos del empeoramiento de la hipertensión arterial, agravamiento de la insuficiencia cardiaca, de mayor riesgo de hemorragia cuando se combinan con antagonistas de la vitamina K, de disfunción renal, de reacción dérmica fija a drogas, de meningitis aséptica recurrente, etc.25 32 De manera relevante se han presentado casos de disminución momentánea de la agudeza visual al utilizar rofecoxib y celecoxib. En cuatro de siete pacientes informados (edad promedio 67.2 años) el tiempo de aparición después de la ingestión fue una semana o menos, uno de los pacientes presentó la disminución pocas horas después de la ingestión del coxib y en la mayoría de los pacientes se apreció una mejoría de los síntomas después de la suspensión del fármaco. En el año 2003 este evento se había informado en los siguientes casos, para celecoxib 230; rofecoxib 244; diclofenaco 410; ibuprofeno 429 e indometacina 262. Como se observa, las frecuencias parecen ser menores para los coxibs, sin embargo, esto puede ser debido a un efecto confusor y/o estar relacionado con el tiempo de uso clínico, debido a que no todos estos productos comparten el mismo periodo en uso. Se ha argumentado que la inhibición en la síntesis de las prostaglandinas y otros compuestos relacionados son la génesis de estas alteraciones.33
LECCIONES APRENDIDAS
La FDA ha anunciado que analizará toda la información disponible sobre los AINES selectivos y no selectivos para determinar si se deben adoptar nuevas medidas, las cuales serán publicadas en los próximos meses, http://www.fda.gov/cder/drug/analgesics/default.htm.
En México, la Secretaría de Salud, a través del Consejo Científico de la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS), incluirá un "inserto" (dentro de la caja de los coxibs) con la información precautoria para el empleo de estos medicamentos en pacientes con enfermedades cardiovasculares, renales, hipertensión arterial y diabetes mellitus. Por otro lado, invita a informar de cualquier tipo de reacción negativa que pudiera presentarse en los consumidores de estos productos. Recomienda a los médicos enfatizar las precauciones que se deben tener al administrarlos a pacientes con enfermedades adicionales y puntualiza que estos medicamentos "siguen siendo seguros para la población que los consume".
A estas recomendaciones agregaríamos que es claro que se requieren estudios designados específicamente para examinar el impacto de cada coxib en el riesgo CV tanto en pacientes susceptibles como en no susceptibles. Que se deben plantear otras consideraciones enfocadas a otros mecanismos fisiopatológicos por el potencial riesgo CV asociado a la inhibición de COX–2 y dado que los resultados de estos estudios son preliminares, que existen datos discordantes y que mientras FDA realiza la revisión minuciosa de éstos y futuros datos, es recomendable que los coxibs sean administrados con cautela, solamente en pacientes en quienes su eficacia y eficiencia hayan sido demostradas y con un monitoreo exhaustivo de desenlaces y eventos adversos. Esto es particularmente importante en pacientes ancianos, pacientes con enfermedad cardiovascular o renal o en quienes otros factores de riesgo pueden predisponerlos al desarrollo de complicaciones CV.
A los médicos que prescriban celecoxib o valdecoxib se recomienda considerar la información emergente en los últimos y próximos meses y valorar el riesgo–beneficio de este tipo de terapia al aplicarlo en pacientes individuales. Los pacientes que tienen riesgo elevado de hemorragia gastrointestinal, quienes tienen historia de intolerancia a AINES no selectivos o quienes son refractarios a estos últimos, deben ser considerados como candidatos a recibir coxibs y en quienes se empleen, se deberá hacer a la dosis mínima posible y por el menor tiempo necesario. Se recomienda evitar su administración en pacientes mayores de 65 años, con antecedente de enfermedad cardiovascular o cerebrovascular activas y que en caso de utilizarlos, no posponer o retirar la terapia con aspirina a dosis inhibitorias de la agregación plaquetaria. Los autoconsumidores deben ser advertidos que cada AINE debe ser empleado en acuerdo estricto con la prescripción y que en las terapias con AINES por tiempo prolongado se debe consultar al médico.
Como se ha observado, el riesgo de eventos CV asociado a naproxeno es bajo y el uso del mismo para el control del dolor se debe realizar tomando en cuenta el riesgo–beneficio.
Finalmente, queremos enfatizar que la experiencia con los coxibs es una más de las muchas que se han registrado en el historial del desarrollo de un nuevo fármaco; que la toxicidad CV se ha presentado en un tiempo "razonable" para su detección, análisis y toma de medidas reguladoras; que la fase en la que se han detectado los eventos CV es la fase 4, en la cual se lleva a cabo la vigilancia farmacoepidemiológica, que es responsabilidad tanto de las agencias reguladoras como de todos los médicos que utilizan los nuevos medicamentos. Por lo que, una actitud razonable hacia el futuro se resume en el proverbio que recomienda ser al médico "ni el primero en aceptar lo nuevo, ni el último en desechar lo viejo"34 y tratar de analizar con cautela el beneficio real, así como evaluar los eventos y reacciones secundarias a los nuevos tratamientos.
REFERENCIAS
1. Hawkey CJ COX–2 inhibitors. Lancet 1999; 353(9149): 307–13. [ Links ]
2. Fitzgerald GA, Patrono C. The coxibs, selective inhibitors of cyclooxygenase–2. N Engl J Med 2001; 345(6): 433–42. [ Links ]
3. Clemett D, Goa KL. Celecoxib: a review of its use in osteoarthritis, rheumatoid arthritis and acute pain. Drugs 2000; 59(4): 957–80. Erratum in: Drugs 2001; 61(4): 498. [ Links ]
4. Ormrod D, Wellington K, Wagstaff AJ. Valdecoxib. Drugs. 2002; 62(14): 2059–71; discussion 2072–3. [ Links ]
5. Debashis S. Merck withdraws arthritis drug worldwide. BMJ 2004; 329: 816. [ Links ]
6. Pedros C, Cereza G, Laporte JR. First spontaneous reports of adverse reactions to the new selective COX–2 non–steroidal anti–inflammatory drugs. Med Clin (Bare) 2002; 118(11): 415–17. [ Links ]
7. Hankey GJ, Eikelboom JW. Cyclooxy–genase–2 inhibitors: are they really atherothrombotic, and if not, why not? Stroke 2003; 34(11): 2736–40. [ Links ]
8. Croofford LJ, Oates JC, McCune WJ, et al. Thrombosis in patients with connective tissue diseases treated with specific cyclooxigenase–2 inhibitors: a report of four cases. Arthritis Rheum 2000; 43: 1891–6. [ Links ]
9. Ouellet M, Riendeau D, Percival MD. A high level of cyclooxygenase–2 inhibitor selectivity is associated with a reduced interference of platelet cyclooxygenase–1 inactivation by aspirin PUBLISHED ON LINE http:// www.pnas.org/cgi/content/abstract/98/25/14583. Accessibility verified February 21, 2005. [ Links ]
10. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos–Vargas R, Davis B, et al., VIGOR Study Group. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N Engl J Med 2000; 43(21): 1520–8. [ Links ]
11. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et. al. Gastrointestinal toxicity with celecoxib vs. nonsteroidal anti–inflammatory drugs for osteoarthritis and rheumatoid arthritis: The CLASS Study: A randomized controlled trial celecoxib long–term arthritis safety study. JAMA 2000; 284(10): 1247–55. [ Links ]
12.Cleland LG, James MJ, Stamp LK, Penglis PS. COX–2 inhibition and thrombotic tendency: a need for surveillance. Med J Aust 2001; 175: 214–17. [ Links ]
13. Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX–2 inhibitors. JAMA 2001; 286(8): 954–9. [ Links ]
14. Bresalier RS, Sandier RS, Quan H, Bolognese JA, Oxenius B, Horgan K, et al. for the Adenomatous Polyp Prevention on Vioxx (APPROVe) Trial Investigators Cardiovascular Events Associated with rofecoxib in a colorectal adenoma chemoprevention trial published on line at www.nejm.org February 15, 2005 (10.1056/NEJMoa050493). Accessibility verified February 21, 2005. [ Links ]
15. Farkouh ME, Kirshner H, Harrington RA, Ruland S, Verheugt FW, Schnitzer TJ, TARGET Study Group. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), cardiovascular outcomes: randomised controlled trial. Lancet 2004; 364(9435): 675–84. [ Links ]
16. Nussmeier NA, Whelton AA, Brown MT, Langford RM, Hoeft, Parlow JL, Boyce SW, Verburg KM. Complications of the COX–2 inhibitors parecoxib and valdecoxib after cardiac surgery Published on line at www.nejm.org February 15, 2005 (10.1056/NEJ–Moa050330). Accessibility verified February 21, 2005. [ Links ]
17. Solomon DH, Schneeweiss S, Glynn RJ, Kiyota Y, Levin R, Mogun H. Relationship between selective cyclooxygenase–2 inhibitors and acute myocardial infarction in older adults. Circulation 2004; 109(17): 2068–73 [ Links ]
18. White WB, Faich G, Borer JS, Makuch RW. Cardiovascular thrombotic events in arthritis trials of the cyclooxygenase–2 inhibitor celecoxib. Am J Cardiol 2003; 92(4): 411–18. [ Links ]
19. Solomon SD, McMurray JV, Pfeffer MA, Wittes J, Fowler R, Finn P, Anderson WF, Zauber A, Hawk E, Bertagnolli M for the Adenoma Prevention with Celecoxib (APC) Study Investigators Cardiovascular Risk Associated with Celecoxib in a Clinical Trial for Colorectal Adenoma Prevention Published on line at www.nejm.org February 15, 2005 (10.1056/NEJ–Moa050405) . Accessibility verified February 21, 2005. [ Links ]
20. Graham DJ, Campen D, Hui R, Spence M, Cheetham C, Levy G, Shoor S, Ray WA. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclo–oxygenase 2 selective and non–selective non–steroidal anti–inflammatory drugs: nested case–control study. Lancet 2005; 365(9458): 475–81. [ Links ]
21. Etminan M, Gill S, Samii A. Effect of non–steroidal anti–inflammatory drugs on risk of Alzheimer's disease: systematic review and meta–analysis of observational studies. BMJ 2003; 327(7407): 128. [ Links ]
22. Aisen PS, Schmeidler J, Pasinetti GM. Randomized pilot study of nimesulide treatment in Alzheimer's disease. Neurology 2002; 58(7): 1050–4. [ Links ]
23. Aisen PS, Schafer KA, Grundman M, Pfeiffer E, Sano M, Davis KL, Farlow MR, Jin S, Thomas RG, Thai LJ. Alzheimer's Disease Cooperative Study. Effects of rofecoxib or naproxen vs. placebo on Alzheimer disease progression: a randomized controlled trial. JAMA 2003; 289(21): 2819–26. [ Links ]
24. Etminan M, Gill S, Samii A. Effect of non–steroidal anti–inflammatory drugs on risk of Alzheimer's disease: systematic review and meta–analysis of observational studies BMJ 2003; 327(7407): 128. [ Links ]
25. Weir MR, Sperling RS, Reicin A, Gertz BJ. Selective COX–2 inhibition and cardiovascular effects: a review of the rofecoxib development program. Am Heart J 2003; 146(4): 591–604. [ Links ]
26. Verrico MM, Weber RJ, McKaveney TP, Ansani NT, Towers AL. Adverse Drug Events Involving COX–2 Inhibitors. Ann Pharmacother 2003; 37(9): 1203–13. [ Links ]
27. Freedman GM, Kreitzer JM, Badola Ruchi. Rofecoxib–associated upper gastrointestinal bleed: a case report. Mt Sin J Med 2002; 106. [ Links ]
28. Bing RJ. Cyclooxygenase–2 inhibitors: is there an association with coronary or renal events? Curr Atheroscler Rep 2003; 5(2): 114–17. [ Links ]
29. Papaioannides D, Bouropoulos C, Sina–pides D, Korantzopoulos P, Akritidis N. Acute renal dysfunction associated with selective COX–2 inhibitor therapy. Int Urol Nephrol 2001; 33(4): 609–11. [ Links ]
30. Kaur C, Sarkar R, Kanwar AJ. Fixed drug eruption to rofecoxib with cross–reactivity to sulfonamides. Dermatology 2001; 203(4): 351. [ Links ]
31. Gagnon R, Julien M, Gold P. Selective celecoxib–associated anaphylactoid reaction. J Allergy Clin Immunol 2003; 111(6): 1404–5. [ Links ]
32. Ashwath ML, Katner HP. Recurrent aseptic meningitis due to different non–steroidal anti–inflammatory drugs including rofecoxib. Postgrad Med J 2003; 79(931): 295–6. [ Links ]
33. Coulter DM, Clark DW, Savage RL. Celecoxib, rofecoxib, and acute temporary visual impairment. BMJ 2003; 327: 1214–15. [ Links ]
34. Nies AS. Principles of therapeutics. In: Goodman and Gilman. The pharmacological basis of therapeutics. 10th edit. USA: McGraw–Hill, 2001, p. 63. [ Links ]














