Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.56 no.2 Ciudad de México abr. 2004
Rev Invest Clín 2004; Vol. 56(2):193-208
ARTÍCULO ESPECIAL
Anormalidades metabólicas en pacientes con infección por VIH
Metabolic abnormalities in patients with HIV infection
Sandra I. Rodríguez Carranza*
Carlos A. Aguilar Salinas*
*Departamento de Endocrinología y Metabolismo. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
Reimpresos:
Dra. Sandra I. Rodríguez Carranza
Departamento de Endocrinología y Metabolismo. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
Vasco de Quiroga 15, Tlalpan. 14000, México, D.F.
Tel.: 5513-3891 Fax: 5513-0002
Recibido: 25 de marzo de 2003.
Aceptado: 3 de noviembre de 2003.
RESUMEN
La terapia antirretroviral altamente activa (TARAA) en pacientes con infección por virus de inmunodeficiencia humana (VIH) disminuyó la morbimortalidad del padecimiento, sin embargo, sus efectos sobre el metabolismo de lipoproteínas, carbohidratos y tejido adiposo son causa frecuente de consulta y en el futuro de morbimortalidad. Nuestro objetivo es describir el estado actual del conocimiento sobre la epidemiología, fisiopatología, diagnóstico y tratamiento de estas complicaciones. Se incluye un análisis crítico de las evidencias existentes. La dislipidemia es multifactorial. Antes del inicio del tratamiento es común encontrar hipertrigliceridemia con concentraciones bajas de colesterol y colesterol HDL. Los medicamentos antirretrovirales, en especial algunos inhibidores de proteasas, tienen efectos adversos sobre el metabolismo de lipoproteínas. A ello se suma la recuperación nutricional y se agrava en presencia de lipodistrofia. El efecto final es hipertrigliceridemia (moderada a severa, en especial con ritonavir) con hipercolesterolemia moderada (< 300 mg/dL). La grasa subcutánea en cara y extremidades inferiores disminuye y se deposita en sitios anormales (cuello, grasa intraabdominal). La evaluación y el tratamiento de estas complicaciones es controversial debido a la falta de evidencias. Las alteraciones metabólicas asociadas a TARAA serán una de las principales causas de morbimortalidad en los próximos años. Por ello, se requieren estudios longitudinales en distintos grupos étnicos que evalúen los determinantes de estas complicaciones y mejores estrategias de prevención y tratamiento. La interacción entre endocrinólogos, infectólogos y otros especialistas será cada vez más frecuente e indispensable en este campo.
PALABRAS CLAVE. Virus de inmunodeficiencia humana. Dislipidemias. Antirretrovirales. Inhibidores de proteasas. Lipodistrofia.
ABSTRACT
Highly active antiretroviral therapy (HAART) decreased the mortality of patients with HIV infection, but its effects on the metabolism of lipoproteins, carbohydrates and adipose tissue are a common cause for seeking treatment. Our purpose is to present the current knowledge available regarding the epidemiology, pathophysiology, diagnosis and treatment of these conditions. A discussion about the limitations of the current evidence is included. HIV-related dyslipidemia is multifactorial. Prior to the treatment, hypertriglyceridemia is found frequently,usually with low cholesterol and HDL cholesterol levels. Antiretroviral agents, especially some protease inhibitors, have adverse effects on plasma lipids. Nutritional recovery and lipodistrophy exacerbate the lipid abnormalities. Hypertriglyceridemia (usually moderate to severe) and moderate hypercholesterolemia (< 300 mg/dL) are the most common end-results. Subcutaneous fat of the face and limbs decreases and it is deposited in the neck and in the abdomen. The diagnosis and treatment of these conditions are controversial due to the lack of appropiate evidence. The metabolic complications of HAART could be a leading cause of mortality in the near future. Thus, longitudinal studies, including subjects from several ethnic groups are needed to identify the main factors involved in the pathophysiology and to assess several therapeutical and preventive strategies. Collaboration between HIV specialists and other health professionals (i.e. endocrinologysts) will be required to accomplish these goals.
KEY WORDS. Human immunodeficiency virus. Dyslipidemias. Antiretrovirals. Protease inhibitors. Lipodistrophy.
INTRODUCCIÓN
La terapia antirretroviral altamente activa (TARAA) en pacientes con infección por virus de inmunodeficiencia humana (VIH) disminuyó la morbimortalidad del padecimiento. Durante el periodo de 1995 a 1997, la mortalidad relacionada a VIH en los Estados Unidos disminuyó de 29.4 a 8.8 por 100 personas por año. 1 Las reducciones mayores coincidieron con la introducción de los inhibidores de proteasas (IP). Los diferentes regímenes de TARAA incluyen la combinación de medicamentos de tres diferentes categorías: inhibidores de transcriptasa reversa de tipo nucleósido (ITRN), inhibidores de transcriptasa reversa de tipo no nucleósido (ITRNN) e inhibidores de proteasas (IP). Los ITRNN y los ITRN inhiben a la transcriptasa reversa y suprimen la replicación del genoma viral. Los IP inhiben la maduración del virus, limitando la infectividad de las partículas virales. Los regímenes más frecuentes incluyen dos ITRN (abacavir, didanosida, lamivudina, estavudina, zalcitabina, zidovudina) en combinación con uno o dos IP (amprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir) y/o un ITRNN (efavirenz, nevirapina). Sin embargo, los antirretrovirales producen efectos adversos metabólicos similares a lo observado en el síndrome metabólico. Las anormalidades incluyen dislipidemia, lipodistrofia o lipoatrofia, intolerancia a la glucosa o diabetes, acidosis láctica, hiperfibrinogenemia, concentraciones altas de proteína C-reactiva, apolipoproteína B, inhibidor del activador de plasminógeno tipo 1, disminución en la vasodilatación arterial mediada por flujo y aumento en el grosor de la íntima de la arteria carótida. La consecuencia esperable es aceleración de la ateroesclerosis. 2-5 El objetivo de esta revisión es describir la fisiopatología, diagnóstico y tratamiento de las alteraciones metabólicas de los pacientes con VIH.
COMPLICACIONES CARDIOVASCULARES
Antes de la introducción de TARAA, la enfermedad coronaria se asociaba al propio VIH, o bien a citomegalovirus. En años recientes, existen múltiples reportes de eventos coronarios agudos en pacientes que reciben tratamiento con IP. Pese a ello, aún no es posible cuantificar con certeza el riesgo cardiovascular del paciente con VIH, ya que no existen estudios prospectivos con el poder suficiente para ello. La evidencia actual proviene de estudios retrospectivos o de cohortes pequeñas. Por ejemplo, el estudio retrospectivo de Frankfurt encontró un aumento de cuatro veces en la incidencia de infarto agudo al miocardio después de la introducción de regímenes de TARAA comparado con la etapa previa a ese tipo de tratamiento. 6 El uso de IPs asoció en forma independiente a la incidencia del infarto agudo al miocardio. Dos estudios transversales aportan conclusiones similares. 5,7 En uno de ellos hubo aumento del número de eventos vasculares en relación con la duración con el tratamiento con IPs. 7 Klein informó al estudiar 4,541 pacientes de 1996 al 2000, que la tasa de eventos cardiovasculares fue mayor en los pacientes con VIH comparada contra la de los controles (2.8 eventos por 1,000 personas por año), 4 pero la diferencia no fue explicada por el empleo de los IP (5.8 vs . 5.2 eventos por 1,000 personas por año entre los que usaron o no IP). Otro estudio retrospectivo 8 mostró que en 36,766 casos tratados de 1995 a 2001, la mortalidad global disminuyó 75%, mientras que la tasa de admisión hospitalaria o muerte por enfermedad cardiovascular o cerebrovascular permaneció constante. En este informe no se encontró asociación entre el tipo de antirretroviral y la incidencia de eventos vasculares. Finalmente, estudios que evalúan ateroesclerosis subclínica no han sido concluyentes, pese a que diversos métodos han sido empleados (espesor de la íntima media de arterias carótidas, función endotelial (reactividad braquial), tomografía computarizada con electrones, etc.). 9 Evidencias prospectivas son escasas. El estudio HOPS (HIV Outpatient Study), reporte prospectivo observacional de 5,672 pacientes seguidos desde 1992, 10 mostró que la incidencia de infarto del miocardio aumentó con el uso de IP (razón de momios 7.1, IC 95%1.6-44.3). De los casos tratados con IP (n = 3,247), 19 tuvieron un evento vascular; en contraste sólo dos de los 2,425 sujetos que no emplearon IP tuvieron esta complicación. La independencia de la asociación persistió al ajustar por la presencia de confusores, sin embargo, el número de eventos vasculares es pequeño para establecer conclusiones. En resumen, los IP probablemente aumentan el riesgo de sufrir eventos vasculares. Las complicaciones vasculares aumentarán su frecuencia en el futuro, ya que la población envejecerá aumentando la posibilidad de interactuar con otros factores asociados con la ateroesclerosis. 11-15 Una complicación adicional resultante del daño vascular será un aumento en la incidencia de insuficiencia cardiaca. 6
Datos en modelos experimentales apoyan la aterogenicidad de los IP. Dressman 16 demostró que 3 IPs aceleran la formación de células espumosas; este efecto se observó aun en ausencia de hiperlipidemia. Demostró que el acúmulo de lípidos en los macrófagos se explica por aumento en la actividad del receptor CD36; su ausencia (en un modelo transgénico) evitó la aparición de las lesiones causadas por los IPs. Estos datos pueden ser útiles para identificar posibles marcadores de riesgo cardiovascular en pacientes tratados con IP (ej. actividad CD36 en polimorfonucleares).
HIPERLIPIDEMIA
Puede ser explicada por varios mecanismos: efectos de la infección viral, recuperación nutricional, acciones adversas de los antirretrovirales y cambios inducidos por la aparición de la lipodistrofia. Cada componente se describirá a continuación:
1. Infección por VIH. La infección por VIH asintomática se asocia con una disminución temprana en las concentraciones plasmáticas de colesterol de alta densidad (HDL). 17 La progresión hacia enfermedad sintomática y a síndrome de inmunodeficiencia adquirida (SIDA) causa mayor disminución del colesterol HDL, disminución del colesterol total, elevación de triglicéridos y acumulación de las subclases pequeñas y densas de las LDL. Los niveles de colesterol HDL son menores en pacientes con cuentas bajas de linfocitos CD4. 18 Las anormalidades son una respuesta inespecífica a una infección con repercusión sistémica; existe relación entre las concentraciones plasmáticas de triglicéridos con las concentraciones de β2-microglobulina y de factor de necrosis tumoral-α, o de interferón-γ. 17,19 La hipertrigliceridemia se debe a disminución de la actividad de la lipasa liproteica, debido al acúmulo sanguíneo de sus inhibidores (ej. ácidos grasos). La producción hepática de lipoproteínas es anormalmente baja, hecho que limita la severidad de la hipertrigliceridemia.
2. Recuperación nutricional El inicio del TARAA causa recuperación del peso y del estado de nutrición. Como resultado, la producción hepática de lipoproteínas aumenta. Por ello, las concentraciones de los lípidos sanguíneos regresan a las concentraciones previas a la infección. En muchos estudios que analizaron el efecto del TARAA no han disecado este confusor; por ello, se sobreestima la magnitud de los efectos adversos del tratamiento. Los datos de Riddler, et al. son un claro ejemplo de ello. 20 Los autores contaban con valores antes de la infección, antes y después del tratamiento en 50 pacientes. La diferencia final por tratamiento fue de 18 mg/dL en el colesterol, de 5 mg/dL en el colesterol LDL y un déficit de 10 mg/dL en el colesterol HDL. Si no se hubiese tenido la información pre-infección, se hubiera concluido erróneamente que el tratamiento incrementó 50 mg/d la concentración de colesterol.
3. Efectos de los antirretrovirales. Estudios en voluntarios sanos demuestran que los antirretrovirales son causa de dislipidemia: este efecto se observa pocos días después del inicio del tratamiento. En el cuadro 1 se resumen las alteraciones más frecuentes. Su prevalencia varía de acuerdo con la fuente consultada; son múltiples los factores que determinan su frecuencia. Entre ellos están el tiempo de administración, la presencia de lipodistrofia, los valores de corte usados y alteraciones preexistentes en el perfil de lípidos. Uno de los reportes más representativos es el estudio DAD (Data collection of adverse events of antiHIV drugs) que incluye más de 20,000 casos de Europa, Estados Unidos y Australia.21 En el cuadro 2 se muestra la prevalencia de las diversas dislipidemias de acuerdo con el tipo de tratamiento recibido. La prevalencia de hipercolesterolemia es tres veces mayor en los casos tratados, en especial cuando se incluye un IP. Sin embargo, las concentraciones de los casos que suspendieron el tratamiento eran similares al de los que no lo habían recibido; este dato sugiere que el efecto es reversible. Niveles bajos de colesterol HDL se presentan en casi 25% de los casos; la prevalencia es menor en los tratados con inhibidores no nucleósidos (19%). La prevalencia de hipertrigliceridemia es similar en tratados y no tratados, excepto si un IP es utilizado. Niveles muy altos de triglicéridos (>1,000 mg/dL) están asociados al uso de IP, especialmente con el ritonavir .2,22-33 Hipertrigliceridemias extremas pueden ser causa de pancreatitis aguda, dolor abdominal con enzimas pancreáticas normales, disnea, pérdida de memoria, lipemia retinalis y xantomas eruptivos. 17 El uso de IP aumenta los niveles de triglicéridos en promedio 113%. El colesterol es mayor en pacientes tratados con efavirenz.
Los efectos de los IP varían entre ellos. El ritonavir es el que tiene un efecto mayor; en el extremo opuesto está el indinavir. Un inhibidor de proteasas en desarrollo, el atazanavir, tiene un efecto neutro en el perfil de lípidos. Aún más, al combinarse con el ritonavir disminuye la incidencia de dislipidemia causada por el ritonavir. Este efecto benéfico no ha sido observado con otros antirretrovirales. 34-37
La asociación entre los ITRN y la dislipidemia es menos clara. En estudios con diseño cruzado se ha asociado la estavudina a valores mayores de colesterol y triglicéridos. 37,38 Sin embargo, en otros estudios longitudinales y controlados, en ausencia de lipodistrofia, los ITRN no son causa frecuente de hipertrigliceridemia. 30,34,38-40
En ausencia de lipodistrofia, ninguno de los ITRNN parecen implicados en el desarrollo de dislipidemia. Por ello, es frecuente que se sustituyan IPs por ITRNNs para el manejo de la dislipidemia. 28 En muchos casos, esta estrategia disminuye el nivel de triglicéridos; su efecto sobre el nivel de colesterol es variable 41-43 y en ocasiones se observa un colesterol HDL mayor. 43 También puede disminuir la lipodistrofia después de cambiar un IP por nevirapina. 44
Los factores identificados como predictores de dislipidemia varían notablemente entre los estudios. Los más comunes son carga viral baja, CD4 altos, sujetos con recuperación nutricional, preexistencia de dislipidemia, diabetes y la lipodistrofia. 30,34,44-48 Se ha encontrado hipertrigliceridemia en pacientes tratados con IP en ausencia de resistencia a insulina. La dislipidemia no es específica de pacientes con VIH, ya que también se observa en voluntarios sanos que reciben IPs. 49
La fisiopatología de la dislipidemia se muestra en la figura 1; los mecanismos son:
• Sobreproducción de partículas VLDL por el hígado. Los IP estimulan in vitro la producción hepática de lipoproteínas. Estudios de cinética de lipoproteínas en humanos demuestran que los IPs aumentan 76% la tasa de producción hepática de lipoproteínas. 50 Este defecto puede ser debido a una menor degradación de apolipoproteína B-100, proteína principal de las lipoproteínas ricas en triglicéridos (ej. VLDL). Los IPs inhiben la degradación proteasomal de la apolipoproteína B naciente. 51 Además los IPs activan diversos genes lipogénicos en el hígado regulados por la proteína de unión a los elementos regula-dores del esterol (SREBP). Por otro lado, la mejoría en el estado nutricional y la hiperinsulinemia contribuyen a la activación de esta vía metabólica. Es, el mecanismo más importante en estudio in vivo . Por el contrario, la producción hepática está disminuida en pacientes con síndrome de desgaste o antes del tratamiento con antirretrovirales.
• Retraso en la eliminación de lipoproteínas ricas en triglicéridos Los IP inhiben la actividad de la lipasa lipoproteica y de la lipasa hepática; ambas son responsables de la eliminación de las lipoproteínas ricas en triglicéridos. El mecanismo molecular de esta acción se desconoce. La resistencia a la insulina, el aumento de la concentración de ácidos grasos circulantes (propio de la lipodistrofia) son posibles mecanismos. Es probable que este defecto tenga un papel secundario en la fisiopatología de la dislipidemia. Algunos autores han propuesto que los IPs inhiben de manera inespecífica a la proteína relacionada con el receptor de LDL (LRP), encargada de la eliminación de las lipoproteínas ricas en triglicéridos parcialmente catabolizadas (llamadas remanentes). Sin embargo, la disrupción específica de LRP no es causa de dislipidemia; este defecto sólo se observa si coexiste con menor función del receptor de LDL. Por el contrario, estas anormalidades son la causa principal de la hipertrigliceridemia en la infección aguda y en el síndrome de desgaste, condición en que la producción hepática de lipoproteínas está disminuida.
• Factores genéticos. Existen diferencias en el perfil de lípidos por la presencia de distintos polimorfismos de las apolipoproteínas E y C-III. El alelo e2 se asocia a niveles más altos de triglicéridos. 52,53
• Metabolismo de las HDL . Los niveles bajos de colesterol HDL se explican por la menor actividad de la lipasa lipoproteica, enzima responsable de un porcentaje importante de la síntesis de las HDL. Además, si existen niveles altos de triglicéridos, la hipertrigliceridemia por sí misma es causa de colesterol HDL bajo (por aumento de depuración de la HDL enriquecidas en triglicéridos). Se requieren de estudios de cinética de HDLs en humanos tratados con diversos antirretrovirales.
Los datos presentados demuestran que existen huecos significativos en el estudio de la dislipidemia asociada al VIH. Muchos de los estudios son retrospectivos o no han controlado la presencia de variables confusoras. Se requieren estudios que analicen la interacción de factores genéticos con los eventos asociados a la infección por VIH. Se necesitan estudios en poblaciones que tienen prevalencia alta de algunas formas de dislipidemias (ej. colesterol HDL bajo/hipertrigliceridemia) o en individuos con síndrome metabólico.
RESISTENCIA A LA INSULINA
Estudios longitudinales revelan que la resistencia a la insulina precede, generalmente, a la lipodistrofia. 54 Existe resistencia a la insulina en voluntarios sanos bajo tratamiento con indinavir, cuatro semanas después del inicio del tratamiento, aun en ausencia de cambios en la composición corporal o en la distribución de grasa corporal; esto sugiere que se trata de un efecto directo del tratamiento con IP. 55,56 La consecuencia clínica de la resistencia a la insulina es el síndrome metabólico. En pacientes italianos con VIH, la prevalencia del síndrome metabólico es 45.4%; esta tasa es más del doble de la observada en población general y mayor que en individuos sanos > 60 años. 17 Los componentes del síndrome fueron: hiperglucemia o diabetes (24%), obesidad central (37.8%), hipertensión (42.3%), hipertrigliceridemia (59.3%) y niveles bajos de colesterol HDL (52.4%). 17 No existen estudios sobre la prevalencia del síndrome en otras poblaciones.
Los mecanismos por los que puede existir resistencia a la insulina en pacientes con VIH son:
1. Efecto del virus VIH y de la redistribución de la grasa corporal. Cualquier infección (aguda o crónica) es causa de resistencia a la insulina; la infección por VIH no es excepción.
2. Efecto de TARAA . Los IPs inhiben la actividad del transportador de glucosa GLUT-4. 54,57-60 No se conoce con certeza su patogénesis (Figura 2). Los IPs pueden unirse a las proteínas de unión del ácido retinoico en el citoplasma y a las proteínas relacionadas con receptores de lipoproteínas, disminuyen la activación de los receptores del ácido retinoico y de los receptores PPARγ. Aún en pacientes sin VIH, el indinavir disminuye la utilización de glucosa, sin modificar la composición corporal, lo que sugiere un efecto directo de los antirretrovirales. Los pacientes que toman TARAA tienen una reducción de aproximadamente 50% en la utilización total de la glucosa estimulada por insulina y de su consumo por vías oxidativa y no oxidativa. El consumo muscular de glucosa es 66%. 61-65 Los ITRN pueden afectar la función mitocondrial y el metabolismo de adipocitos al inhibir la DNA polimerasa γ, lo que puede conducir a depleción progresiva del DNA mitocondrial, alteración en la transcripción, la síntesis y pérdida de la función de fosforilación oxidativa.
3. Efectos de la redistribución de grasa. La resistencia a la insulina es más frecuente si existe lipodistrofia. Treinta y cinco por ciento de los pacientes con VIH con lipodistrofia tiene intolerancia a la glucosa comparado con 5% de los controles; los porcentajes correspondientes de diabetes son 7 y 0.5%, respectivamente. 57,58 Existe asociación positiva entre la circunferencia de cintura y la insulina de ayuno y negativa con la circunferencia del muslo; por lo tanto, el aumento en la grasa visceral como la disminución en la grasa subcutánea contribuyen a la resistencia a la insulina. 57 Ambos mecanismos aumentan los ácidos grasos libres circulantes, probable mecanismo de la resistencia a la insulina. Además estos casos tienen concentraciones bajas de adiponectina 60-64 , hormona producida por la célula adiposa que tiene acciones positivas sobre la acción de la insulina y protege contra el desarrollo de la aterosclerosis. También se han descrito cambios en la acción de la leptina, hormona que al sustituirse tiene efectos favorables en la distribución de la grasa corporal. 60,63,64 Otras hormonas producidas en la célula adiposa como la resistina, el factor de crecimiento parecido a la insulina (IGF), la visfatina (hormonas recientemente descritas), la interleucina-6 y el factor de necrosis tumoral alfa participan en este proceso, sin embargo, la evidencia no es concluyente en pacientes con VIH. 64
La resistencia a la insulina causa alteraciones que favorecen la progresión de la ateroesclerosis. La función endotelial cambia favoreciendo la adhesión de células a la superficie celular y su capacidad para inducir vasodilatación disminuye. 66,67 La hiperinsulinemia promueve el crecimiento y migración de las células vasculares de músculo liso. La resistencia a la insulina es causa de dislipidemia y niveles altos de PAI-1 y tPA. El tratamiento con metformin disminuye significativamente los niveles de estas dos proteínas y de insulina, lo que sugiere que los medicamentos que sensibilizan a la insulina pueden mejorar el perfil de riesgo cardiovascular en estos pacientes. 14,15
HIPERTENSIÓN ARTERIAL SISTÉMICA
La hipertensión arterial sistémica es una parte importante del síndrome metabólico. Pese a ello, la hipertensión arterial no es frecuente en pacientes que reciben TARAA. En el estudio DAD, la prevalencia de hipertensión fue de 8.5%. La historia familiar de hipertensión, la lipodistrofia y el síndrome metabólico son más frecuentes en sujetos con hipertensión. 68 Probablemente la edad de los sujetos afectados (adultos jóvenes) es una explicación para la prevalencia. De ser cierta, en el futuro se observará un aumento notable de su incidencia.
SÍNDROME DE LIPODISTROFIA
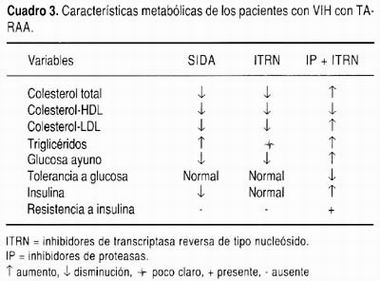
La lipodistrofia inicia con la pérdida del tejido adiposo subcutáneo en la cara, en la pared abdominal y en las extremidades. Más adelante, la grasa se deposita en sitios anormales como las vísceras intraabdominales, el cuello, sobre la columna dorsocervical (giba de búfalo) y en el tórax superior (Cuadro 3). Estos cambios se asocian a disminución de la acción de la insulina y dislipidemia. 68-71 La prevalencia de lipodistrofia es muy variable (8-84%) debido a las diferencias en los criterios diagnósticos, en la selección de la población estudiada y la duración del seguimiento. En promedio, la prevalencia es de 42% en pacientes tratados con IPs. La prevalencia es proporcional a la duración del tratamiento (17% en aquellos tratados con IP por menos de un año vs. 43% en aquellos con más de un año de tratamiento). Por cada seis meses de tratamiento con TARAA, el riesgo de lipodistrofia aumenta 45%. La incidencia es mayor con indinavir que con amprenavir, en pacientes que reciben inhibidores de proteasas, en mujeres, y con la adición de IP al tratamiento dual con ITR (riesgo 13 veces mayor). 60,69,70
Hasta hace poco tiempo no existían criterios objetivos de diagnóstico. Recientemente se desarrolló una escala objetiva que incorpora 10 variables clínicas, metabólicas y de composición corporal, y que puede diagnosticar lipodistrofia con una eficacia de 80%, además de ser útil tanto en mujeres como en hombres. 71,72 Cada variable tiene una puntuación. El total de los puntos se resta de una constante; si el resultado es igual o mayor a cero se considera como positivo el diagnóstico. Utilizando esta escala, la proporción de pacientes con VIH y lipodistrofia vírgenes a TARAA, con TARAA, pero sin IP y con IP fue de 5, 39 y 59%, respectivamente. 72 Esta escala permitirá una comparación adecuada entre diferentes estudios; tiene como limitante que el patrón de oro sobre la que fue construida fue la apreciación subjetiva del médico o del paciente 72 (Cuadro 4).
Los IPs es uno de los factores más importantes para el desarrollo de la lipodistrofia. 60,70 El tiempo promedio de inicio puede variar, siendo más corto con ritonavir y saquinavir, que con indinavir o nelfinavir. 2 También se ha observado con el uso de ITRN, 72 aunque se requiere tratamiento de larga duración para desarrollar este efecto. 70 La lipodistrofia asociada a ITRN puede estar relacionada con toxicidad mitocondrial. 4 Sin embargo, estos pacientes también presentan pérdida reciente de peso, fatiga, náusea, hepatomegalia, disfunción hepática y concentraciones elevadas de ácido láctico. Por lo anterior, es posible que la pérdida de grasa y la acumulación de la misma en pacientes tratados sólo con ITRN, represente un trastorno distinto al síndrome de lipodistrofia que se observa en los pacientes tratados con IPs. 70
La lipodistrofia está asociada positivamente con la duración de la infección por VIH. Existe controversia sobre la relevancia de la carga viral previa, la cuenta de linfocitos CD4 y el índice de masa corporal basal. 70-74 Pacientes con IMC mayor a 28 kg/m 2 antes del inicio del tratamiento tienen mayor prevalencia de giba dorsal, aumento de región mamaria y menor prevalencia de pérdida de grasa facial y glútea, en comparación con los que tienen un IMC menor a 20. 75
Otros factores asociados a la lipodistrofia son mayor edad, raza blanca, la duración y severidad de la enfermedad por VIH, tiempo desde la reversión de la progresión clínica de la infección por VIH y cambios extremos de peso. 60 La estavudina se asocia a pérdida de grasa subcutánea. Los hombres con lipodistrofia tienen mayor riesgo de desarrollar anormalidades metabólicas y depleción de grasa subcutánea. 76,77 Finalmente, las pacientes con lipodistrofia tienen niveles más altos de testosterona total y libre comparadas con las no lipodistróficas, sin embargo, mujeres afectadas por el VIH, pero sin lipodistrofia tienen niveles más bajos de andrógenos en comparación con las controles. 78 La patogénesis e implicaciones clínicas de estos hallazgos se desconocen.
No se conocen los mecanismos por los que los IP y los ITRN ocasionan lipodistrofia. El tejido adiposo de estos pacientes se caracteriza por apoptosis de adipocitos, formación local de lipogranulomas y proliferación vascular; el DNA mitocondrial del tejido adiposo subcutáneo está disminuido. 60,70 Se han propuesto las siguientes explicaciones:
a) Los IP inhiben la diferenciación de los preadipocitos: en estudios in vitro , los IP inhiben la acumulación de triglicéridos y la expresión de proteínas que intervienen la diferenciación de los preadipocitos (FABP: la proteína de unión a ácidos grasos y la glicerol-3-fosfato deshidrogenasa). Los IPs inhiben la proteína de unión al ácido cis-9 retinoico (a través del receptor X de retinoides), el cual tiene similitud con el sitio activo de la proteasa del VIH. Además, la región catalítica de esta proteasa tiene una homología de 60% con la secuencia del dominio de unión a lípidos del receptor de LDL y de la región C-terminal de la proteína de unión tipo I del ácido retinoico (CRABP-I). El receptor X de retinoides forma un complejo con el receptor activado de proliferador de peroxisomas γ (PPAR γ), el cual aumenta la transcripción de genes que rescatan a los adipocitos de la apoptosis y aumentan su diferenciación. Debido a que los receptores PPAR γ se expresan principalmente en el tejido adiposo periférico, es posible que la inhibición de la CRABP-I por los IP pueda resultar en apoptosis y alteración en la diferenciación de los adipocitos periféricos, con menor afección de los adipocitos intraabdominales y viscerales.
b) La lipodistrofia asociada a VIH/TARAA como resultado de las interacciones entre factores virales y los medicamentos antirretrovirales: antes del inicio del tratamiento, los linfocitos CD4 son predominantemente del tipo Th 2 y secretan citocinas inflamatorias como IL-4 e IL-10. Con el tratamiento, el perfil de los linfocitos CD4 cambia al subtipo Th1, los cuales secretan principalmente IL-2, interferón gamma, y factor de necrosis tumoral-alfa (FNT-α). Además, las proteínas del VIH como el Tat pueden activar el factor nuclear-kappa β con la subsecuente inducción del FNT-α. El aumento del FNT-α (y la consecuente producción de interleucina 6) puede mediar los cambios metabólicos observados en la lipodistrofia, ya que inhibe la captación de ácidos grasos libres por los adipocitos, estimula la lipólisis y estimula la producción hepática de lipoproteínas. Además, el FNT-α produce resistencia a la insulina. 60
c) La disminución del DNA mitocondrial del tejido adiposo subcutáneo puede ser secundaria a inhibición de la DNA polimerasa gamma inducida por los ITRN: en casos con lipodistrofia existe menor expresión de los genes de PPAR-γ y PGC-1 (coactivador 1 del receptor gamma activado del proliferador de peroxisomas). Este coactivador es indispensable para la biogénesis mitocondrial. En el grupo con lipodistrofia se encontró, además, disminución en la expresión de la acetil coenzima A sintetasa y lipoproteín lipasa, así como de la concentración del RNAm del GLUT-4, mientras que las concentraciones del RNAm de CD45 e IL-6 fueron significativamente más altas en este grupo. 79
d) Hipercortisolismo. El ritmo circadiano del cortisol es normal. Sin embargo, el cortisol puede sintetizarse localmente en el tejido adiposo visceral por la enzima 11β-hidroxiesteroide deshidrogenasa tipo 1 (conversión de cortisona a cortisol). Una concentración elevada de glucocorticoides a nivel local, aun sin hipercortisolismo sistémico, pueda inducir adiposidad regional; sin embargo, no se ha demostrado que este mecanismo sea la causa de esta anormalidad. 70
Se debe hacer diagnóstico diferencial con otras causas de lipodistrofia. Es común observar una pérdida generalizada de grasa en aquellos con síndrome por desgaste; generalmente se ven clínicamente enfermos por una carga viral alta, con una pérdida significativa de peso que involucra tanto masa corporal magra como grasa. Los pacientes con síndrome de desgaste no tienen alteraciones en la tolerancia a la glucosa o hiperinsulinemia, aunque pueden tener hipertrigliceridemia. Otras causas son alcoholismo, tratamiento con esteroides o testosterona.
HIPERLACTATEMIA
Existen múltiples reportes de acidosis láctica y esteatosis hepática en pacientes con VIH en tratamiento con ITRN. Sin embargo, los estudios prospectivos demuestran que la acidosis láctica o la esteatosis hepática severas son muy poco frecuentes. El cuadro clínico por la hiperlactatemia varía desde severo, compensado crónico o asintomático. La hiperlactatemia puede ocurrir también por otras causas como hipoxia, sepsis, deficiencia de tiamina, intoxicación por alcohol, trastornos mitocondriales o neoplasias.
En la hiperlactacidemia compensada asintomática se encuentran niveles de lactato menores 2.5 mmol/l de manera crónica o intermitente; en general, no se acompaña de alteraciones en las pruebas de función hepática. En este caso existe un mayor recambio de lactato, probablemente por toxicidad mitocondrial. Al realizar ejercicio, la tasa de eliminación del lactato es similar a la de los pacientes control. Se presenta en los primeros seis meses de tratamiento y es más frecuente con la estavudina, en especial en combinación con didanosina. 80
La incidencia de lactacidemia sintomática oscila entre 12 y 14.5 por 1,000 personas por año; la incidencia de acidosis láctica varía entre 1.3 y 8.3 casos por 1,000 personas por año. 80 La etapa inicial se manifiesta por náusea, vómito, anorexia, dolor abdominal o distensión, hepatomegalia dolorosa, fatiga y postración, inicialmente con pH normal. Este cuadro puede evolucionar rápidamente a acidosis metabólica con hiperventilación, arritmias y falla orgánica; también se puede presentar pancreatitis y elevación de creatinfosfoquinasa. La infección con hepatitis B y C es más frecuente en este grupo. Existe esteatosis hepática microvesicular. Concentraciones mayores de 5 mmol/l se observan generalmente en acidosis láctica y se asocian con una alta mortalidad. Las muestras deberán obtenerse en tubos con flúor y ser colocadas inmediatamente en hielo, así como evitar el uso de torniquete, ya que puede aumentar artificialmente su concentración. Lo más importante es el reconocimiento temprano de esta entidad, la suspensión del medicamento causante, así como apoyo ventilatorio y hemodinámico en una Unidad de Cuidados Intensivos. En casos de extrema gravedad se requiere el uso de hemodiálisis y se han utilizado los siguientes medicamentos, algunos de manera empírica: tiamina endovenosa, riboflavina, L-carnitina, coenzima Q y vitamina C. 80
Es conveniente que se tenga siempre en mente esta complicación y, en su caso, cambiar la clase del medicamento utilizado. Por otro lado, el hallazgo incidental de niveles moderadamente elevados de lactato puede ser un artefacto o reflejar únicamente una hiperlactatemia compensada en donde no se requiere ninguna intervención. 80
VIGILANCIA DE LOS CAMBIOS METABÓLICOS ASOCIADOS CON LA TARAA
No existe un consenso sobre el diagnóstico y tratamiento de los efectos adversos producidos por el tratamiento antirretroviral. En relación con la lipodistrofia, ésta puede diagnosticarse a la inspección visual por la combinación de obesidad abdominal con pérdida de la grasa subcutánea. Es necesario desarrollar guías sensibles y específicas para el diagnóstico y seguimiento en estos pacientes que, al mismo tiempo, sean costo-eficientes. Para la medición de la distribución de grasa corporal se han utilizado numerosos métodos, como son la tomografía computada, resonancia magnética, absorciometría rayos X dual (DEXA), y análisis de impedancia bioeléctrica. Esto puede utilizarse en conjunto con la medición del grosor de pliegues dérmicos, relación cintura/cadera, fotografías, o cuestionarios para evaluar cambios detectados por el mismo paciente. El uso de DEXA no es muy preciso, ya que es bidimensional y aunque cuantifica la grasa total, no distingue entre grasa visceral y subcutánea en el tronco. Por otro lado, la resonancia magnética (RM) y la tomografía axial computada (TAC) producen imágenes tridimensionales; sin embargo, su desventaja es el costo; una alternativa menos costosa es utilizar cortes únicos de TAC (entre L4 y muslo). Es evidente que se requiere la estandarización y métodos más sensibles para evaluar este tipo de cambios y poder definir y diagnosticar las complicaciones metabólicas asociadas con la TARAA. De momento, se recomienda la medición en cada visita de la estatura y peso. También son útiles fotografías, talla del sostén en mujeres, la evaluación subjetiva por el paciente, la circunferencia de cintura, el examen físico de piernas, brazos y cara en busca de signos de lipoatrofia, y del perímetro del cuello, abdomen y región mamaria femenina en busca de hipertrofia. 81
Para la evaluación de la dislipidemia, se han adoptado las recomendaciones usadas en población sin VIH, debido a que no existen datos suficientes para estimar el riesgo cardiovascular de estos casos.82,83 Se sugiere medir un perfil de lípidos en ayuno antes de iniciar la TARAA y repetirlo en un lapso de tres a seis meses. Ya que no se han establecido metas específicas de niveles de colesterol LDL en pacientes con infección por VIH, la AACTG (Adult AIDS Clinical Trial Group Cardiovascular Disease Focus Group) recomienda aplicar las guías de la NCEP (National Cholesterol Education Program), que sugieren establecer la meta de niveles de colesterol LDL de acuerdo al riesgo cardiovascular. En el tercer reporte de la NCEP se identificó al síndrome metabólico como meta secundaria, debido a la evidencia en su participación en el riesgo de enfermedad coronaria. El uso de las tablas de Framingham, propuesto por el NCEP no ha sido validado en poblaciones latinoamericanas (y menos aún en pacientes con VIH). Por ello, es opinión de los autores que su empleo para estimar el riesgo cardiovascular en pacientes mexicanos con infección por VIH no puede ser recomendado. Se sugiere identificar cuantas causas secundarias existan (consumo de alcohol, diabetes, fármacos, etc.) y en casos con valores de colesterol y/o triglicéridos mayores de 300 mg/dL o con historia familiar de dislipidemia, diabetes o cardiopatía isquémica hacer la búsqueda intencionada de hiperlipidemias primarias. 82
La evaluación de pacientes con resistencia a la insulina también es motivo de controversia. No se ha definido el método idóneo ni la frecuencia de tamizaje para diabetes mellitus en pacientes con VIH. Aún es controversial si todos los pacientes con VIH deben ser evaluados de manera rutinaria con este fin. 84
TRATAMIENTO
El tratamiento de las alteraciones metabólicas incluye terapia nutricional, ejercicio y la eliminación de otros factores de riesgo como tabaquismo y alcoholismo. El objetivo es mantener niveles normales de lípidos séricos, glucosa, peso y presión arterial a largo plazo. La dieta y el ejercicio pueden ayudar a las metas deseadas, sin embargo, no suele revertir la pérdida de grasa subcutánea. Pocos estudios han evaluado el efecto de la dieta; sus resultados son poco alentadores. 85,86 Se deberá tener cuidado en evitar restricción calórica inadecuada en pacientes que ya han perdido peso a consecuencia de lipoatrofia severa.
Una práctica común es cambiar el tipo de fármaco sin sacrificar eficacia antirretroviral con el fin de reducir las complicaciones metabólicas asociadas a la TARAA. Los resultados han sido variables. La sustitución de un IP por nevirapina disminuye la pérdida de grasa en cara y brazos y disminuye los niveles de lípidos en 57%. 87,88 El cambio de un IP por abacavir aumenta la sensibilidad a la insulina y disminuye los niveles de colesterol y triglicéridos en la mayoría de los pacientes. 89 En resumen, la mayoría de los estudios muestran una disminución de los niveles de triglicéridos al cambiar un IP por un ITRNN (nevirapina o efavirenz), un ITRN (abacavir) u otro IP (nelfinavir). 90 En contraste, la hipercolesterolemia y la redistribución de grasa tienden a persistir a pesar de descontinuar el tratamiento con IP. 17 El atazanavir parece tener un efecto más favorable en el perfil de lípidos. 37
Dislipidemia
Si no se logra la normalización del perfil de lípidos con dieta y ejercicio, se pueden utilizar tratamiento con fármacos (Cuadro 5). La mayoría de los IP son metabolizados por el citocromo p4503A4, lo que aumenta la concentración sanguínea de los fármacos hipolipemiantes y el riesgo de miopatía. Todos los IP inhiben esta enzima, siendo ritonavir el más potente. En un estudio de farmacocinética que combinó diferentes estatinas con ritonavir, los niveles de simvastatina aumentaron 32 veces, los de atorvastatina 4.5 y los de pravastatina disminuyeron 0.5 veces. 17 El riesgo es bajo con el uso de estatinas como único medicamento (< 0.5%), 91 pero aumenta al combinarlas con fibratos (5%). 92 En la experiencia publicada no hubo casos de miopatía en 49 pacientes que tomaron un IP y pravastatina o atorvastatina y en 19 pacientes con IP más atorvastatina y gemfibrozil. 17 El gem-fibrozil también es un inhibidor potente de este citocromo. Por ello no se recomienda el uso de este fibrato en pacientes que reciben antirretrovirales. 93,94 Varios estudios han evaluado la eficacia de los fibratos y las estatinas en pacientes con VIH. Su eficacia es similar a la observada en población general.
La hipertrigliceridemia severa tiene como complicación a la pancreatitis aguda. Casos con episodios previos de pancreatitis o con hepatomegalia dolorosa se consideran en alto riesgo. Se recomienda el ayuno bajo vigilancia intrahospitalaria para estos casos; lo mismo es aplicable para pacientes con diabetes. El uso de una dieta baja en grasa (< 10%) y azúcares simples con alto contenido de fibra es la alternativa a usar en pacientes externos. El ritonavir es el IP asociado con más frecuencia a este efecto adverso; debe ser sustituido por otro antirretroviral. Al tratamiento se agrega un fibrato una vez que los triglicéridos estén por debajo de 500 mg/dL. En pacientes sin riesgo de pancreatitis, la terapia hipolipemiante debe dirigirse hacia la meta de reducir el riesgo cardiovascular. Las estatinas son los medicamentos más eficaces para disminuir las concentraciones de colesterol LDL, y disminuyen parcialmente los triglicéridos. Los fibratos son útiles en pacientes con hipertrigliceridemia. En casos con elevaciones de colesterol y triglicéridos, el uso combinado de fibratos y estatinas es necesario en un alto porcentaje. Sin embargo, esta combinación aumenta el riesgo de miopatía. Los casos con colesterol HDL bajo e hipertrigliceridemia deberán ser tratados con un fibrato; la sola corrección de la cifra de triglicéridos normalizará el nivel de colesterol HDL cuatro a ocho semanas después. Los pacientes con colesterol HDL bajo sin hipertrigliceridemia se tratan con ejercicio aeróbico, suspensión de tabaco y corrección de todas las causas secundarias posibles. El uso de fármacos en esta condición se limita a sujetos de alto riesgo. Dado que la prevención de eventos vasculares puede observarse sólo a largo plazo, los especialistas deberán reservar esta intervención para pacientes con riesgo cardiovascular y un pronóstico favorable de la enfermedad de base. 17
Diabetes mellitus y resistencia a la insulina
El metformin disminuye los niveles de PAI-1 y tPA, así como la insulinemia en estos pacientes. 95 Las dosis de metformin que se han utilizado en este tipo de pacientes son: 850 mg tres veces al día durante ocho semanas, con una disminución significativa de la resistencia a la insulina y adiposidad troncal; también disminuye el peso corporal y la circunferencia de cintura 14,15 (Cuadro 5). Los agonistas PPAR gamma, como pioglitazona o rosiglitazona, pueden disminuir los niveles de glucosa y las complicaciones metabólicas, además de que parecen revertir los defectos mitocondriales asociados con la TARAA y aumentar la adipogénesis subcutánea. En un estudio reciente con rosiglitazona (8 mg/d durante seis a 12 semanas) hubo mejoría en la resistencia a la insulina y en la distribución de grasa corporal en algunos pacientes; 96 lo mismo había sido descrito con la troglitazona. 97 El uso del metformin y las tiazolidinedionas aún se considera en estudio y no se recomienda para todos los casos con lipodistrofia. El tratamiento de la hiperglucemia y la diabetes tipo 2 es el mismo que en la población general; en pacientes con lipodistrofia la respuesta es menor.
Lipodistrofia
No existe ningún tratamiento eficaz. En 1996 se aprobó el uso de hormona de crecimiento recombinante (GHrh) para el tratamiento del desgaste asociado a VIH. Además, la hormona de crecimiento se ha usado en forma experimental en casos con lipodistrofia. No existe deficiencia de hormona de crecimiento en pacientes con VIH y lipodistrofia, sin embargo, se han encontrado concentraciones menores de GH durante la noche y disminución en la respuesta de GH a GHrh, a pesar de que los pulsos de GH y las concentraciones de IGF-1 permanezcan en límites normales. 98 La grasa visceral disminuye después del uso de GHrh en hombres sin VIH con obesidad abdominal. 99 En pacientes con VIH, utilizando dosis farmacológicas de GHrh se observó mejoría en la distribución de grasa; sin embargo, hubo deterioro en la tolerancia a la glucosa. Otros grupos emplearon dosis menores (3 mg/día); pese a ello, se observó disminución en la disposición de glucosa mediada por insulina al mes de tratamiento. Este defecto es reversible a los seis meses de tratamiento. 100 Las dosis bajas mejoran los niveles de lípidos después de seis meses de empleo. El uso de 4 mg/d por 12 semanas disminuye la grasa central. 35 La dosis de 6 mg/día disminuye la grasa visceral en mayor porcentaje que los esquemas con dosis bajas, sin embargo, se asocian con mayor riesgo de tener hiperglucemia. Por lo anterior, el uso de GHrh no puede recomendarse para el tratamiento de la lipodistrofia asociada a VIH/TARAA. Finalmente, en estudios recientes se observó eliminación de la resistencia a la insulina después de la coadministración de leptina y adiponectina en un modelo murino de diabetes lipoatrófica. Por lo anterior, se requieren estudios que exploren el uso de adiponectina sola o con leptina, o bien análogos de los mismos como otra opción de tratamiento. 59,63
CONCLUSIONES
Ante los retos que representa el número creciente de casos de infección por VIH y los altos costos de tratamiento se requiere de políticas de investigación en salud que aporten datos útiles para diseñar estrategias preventivas de las futuras causas de muerte de los pacientes afectados. Las alteraciones metabólicas asociadas a TARAA serán una de las principales causas de morbimortalidad en los próximos años. Pese a ello, existen grandes vacíos en su estudio. Muchos de los reportes tienen problemas metodológicos o son cohortes pequeñas no representativas. En población latinoamericana existe aún menos información. En países, como México, con prevalencia alta de síndrome metabólico, dislipidemias, hipertensión arterial y diabetes tipo 2, es esperable que las alteraciones metabólicas sean más frecuentes, ya que un factor ambiental (como TARAA) puede hacer evidente la predisposición genética para sufrir las anormalidades metabólicas antes descritas. Para poder evaluar con certeza el impacto de las alteraciones metabólicas en nuestra población, se requiere de registros regionales o nacionales de pacientes con VIH. Entre otras cosas, este instrumento aseguraría el poder tener datos epidemiológicos confiables. La interacción entre endocrinólogos, infectólogos y otros especialistas será cada vez más frecuente e indispensable en este campo.
REFERENCIAS
1. Palella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection: HIV Outpatient study investigators. N Engl J Med 1998; 338: 853-60. [ Links ]
2. Carr A, Samaras K, Thorisdottir A, Kaufmann GR, Chisholm DJ, Cooper DA. Diagnosis, prediction, and natural course of HIV-1 protease-inhibitor-associated lipodystrophy, hyperlipidaemia, and diabetes mellitus: a cohort study. Lancet 1999; 353: 2093-9. [ Links ]
3. Jain RG, Furfine ES, Pedneault L, White AJ, Lenhard JM. Metabolic complications associated with antiretroviral therapy. Antiviral Research 2001; 51(3): 151-77. [ Links ]
4. Klein D. Do protease inhibitors increase the risk for coronary disease among HIV positive patients-follow up. 2001, 8 th Conference on Retroviruses and Opportunistic Infections, Chicago, IL, USA. [ Links ]
5. Barbaro G. Cardiovascular manifestations of HIV infection . Circulation 2002; 106(11): 1420-7. [ Links ]
6. Rickerts V, Brodt H, Staszewski S, Stille W. Incidence of myocardial infarctions in HIV-infected patients between 1983 and 1998: the Frankfurt HIV-cohort study. Eur J Med Res 2000; 5: 329-33. [ Links ]
7. Mary-Krause M. Impact of treatment with protease inhibitor (PI) on myocardial infarction (MI) occurrence in HIV-infected men. 2001, 8 th Conference on Retroviruses and Opportunistic Infections, Chicago, IL, USA. [ Links ]
8. Gazzaruso C, Sacchi P, Garzaniti A, Fratino P, Bruno R, Filice G. Prevalence of metabolic syndrome among HIV patients. Diabetes Care 2002; 25(7): 1253-4. [ Links ]
9. Bozzette SA, Ake CF, Tam HK, Chang SW, Louis TA. Cardiovascular and cerebrovascular events in patients treated for human immunodeficiency virus infection. N Engl J Med 2003; 348(8): 702-10. [ Links ]
10. Holmberg SD, Moorman AC, Williamson JM, Tong TC, Ward DJ , Wood KC, Greenberg AE, Janssen RS and the HIV Outpatient Study (HOPS) Investigators. Protease inhibitors and cardiovascular outcomes in patients with HIV-1. Lancet 2002; 360: 1747-8. [ Links ]
11. Behrens G, Schmidt H, Meyer D, Stoll M, Schmidt RE. Vascular complications associated with use of HIV protease inhibitors. Lancet 1998; 351: 1958-60. [ Links ]
12. Head G, Mehta NJ, Khan IA, Mehta RN, Gowda RM. Acute coronary syndrome in patients with human immunodeficiency virus disease. Angiology 2002; 53: 545-9. [ Links ]
13. Kuritzkes DR, Currier J. Cardiovascular risk factors and antiretroviral therapy. N Engl J M 2003; 348(8): 679-80. [ Links ]
14. Hadigan C, Meigs JB, Rabe J, D,Agostino RB, Wilson PWF, Lipinska I, Tofler GH. Grinsspoon S. Increased PAI-1 and tPA antigen levels are reduced with metformin therapy in HIV-infected patients with fat redistribution and insulin resistance . J Clin Endocrinol Metab 2001; 86(2): 939-43. [ Links ]
15. Hadigan C, Rabe J, Grinspoon S. Sustained benefits of metformin therapy on markers of cardiovascular risk in human immunodeficiency virus-infected patients with fat redistribution and insulin resistance. J Clin Endocrinol Metab 2002; 87(10): 4611-15. [ Links ]
16. Dressman J, Kincer J, Matveev S, et al. HIV protease inhibitors promote atherosclerotic lesion formation independent of dyslipidemia by increasing CD36-dependent cholesteryl ester accumulation in macrophages. J Clin Invest 2003; 111: 389-97. [ Links ]
17. Green ML. Evaluation and management of dyslipidemia in patients with HIV infection. JGIM 2002; 17: 797-810. [ Links ]
18. Zangerle R, Sarcletti M, Gallati H, Reibnegger G, Wachter H, Fuchs D. Decreased plasma concentrations of HDL cholesterol in HIV-infected individuals are associated with immune activation. J Acquir Immune Defic Syndr 1994; 7: 1149-56. [ Links ]
19. Mooser V, Carr A. Antiretroviral therapy-associated hyperlipidaemia in HIV Disease. Curr Opin Lipidol 2001; 12: 313-19. [ Links ]
20. Riddler S, Smit E, Cole S at al. Impact of HIV infection and HAART on serum lipids in men. JAMA 2003; 289: 2978-82. [ Links ]
21. Friis-Moller N, Weber R, Reiss P, et al. Cardiovascular disease risk factors in HIV patients- association with antiretroviral therapy. Results from the DAD study. AIDS 2003; 17: 1179-93. [ Links ]
22. Echevarria KL, Hardin TC, Smith JA. Hyperlipidemia associated with protease inhibitor therapy. Ann Pharmacother 1999; 33: 859-63. [ Links ]
23. Sullivan AK, Nelson MR. Marked hyperlipidaemia on ritonavir therapy. AIDS 1997; 11: 938-9. [ Links ]
24. Pujol RM, Domingo P, Xavier Matias G, Francia E, Sanbeat MA, Alomar A. HIV-1 protease inhibitor-associated partial lipodystrophy: clinicopathologic review of 14 cases. J Am Acad Dermatol 2000; 42: 193-8. [ Links ]
25. Panse I, Vasseur E, Raffin-Sanson ML, Staroz R, Rouveix E, Saiag P. Lipodystrophy associated with protease inhibitors. Br J Dermatol 2000; 142: 496-500. [ Links ]
26. Behrens G, Dejam A, Schimidt H, Balks HJ, Brabant G, Korner T, Stoll M, Schimidt RE, et al. Impaired glucose tolerance, beta cell function and lipid metabolism in HIV patients under treatment with protease inhibitors. AIDS 1999; 13: F63-70. [ Links ]
27. Koppel K, Bratt G, Eriksson M, Sandstrom E. Serum lipid levels associated with increased risk of cardiovascular disease is associated with increased risk for cardiovascular disease is associated with highly active antiretroviral therapy (HAART) in HIV-1 infection . Int J STD AIDS 2000; 11: 451-5. [ Links ]
28. Garcia-Benayas T, Blanco F, de la Cruz JJ, Senchordi MJ, Gomez-Viera JM, Soriano V, Gonzalez-Lahoz J. Role of nonnucleosides in the development of HAART-related lipid disturbances. J Acquir Immune Defic Syndr 2001; 28: 496-8. [ Links ]
29. Manfredi R, Chiodo F. Disorders of lipid metabolism in patients with HIV disease treated with antiretroviral agents: frequency, relationship with administered drugs and role of hypolipidaemic therapy with bezafibrate. J Infect 2001; 42: 181-8. [ Links ]
30. Tsiodras S, Mantzoros C, Hammer S, Samore M. Effects of protease inhibitors on hyperglycemia, hyperlipidemia and lipodystrophy: a 5-year cohort study. Arch Intern Med 2000; 160: 3050-6. [ Links ]
31. Periard D, Talenti A, Sudre P, Cheseaux JJ, Halfon P, Reymond MJ. Atherogenic dyslipidemia in HIV-infected individuals treated with protease inhibitors. Circulation 1999; 100: 700-5. [ Links ]
32. Roge BT, Katzenstein TL, Gerstof J. Comparison of P-trygliceride levels among patients with human immunodeficiency virus on randomized treatment with ritonavir, indinavir or ritonavir/saquinavir. Scand J Infect Dis 2001; 33: 306-11. [ Links ]
33. Carr A, Hudson J, Chuah J, Mallal S, Law M, Hoy J, Doong N, French M, Smith D, Cooper DA, PIILR Study Group. HIV protease inhibitor substitution in patients with lipodystrophy: a randomized, controlled, open-label, multicentre study. AIDS 2001; 15: 1811-22. [ Links ]
34. Thiebaut R, Dabis F, Malvy D, Jacqmin-Gadda H, Mercie P, Valentin VD. Serum triglycerides, HIV infection, and highly active antiretroviral therapy. Aquitaine Cohort, France 1996 to 1998. Groupe Epidemiologie Clinique du Sida en Aquitaine (GECSA). J Acquir Immune Defic Syndr 2000; 23: 261-5. [ Links ]
35. Vergis EN, Paterson DL, Wagener MM, Swindells S, Singh N. Dyslipidaemia in HIV-infected patients: association with adherence to potent antiretroviral therapy. Int J STD AIDS 2001; 12: 463-8. [ Links ]
36. Currier J. Management of metabolic complications of therapy. AIDS 2002; 16 (Suppl 4): S171-S176. [ Links ]
37. Badaro R, DeJesus E, Lazzarin A, Jemsek J, Clotet B, Rightmire A, Thiry A, Wilber R. Atazanavir with ritonavir or saquinavir vs. lopinavir/ritonavir in patients with multiple virologic failures. Memories of 5 th International Workshop on Adverse Drug Reactions and Lipodystrophy in HIV,July 8-11, Paris, France. [ Links ]
38. Saint-Marc T, Partisani M, Poizot-Martin I, Rouviere O, Bruno F, Avellaneda R. Fat distribution evaluated by computed tomography and metabolic abnormalities in patients undergoing antiretroviral therapy:preliminary results of LIPOCO study. AIDS 2000; 14: 37-49. [ Links ]
39. Galli M, Ridolfo AL, Adorni F, Gervasoni C, Ravasio L, Corsico L, Gianelli E, Piazza M, Vaccarezza M, d'Arminio Monforte A, Moroni M. Body habitus changes and metabolic alterations in protease inhibitor-naive HIV-1 infected patients treated with two nucleoside reverse transcriptase inhibitors. J Acquir Immune Defic Syndr 2002; 29: 21-31. [ Links ]
40. Rakotoambinina B, Medioni J, Rabian C, Jubault V, Jais JP, Viard JP. Lipodystrophic syndromes and hyperlipidemia in a cohort of HIV-1 infected patients receiving triple combination antiretroviral therapy with a protease inhibitor. J Acquir Immune Defic Syndr 2001; 27: 443-9. [ Links ]
41. Martinez E, García-Viejo M, Blanco JL, Bianchi L, Buira E, Conget I. Impact of switching from human immunodeficiency virus type 1 protease inhibitors to efavirenz in succesfully treated adults with lipodystrophy. Clin Infect Dis 2000; 31: 1266-73. [ Links ]
42. Casado JL, Arrizabalaga J, Antela A. Long-term efficacy and tolerance of switching the protease inhibitor for non-nucleoside reverse transcriptase inhibitors: a 52 week, multicenter, prospective study. Eight Conference on Retroviruses and Opportunistic Infections. Chicago, February 1999 (abstract 673). [ Links ]
43. Van der Valk M, Kastelein J, Murphy R, Van Leth F, Katlama C, Horban A. Nevirapine-containing antiretroviral therapy in HIV-1 infected patient results in an anti-atherogenic lipid profile. AIDS 2001; 15: 2407-14. [ Links ]
44. Barreiro P, Soriano V, Blanco F, Casimiro C, de la Cruz JJ, Gonzalez-Lahoz J. Risks and benefits of replacing protease inhibitors by nevirapine in HIV-infected subjects Ander long-term succesful triple combination therapy. AIDS 2000; 14: 807-12. [ Links ]
45. Kosmiski LA, Kuritzkes DR, Lichteinstein KA, Glueck DH, Gourley PJ, Stamm ER. Fat distribution and metabolic changes are strongly correlated and energy expenditure is increased in the HIV lipodystrophy syndrome. AIDS 2001; 15: 1993-2000. [ Links ]
46. Hadigan C, Meigs JB, Corcoran C, Rietschel P, Piecuch S, Basgoz N. Metabolic abnormalities and cardiovascular risk factors in adults with human immunodeficiency virus infection and lipodystrophy. Clin Infect Dis 2001; 32: 130-9. [ Links ]
47. Gervasoni C, Ridolfo AL, Trifiro G, Santambrogio S, Norbiato G, Musicco M, Clerici M, Galli M, Moroni M. Redistribution of body fat in HIV-infected women undergoing combined antiretroviral therapy. AIDS 1999; 13: 465-71. [ Links ]
48. Dong KL, Bausserman LL, Flynn MM, Dickinson BP, Flanigan TP, Mileno MD, Tashima KT, Carpenter CC. Changes in body habitus and serum lipid abnormalities in HIV-positive women on highly active antiretroviral therapy (HAART). J Acquir Immune Defic Syndr 1999; 21: 107-13. [ Links ]
49. Purnell JQ, Zambon A, Knopp RH, Pizzuti DJ, Achari R, Leonard JM. Effect of ritonavir on lipids and postheparine lipase activities in normal subjects. AIDS 2000; 14: 51-7. [ Links ]
50. Petit JM, Doung M, Florentin E, Duvillard L, Chavanet P, Brun JM, Portier H, Gambert P, Verges B. Increased VLDL-apolipoprotein B and IDL-apolipoprotein B production rates in non lipodystrophic HIV-infected patients on a protease inhibitor containing regimen. A stable isotope kinetic study. J Lipid Res 2003 (in press). [ Links ]
51. Liang JS, Distler O, Cooper DA, Jamil H, Deckelbaum RJ, Ginsberg HN. HIV protease inhibitors protect apolipoprotein B from degradation by the proteasome: a potential mechanism for protease inhibitor-induced hyperlipidemia. Nat Med 2001; 7: 1327-31. [ Links ]
52. Grunfeld C, Doerrier W, Pang M, Jensen P, Weisgraber KH, Feingold KR. Abnormalities of apolipoprotein E in the acquired immunodeficiency syndrome . J Clin Endocrinol Metab 1997; 82: 3734-40. [ Links ]
53. Fauvel J, Bonnet E, Ruidavets JB, Ferrieres J, Toffoletti A, Massip P, Chap H, Perret B. An interaction between apoc C-III variants and protease inhibitors contributes to high triglyceride/low HDL levels in treated HIV patients. AIDS 2001; 15: 2397-406. [ Links ]
54. Hruz PW, Murata H, Mueckler M. Adverse metabolic consequences of HIV protease inhibitor therapy: the search for a central mechanism. Am J Physiol Endocrinol Metab 2001; 280: E549-E553. [ Links ]
55. Noor M, Lo JC, Mulligan K, Halvorsen R, Schwarz J, Shambelan M, Grunfeld C. Metabolic effects of indinavir in healthy HIV-seronegative subjects. Antiviral Therapy 2000; 5-8. [ Links ]
56. Noor MA, Senerivatne T, Aweeka FT. The HIV protease inhibitor indinavir acutely inhibits insulin-stimulated glucose disposal: a randomized, placebo-controlled study. Antiviral Therapy 2001; 6: 4. [ Links ]
57. Grinspoon S. Insulin resistance in the HIV-lipodystrophy syndrome. Trends Endocrinol Metab 2001; 12(9): 413-9. [ Links ]
58. Dube MP. Disorders of glucose metabolism in patients infected with human immunodeficiency virus. Clin Infect Dis 2000; 31: 1467-75. [ Links ]
59. Murata H, Hruz PW, Mueckler M. The mechanism of insulin resistance caused by HIV protease inhibitor therapy. J Biol Chem 2000; 275: 20251-4. [ Links ]
60. Leow MKS, Addy CL, Mantzoros CS. Human immunodeficiency virus/highly active antiretroviral therapy-associated metabolic syndrome: clinical presentation, pathophysiology, and therapeutic strategies. J Clin Endocrinol Metab 2003; 88(5): 1961-76. [ Links ]
61. Addy CI, Gavrila A, Tsiodras S, Brodovicz K, Karchmer AW, Mantzoros CS. Hypoadiponectinemia is associated with insulin resistance, hypertriglyceridemia, and fat redistribution in human immunodeficiency virus-infected patients treated with highly active antiretroviral therapy. J Clin Endocr Metab 2003; 88(2): 627-36. [ Links ]
62. Sutinen J, Korsheninnikova E, Funahashi T, Matsuzawa Y, Nyman T, Yki-Jarvinen H. Circulating concentration of adiponectin and its expression in subcutaneous adipose tissue in patients with highly active antiretroviral therapy-associated lipodystrophy. J Clin Endocrinol Metab 2003; 88(4): 1907-10. [ Links ]
63. Tong Q, Sankalé JL, Hadigan CM, Tan G, Rosenberg ES, Kanki PJ, Grinspoon SK and Hotamisligil S. Regulation of adiponectin in human immunodeficiency virus-infected patients: relationship to body composition and metabolic indices. J Clin Endocr Metab 2003; 88(4): 1559-64. [ Links ]
64. Van Gaal LF, Mertens IL, Abrams PJ. Health risks of lipodystrophy and abdominal fat acumulation: therapeutic possibilities with leptin and human growth hormone. Growth Horm IGF Res 2003; 13 Suppl: S4-9. [ Links ]
65. Behrens G, Boerner AR, Weber K, Van den Hoff J, Ockenga J, Brabant G, Schmidt RE. Impaired glucose phosphorylation and transport in skeletal muscle cause insulin resistance cin HIV-1 infected patients with lipodystrophy. J Clin Invest 2002; 110(9): 1319-27. [ Links ]
66. Meigs JB, Mittleman MA, Nathan DM, Tofler GH, Singer DE, Murphy-Sheehy PM. Hyperinsulinemia, hyperglycemia and impaired hemostasis: The Framingham Offspring Study. JAMA 2000; 283: 221-8. [ Links ]
67. Stein JH, Klein MA, Bellehumeur JL, McBride PE, Wiebe DA, Otvos JD, Sosman JM. Use of human immunodeficiency virus-1 protease inhibitors is associated with atherogenic lipoprotein changes and endothelial dysfunction. Circulation 2001; 104: 257. [ Links ]
68. Gazzaruso C, Bruno R, Garzaniti A, Giordanetti S, Fratino P, Sacchi P, Filice G. Hypertension among HIV patients: prevalence and relationships to insulin resistance and metabolic syndrome. J Hypert 2003; 21(7): 1377-82. [ Links ]
69. Behrens G, Meyer-Olson D, Stoll M, Schmidt RE. Clinical impact of HIV-related lipodystrophy and metabolic abnormalities on cardiovascular disease. AIDS 2003; 17 (Suppl. 1): S149-54. [ Links ]
70. Chen D, Misra A, Abhimanyu G. Lipodystrophy in human immunodeficiency virus-infected patients . J Clin Endocrinol Metab 2002; 87(11): 4845-56. [ Links ]
71. HIV lipodystrophy case definition study group. An objective case definition of lipodystrophy in HIV-infected adults: a case-control study . Lancet 2003; 361(9359): 726-35. [ Links ]
72. Carr A, Law M. An objective lipodystrophy severity grading scale derived from the lipodystrophy case definition score. JAIDS 2003; 33: 571-6. [ Links ]
73. Saint-Marc T, Partisani M, Poizot-Martin I, Bruno F, Rouviere O, Lang JM. A syndrome of peripheral fat wasting (lipodystrophy) in patients receiving long-term nucleoside analogue therapy. AIDS 1999; 13: 1659-67. [ Links ]
74. Chow DC, Day LJ, Shikuma CM. Metabolic complications of HIV therapy. HIV inSite Knowledge Base Chapter 2003. [ Links ]
75. Muurahainen N, Pettit R, Kotler D, Falutz J, Santos G, Kleintop M, Glesby M. Abnormalities in HIV-associated lipodystrophy syndrome that vary by weight status (abstract 63). 1 st International workshop on adverse drug reactions and lipodystrophy in HIV, San Diego, CA: 1999, p. 53. [ Links ]
76. Miller JE, Emery S, French M, Baker D, Cooper DA. The Australian prevalence survey of lipodystrophy. The Seventh Conference on Retroviruses and Opportunistic Infections, San Francisco, CA, 2000 (abstract 201). [ Links ]
77. Galli M, Cozzi-Lepri A, Ridolfo AL, Gervasoni C, Ravasio L, Corsico L. Incidence of adipose tissue alterations in first-line antiretroviral therapy: the LipolCoNa Study. Arch Intern Med 2002; 162: 2621-8. [ Links ]
78. Hadigan C, Corcoran C, Piecuch S, Rodriguez W, Grinspoon S. Hyperandrogenemia in human immunodeficiency virus-infected women with the lipodystrophy syndrome. J Clin Endocrinol Metab 2000; 85(10): 3544-50. [ Links ]
79. Kannisto K, Sutinen J, Korsheninnikova E, Fisher RM, Ehrenborg E, Gertow K. Expression of adipogenic transcription factors, peroxisome proliferator-activated receptor gamma co-activator 1, IL-6 and CF45 in subcutaneous adipose tissue in lipodystrophy associated with highly active antiretroviral therapy. AIDS 2003; 17: 1753-62. [ Links ]
80. John M, Mallal S. Hyperlactatemia syndromes in people with HIV infection. Curr Op Infect Dis 2002; 15: 23-9. [ Links ]
81. Schwenk A. Methods of assessing body shape and composition in HIV-associated lipodystrophy. Curr Op Infect Dis 2002; 15: 9-16. [ Links ]
82. Dube D, Sprecher K, Henry JA, Aberg FJ, Torriani HN, Hodis J, Schouten J, Levin G, Myers R, Zackin T, Nevin JS, Currier. Preliminary guidelines for the evaluation and management of dyslipidemia in HIV-infected adults receiving antiretroviral therapy. Recommendations of the adult ACTG cardiovascular disease focus group. Clin Infect Dis 2000; 31: 1467-75. [ Links ]
83. Fantoni M, Del Borgo C, Autore C. Evaluation and management of metabolic and coagulative disorders in HIV-infected patients receiving highly active antiretroviral therapy. AIDS 2003; 17(Suppl 1): S162-9. [ Links ]
84. Yoon C, Gulick R, Hoover D, Vaamonde C, Glesby M. Case-control study of diabetes mellitus in HIV-infected patients. Ninth conference on retroviruses and oportunistic infections. Seattle, 2002. [ Links ]
85. Henry K, Melroe H, Huebesch J, Hermundson J, Simpson J. Atorvastatin and gemfibrozil for protease inhibitor-related lipid abnormalities. (letter). Lancet 1998; 352: 1031-2. [ Links ]
86. Moyle GJ, Lloyd M, Reynolds B, Baldwin C, Mandalia S, Gazzard BG. Dietary advice with or without pravastatin for the management of hypercholesterolaemia associated with protease inhibitor therapy. AIDS 2001; 15: 1503-8. [ Links ]
87. Negredo R, Paredes A, Bonjoch A, Tuldra CR, Fumanz S, Gel B. Benefit to switching from a protease inhibitor (PI) to nevirapine in PI-experienced patients suffering acquired HIV-related lipodystrophy syndrome (AHL): interim analysis at 3 months of follow up. Antiviral Ther 1999; 4: 23-38. [ Links ]
88. Martinez I, Conget L, Lozano L, Casamitjana R, Gatell JM. Reversion of metabolic abnormalities after switching from HIV-1 protease inhibitors to nevirapine. AIDS 1999; 13: 805-10. [ Links ]
89. Moyle GJ, Baldwin C, Comitis S, Dent N and Gazzard BG. Changes in visceral adipose tissue and blood lipids in persons reporting fat redistribution syndrome switched from PI therapy to efavirenz. Antiviral Ther 1999; 4: 48. [ Links ]
90. Walli R, Michi GM, Bogner JR, Goebel FD. Improvement of HAART-associated insulin resistance and dyslipidemia after replacement of protease inhibitors with abacavir. Eur J Med Res 2001; 6: 413-21. [ Links ]
91. Dujovne CA, Chremos AN, Pool JL, Schnaper H, Bradford RH, Shear CL, Higgins J, Downton M, Franklin FA, Nash DT. Expanded clinical evaluation of lovastatin (EXCEL) study results: IV: additional perspectives on the tolerability of lovastatin. Am J Med 1991; 91: 25S-30S. [ Links ]
92. Tobert JA. Efficacy and long-term adverse effect pattern of lovastatin. Am J Cardiol 1988; 62: 28J-34J. [ Links ]
93. Calza L, Manfredi R, Chiodo F. Statins and fibrates for the treatment of hyperlipidemia in HIV-infected patients receiving HAART. AIDS 2003; 17: 851-9. [ Links ]
94. Aberg JA, Evans AZR. A prospective, multicenter, randomized trial comparing the efficacy and safety of fenofibrate versus pravastatin in HIV-infected subjects with lipids abnormalities: ACTG 5087. Twelfth International AIDS Conference. Barcelona, 2002: Abstract LbPE B90181. [ Links ]
95. Hadigan C, Corcoran C, Basgoz N, Davis B, Sax P, Grinspoon S. Metformin in the treatment of HIV lipodystrophy syndrome: a randomized controlled trial. JAMA 2000; 284(4): 472-7. [ Links ]
96. Gelaton MC, Mynarcik DC, Quick JL, Steigbigel RT, Fuhrer J, Brathwaite CE, Brebbia JS, Wax FR, McNurlan MA. Improved insulin sensitivity and body fat distribution in HIV infected patients treated with roziglitazone: a pilot study. J Acquir Immune Defic Syndr 2002; 31(2): 163-70. [ Links ]
97. Walli R, Michl GM, Muhlbayer D, Brinkmann L, Goebel FD. Effects of troglitazone on insulin sensitivity in HIV-infected patients with protease inhibitor-associated diabetes mellitus. Res Exp Med (Berl) 2000; 199(5): 253-62. [ Links ]
98. Rietschel P, Hadigan C, Corcoran T, Stanley G, Neubauer G, Gertner J, Grinspoon S. Assesment of growth hormone dinamics in human inmunodeficiency virus-related lipodystrophy. J Clin Endocrinol Metab 2001; 86: 504-10. [ Links ]
99. Johannsson G, Marin P, Lonn L, Ottonson M, Stenlof K, Bjortorp P. Growth hormone treatment of abdominlally obese men reduces abdominal fat mass, improves glucose and lipoprotein metabolism, and reduces diastolic blood pressure. J Clin Endocrinol Metab 1997; 83: 727-34. [ Links ]
100.Lo JC, Mulligan K, Noor MA, Schwarz J-M, Halvorsen RA, Grunfeld C.The effects of recombinant human growth hormone on body composition and glucose metabolism in HIV-infected patients with fat accumulation. J Clin Endocrinol Metab 2001; 86: 3480-7. [ Links ]














