Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.56 no.2 Ciudad de México abr. 2004
Rev Invest Clín 2004; Vol. 56(2):143-152
ARTÍCULO ESPECIAL
Mecanismos patogénicos de la infección por VIH
Luis Enrique Soto Ramírez*
*Departamento de Infectología, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
Reimpresos:
Dr. Luis Enrique Soto Ramírez
Departamento de Infectología, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
Vasco de Quiroga 15. Tlalpan 14000. México, D.F.
Correo electrónico: Lsoto@quetzal.innsz.mx
RESUMEN
A pesar de los continuos avances que han ocurrido en el entendimiento de la forma en que el VIH produce daño destruyendo las células CD4+, no se han podido dilucidar los mecanismos específicos de virulencia y patogenicidad de este agente infeccioso y, por lo tanto, no se han podido diseñar las estrategias para su posible erradicación. Es muy importante profundizar en el entendimiento de la patogénesis de esta infección para poder combatirla y para este fin debemos de tratar de comprender fenómenos tan relevantes como la infección primaria, las variantes de la progresión a SIDA y en especial los determinantes de la relación virus-huésped.
PALABRAS CLAVE.Infección por VIH. Patogénesis. Subtipos. Progresion.
ABSTRACT
Despite the recent advances in the understanding of the mechanisms of HIV induced T cell depletion, it has not been possible to elucidate the specific virulence factors and as a consequence to create effective strategies for its eradication. It is mandatory to understand deeply the pathogenetic mechanisms of the HIV infection in order to face possible ways to destroy it. In order to fulfill this goal, we have to understand better important events like primary infection, the differences in progression to AIDS and specially those determinants of the host-virus relationship.
KEY WORDS. HIV infection. Pathogenesis, Subtypes. Progression.
La infección por el virus de inmunodeficiencia humana (VIH) y el síndrome de inmunodeficiencia adquirida (SIDA) que produce después de años de agotar las reservas de linfocitos T del cuerpo afectado, son hoy uno de los principales problemas de salud pública en el mundo. 1 A más de 20 años de que se describiera el primer caso del padecimiento que hoy conocemos como SIDA, el impacto de la epidemia en la sociedad, la economía y en los sistemas de salud es uno de los más deletéreos en la historia del mundo. Se calcula que al momento actual existen aproximadamente 43 millones de individuos infectados alrededor del mundo y 15,000 nuevas infecciones diarias. 2 A través de estos 20 años desde que se descubrió el agente etiológico y especialmente en los últimos 10 años se ha evidenciado un cambio drástico en la sobrevida y especialmente en la calidad de vida de los enfermos, como consecuencia de un mayor conocimiento de la patogénesis de esta infección tanto desde el punto de vista viral como inmunológico y virológico, 3 y del descubrimiento concomitante de agentes antirretrovirales con mayor potencia para suprimir la replicación viral. Es evidente que los grandes descubrimientos terapéuticos han sido consecuencia del conocimiento más profundo de los mecanismos íntimos de la acción de este virus junto con la existencia de algunos blancos terapéuticos que no habían sido explotados en su totalidad en forma previa. El camino del conocimiento de la patogénesis no ha sido fácil en estos 20 años dado que al destinarse múltiples recursos económicos a esta investigación, muchos grupos simplemente cambiaron su foco de atención y los resultados que han ofrecido ante la falta de experiencia, no han sido del todo atinados. Incluso resultados altamente promocionados por laboratorios e investigadores de reconocido prestigio han sido desmentidos poco tiempo después ante fallas metodológicas importantes. El aspecto básico de la patogénesis de la infección por el VIH es la destrucción de los linfocitos cooperadores CD4+ con la subsecuente pérdida de la competencia del sistema inmune. En este fenómeno participan también factores virales tanto de tropismo como de variación viral que son básicos para que el efecto final de destrucción linfocitaria se produzca. Con objeto de entender el porqué de estos procesos, repasaremos inicialmente la estructura y ciclo del VIH y luego las teorías de cómo destruye al sistema inmune.
ESTRUCTURA DEL VIRUS
El VIH pertenece a la familia de los retrovirus, los cuales son RNA virus, llamados así por poseer una enzima denominada transcriptasa reversa que es básica para completar el ciclo vital de todos los miembros de esta familia al crear DNA del RNA viral, el cual se integra al genoma de la célula huésped desde donde, como se verá más adelante, se realiza la regulación del genoma viral para la producción de nuevos viriones. En esta familia existen dos subfamilias que contienen patógenos para el humano, los oncovirus y los lentivirus. Dentro de los oncovirus se encuentran HTLV-I y HTLV-II, el primero asociado a neoplasias malignas de células T y alteraciones neurológicas y el segundo sigue en duda aún de ser patógeno y asociado a leucemia de células peludas. Es importante considerar la cercanía desde el punto de vista genético de estos dos virus con el VIH, lo que nos debe hacer tener en cuenta la posible oncogenicidad de los retrovirus en el desarrollo de nuevos candidatos de vacunas para VIH.
La familia de los lentivirus incluye a dos VIH: el tipo 1 y el tipo 2, los cuales tienen de 40 a 60% de homología de secuencia de aminoácidos, pero que se distinguen claramente desde el punto de vista epidemiológico. 4 El tipo 1 está diseminado en todo el mundo y es el responsable de la mayor parte de los casos de infección por VIH y el tipo 2 se encuentra restringido a África Oeste y países con lazos históricos y comerciales en esa región, aun cuando se han encontrado casos aislados en los EUA, principalmente en individuos con viajes a zonas de alta prevalencia. El VIH-2 es también causante de SIDA, sin embargo, en estudios seroepidemiológicos se ha documentado que tiene un periodo de incubación (entre la adquisición del virus y el desarrollo de SIDA) más largo que el de VIH-1 y que oscila entre 15 y 20 años. A pesar de que VIH-2 es raro fuera de África es importante considerar su interacción con VIH-1. Se ha visto en prostitutas de Senegal que han estado infectadas por VIH-2, que a pesar de estar expuestas a VIH-1 se infectan mucho menos frecuentemente que aquellas que no están infectadas. Esta protección cruzada, seguramente relacionada a la similitud antigénica entre ambos virus, es una posible herramienta para la creación de nuevos candidatos a vacunas.
CONFORMACIÓN ESTRUCTURAL DEL VIH-1
La microscopia electrónica de alta resolución ha revelado que el virión del VIH-1 es una estructura icosahédrica que contiene 72 protrusiones (glicoproteínas) y que es característicamente cubierta por una capa lipídica (Figura 1). 5 Cada partícula viral del VIH-1 está compuesta de dos copias idénticas de RNA de una sola cadena, el cual se encuentra empacado en una cubierta proteica o cápside (denominada en inglés "core"). Esta cápside forma parte de un complejo proteico en el interior o centro de la partícula viral, el cual está conformado por tres proteínas estructurales mayores. Dentro de la cápside encontramos todos los productos de otro gene estructural denominado pol, los cuales son básicos para los pasos tempranos del ciclo vital del virus, así como para la conformación final de las partículas virales antes de salir de la célula huésped. La cápside está rodeada de una cubierta lipídica que es derivada de la membrana celular de la célula huésped infectada, cubierta en la que están embebidas las glicoproteínas de membrana gp120 y gp41, que derivan del tercer gene estructural o env y que se encuentran abundantemente glicosiladas, un factor que es de gran importancia para el reconocimiento de los receptores de las células blanco. Como consecuencia lógica de la adquisición de la cubierta lipídica en ella protruyen varias moléculas de origen celular, incluyendo antígenos de histocompatibilidad clase I y clase II. 6
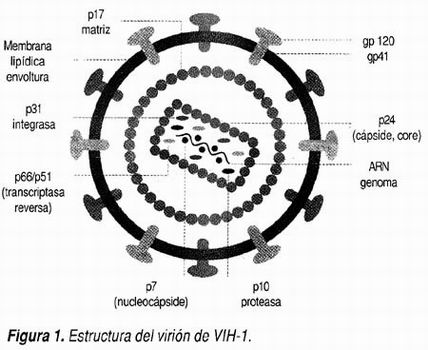
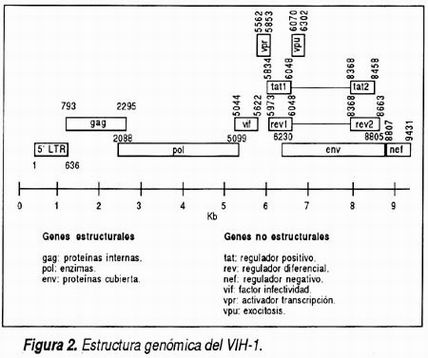
La característica que distingue a los lentivirus de otros retrovirus es la remarcable complejidad de su genoma. Aparte de las tres regiones estructurales previamente mencionadas, gag, pol y env, existen al menos seis genes adicionales, no estructurales y que se encargan de regular la replicación viral y la interacción del genoma viral con el genoma celular (Figura 2). Dentro de los genes no estructurales más importantes se encuentran los denominados vif, vpu, vpr, tat, rev y nef. Los productos de estos genes pueden actuar como reguladores positivos o negativos de la transcripción, algunos de ellos incluso de ambas formas y se asocian a infectividad. En la actividad individual, pero coordinada de estos genes se encuentran los mecanismos básicos y profundos de la patogénesis de la infección por VIH-1. Por otra parte, esta complejidad genómica podría constituirse en el tendón de Aquiles del virus, ya que puede ser blanco de múltiples intervenciones terapéuticas en el futuro.
EL CICLO VITAL DEL VIH-1
El ciclo que se lleva a cabo en la célula huésped por el VIH-1 es un evento complejo ejemplificado en la figura 3.
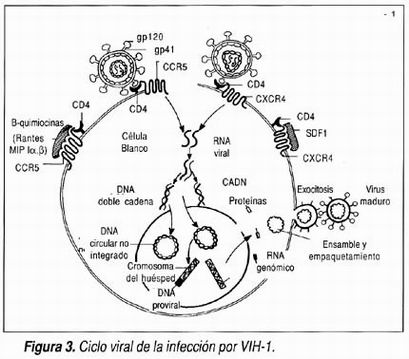
Receptores celulares y entrada viral
El VIH-1 es capaz de infectar diferentes células del cuerpo humano. Sus blancos principales son el linfocito T CD4+ y los macrófagos aunque es capaz de infectar otros linfocitos, células de sostén(glía) del sistema nervioso central y neuronas, células enterocromafines del intestino y células dendríticas incluyendo las células de Langerhans, 7 así como precursores de médula ósea. La entrada a estas células depende de la identificación de receptores específicos entre los que destaca la molécula CD4 y los más recientemente descubiertos correceptores, como CCR5, y CXCR4, el primero correceptor en macrófagos y el segundo correceptor en linfocitos T. 8 El contacto del VIH-1 con el receptor y correceptor origina una serie de cambios en la estructura viral, a nivel de las glicoproteínas de superficie que desemboca en la fusión de las membranas viral y celular y la internalización del virión. Por otra parte, el mejor entendimiento del proceso de fusión que es un mecanismo independiente de pH y mediado por un polipéptido (trimérico) de la gp41 ha permitido el desarrollo de inhibidores de fusión (que impiden la unión de las membranas), uno de los nuevos armamentarios en contra de esta infección, aun cuando hasta este momento se ha enfrentado a un problema importante de desarrollo de resistencia, incluso rápidamente en vista de que se relacionan con una de las regiones virales más variables como es la de las glicoproteínas de cubierta. 9
Integración, latencia y regulación genómica
Después de la internalización se realiza la transcripción reversa con la formación de DNA del RNA viral. La transcriptasa reversa es la enzima que no sólo hace la copia del material genético viral RNA y lo convierte a una cadena simple de DNA, sino que también complementa esta cadena para crear un DNA de doble cadena, que pueda incorporarse al material genético de la célula huésped (integración) en donde se denomina provirus. La transcriptasa reversa es uno de los blancos terapéuticos más usados al momento actual, ya que es la enzima que es inhibida competitivamente por los análogos nucleósidos (AZT, ddI, ddC, 3TC, d4T y abacavir) y no competitivamente por los no nucleósidos (efavirenz, nevirapina y delavirdina). 10 La enzima transcriptasa reversa al realizar estas copias comete un error de copia (mutación) en cada genoma que copia generando poblaciones virales cada vez más diferentes de la cepa predominante inicial a la cual se le denomina silvestre. A las diferentes variantes presentes en un individuo se les denomina cuasiespecies, pudiendo existir cientos de miles de variantes coexistentes en un solo organismo, las cuales están relacionadas con patogenicidad y resistencia a antirretrovirales.
El provirus es el encargado de dirigir la creación de nuevas partículas virales, lo cual ocurre en la mayor parte de las células infectadas permitiendo la producción de un billón de partículas virales por día, en contra de lo que se pensaba previamente en relación con la latencia virológica en conjunto con la latencia clínica. Sin embargo, vale la pena mencionar que desde el primer momento de la infección por VIH-1 se forma un reservorio de células T latentemente infectadas que probablemente y por razones desconocidas replican virus sólo en forma esporádica permaneciendo por largo tiempo latentes y constantes en un "pool" de aproximadamente un millón de células. 11
Este reservorio es probablemente la causa principal del fracaso terapéutico de los antirretrovirales para lograr la cura, ya que aun cuando se haya mantenido a un paciente indetectable por un periodo largo, al suspender el tratamiento siempre habrá un rebote viral que proviene importantemente de estas células T latentes. 12
Morfogénesis, exocitosis y efectos citopáticos
Las proteínas estructurales de gag y pol son formadas de un mismo precursor, así como las dos glicoproteínas de cubierta son originadas de otro llamado gp160. La digestión del precursor gag-pol ocurre como efecto de la proteasa viral y generalmente se produce ya dentro de la partícula viral, probablemente incluso cuando ésta ya ha sido exocitada. Esta proteasa viral es el blanco de acción del otro gran grupo de antirretrovirales, los denominados inhibidores de proteasa (amprenavir, indinavir, lopinavir, nelfinavir, ritonavir y saquinavir) cuya acción genera la producción de partículas virales que pasan a circulación, pero que no son infectantes para otras células blanco. 13
CUASIESPECIES, SUBTIPOS VIRALES, RECOMBINANTES Y SUS CARACTERÍSTICAS BIOLÓGICAS
El estudio de las secuencias genéticas de diferentes aislados de VIH-1 alrededor del mundo ha permitido agrupar a éstos en tres grandes grupos denominados M, N y O. El grupo M se denomina así por ser el principal y contiene al menos a ocho subtipos puros denominados con letras: A, B, C, D, F, G, H, J y una serie de al menos cuatro recombinantes entre éstos (Figura 4). Los grupos N y O son filogenéticamente distantes del grupo M, de tal manera que se sitúan incluso en forma intermedia entre éste y el VIH-2. Esta gran diferencia genómica se traduce también en forma en la expresión de antígenos, de tal manera que los inmunoensayos enzimáticos actuales (ELISA) no son capaces de detectar infección por grupo O o N, para lo cual se encuentran ya en desarrollo y otros, incluso, ya en uso, nuevos ensayos que sí abarcan su detección. Afortunadamente estos grupos están confinados primordialmente al África Central y Oeste y sólo se han detectado en casos aislados en sujetos que están epidemiológicamente relacionados con esa localización geográfica. 14
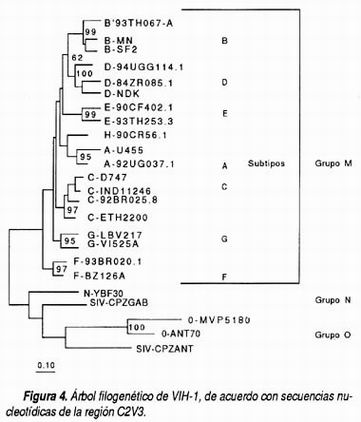
Los subtipos y grupos de VIH-1 se ha demostrado que se introdujeron en el humano en una forma independiente, probablemente por transmisiones específicas e individuales de los primates a los humanos. Posteriormente cada uno de los subtipos ha evolucionado en forma independiente y hasta este momento distintiva desde el punto de vista filogenético.15 Sin embargo, en forma reciente se ha apreciado la existencia de variantes que filogenéticamente pertenecen a dos subtipos de acuerdo con la región genómica secuenciada. Estas variantes se han catalogado como recombinantes gracias a la obtención de secuencias del genoma completo que han permitido analizar la presencia de secuencias de dos o incluso tres diferentes subtipos en un mismo genoma. Para que se lleve a cabo este proceso es necesario que coexista la infección de dos subtipos en un mismo individuo e incluso en una misma célula para que los materiales genéticos sean recombinados, en un fenómeno muy característico de los retrovirus y se adquieran secuencias mixtas. El resultado de estas recombinaciones es más variación viral que la generada por las mutaciones por inadecuada función de la transcriptasa reversa y se ha asociado, asimismo, con la presencia de variantes virales con características específicas como la facilidad de transmisión o la mayor replicación. 16
Los subtipos virales se encuentran distribuidos geográficamente en forma específica, predominando el subtipo B en América y Europa, el subtipo E en el Sureste de Asia y el subtipo C en África, la India y recientemente China. Aun cuando cuestionada existen múltiples evidencias que demuestran la relación de estos subtipos con características biológicas específicas, lo cual a su vez explica el porqué de algunas de las predominancias desde el punto de vista geográfico. Así, los virus subtipo B predominan en sitios donde la transmisión por contacto homosexual y por uso de drogas intravenosas es prevalente y los subtipos E y C predominan en regiones donde la transmisión heterosexual es la dominante. Se demostró previamente que estas diferencias eran al menos parcialmente debidas por la capacidad de selección y replicación de las células blanco. 17 Por ejemplo, las células de Langerhans, uno de los blancos principales en la transmisión heterosexual, replican mucho mejor las cepas virales tipos E y C, explicando el porqué predominan asociadas a dicha transmisión. 18 Por otra parte, se ha visto que virus subtipo no B tienen una velocidad de progresión a SIDA más rápida que los subtipo B. En el caso muy particular de los virus subtipo C se ha visto que la variación genómica es mucho mayor en el tiempo que en otros subtipos.
Finalmente, vale la pena mencionar que las recombinantes se han también asociado con características especiales. Así en recombinantes A-D o A-C en África, se ha evidenciado que cuando es la secuencia del subtipo C la que predomina en la región variable 3 (V3) de la cubierta, la transmisión del virus de la madre al hijo es mucho más frecuente que cuando esto no ocurre. 19
Recientemente se han dado a conocer las secuencias de genomas enteros de VIH. La recombinación existente en diferentes regiones es mucho mayor a la imaginada, dificultando así la creación de una vacuna universal. Más aún, se ha puesto en evidencia cómo en África existen dos patrones de distribución de subtipos, predominando las recombinantes en África Central y del Oeste, cada uno de ellos relacionado con diferencias en la diseminación de la epidemia, reafirmando la importancia de estas variantes en el comportamiento de las epidemias en diferentes regiones geográficas. En contraparte a esta información se ha evidenciado que muchos de los nuevos candidatos a vacunas están basados sólo en virus subtipo B predominantes en países industrializados. 14,20
A nivel individual, las cuasiespecies son el producto de la gran cantidad de mutantes generadas, así como del escape inmune y de otras presiones evolutivas que sufre el virus. En este proceso tan activo se llegan a generar variantes que cambian su tropismo y que son claramente más patógenas al destruir más fácilmente linfocitos CD4+. 9
REPLICACIÓN VIRAL Y DESTRUCCIÓN LINFOCITARIA
La infección por VIHes un proceso crónico que implica una producción elevada y constante de nuevos viriones, acompañada de la consecuente destrucción de linfocitos CD4+ (efecto citopático). 21 Esta destrucción celular es compensada durante varios años, hasta que las reservas corporales se agotan, lo que desemboca en una depleción de estos linfocitos, que son las células coordinadoras de la respuesta inmune, razón por la cual se produce una inmunodeficiencia adquirida. El evento cardinal en la progresión a enfermedad es la replicación viral mientras que el evento determinante del desarrollo de inmunodeficiencia es la destrucción celular linfocitaria. 22
Desafortunadamente el o los mecanismos específicos que producen este efecto no son adecuadamente conocidos, aunque varios son los postulados. 23 Si se imagina la exocitosis masiva de miles de viriones, cada uno con una porción de membrana celular es posible pensar que por el simple efecto mecánico y la pérdida de regulación osmótica la célula podría destruirse. Otra posibilidad ya mencionada es la acumulación de moléculas nocivas para la célula como podría ser el DNA viral no integrado. In vitro , la fusión de células gracias a la presencia en la superficie celular del receptor CD4 y de la gp120/gp41 que permanece después de la entrada del virus a la célula, con la formación de sincicios o grandes acúmulos de células fusionadas que se destruyen es una clara explicación del efecto citopático viral; sin embargo, este fenómeno ha sido muy raramente observado in vitro . Otros mecanismos propuestos son la apoptosis o muerte celular programada originada o estimulada en la producción viral y la consecuente susceptibilidad a ciertos mediadores como Fas 24 y la destrucción autoinmune de la célula mediante un efecto de citotoxicidad mediada por anticuerpos, así como el arresto del ciclo celular en fase G2 como efecto de otra proteína regulatoria viral denominada vpr. 25 Será muy importante trabajar en la precisión de estos mecanismos puesto que el bloquearlos se convertiría en uno de los acercamientos más interesantes en la terapia antirretroviral.
Las variantes presentes en la mayoría de los individuos al principio de la enfermedad son macrofago-trópicas, lo que les da la ventaja de permanecer por largo tiempo y de "esconderse" del sistema inmune, mientras que cuando existe un cambio de tropismo, a mayor afinidad por células T se incrementan los efectos citopáticos en los linfocitos originando la inmunodeficiencia. 26
El huésped participa activamente en la selección natural que se establece de variantes virales a través de la expresión de diversos receptores y correceptores para el virus, así como de la selección constante de variantes que se escapan de la respuesta inmune generada. 27 La respuesta inmune generada por el huésped es variada, pero se considera que la más importante es la citotóxica mediada por linfocitos CD8+ (linfocitos T citotóxicos). La generación de una respuesta citotóxica adecuada depende de la presencia de células CD4+, por lo que la disminución de estas células afecta importantemente también la capacidad del organismo de luchar contra el virus. 28
LA INFECCIÓN PRIMARIA Y SU IMPORTANCIA
Se denomina infección primaria a la adquisición de la infección viral y a las manifestaciones asociadas al episodio de replicación viral inicial. Pocas veces se detecta en población abierta y rara vez en nuestro medio, aun cuando probablemente es sintomática en hasta 70% de los casos. La sintomatología generalmente se presenta de dos a cuatro semanas después de la adquisición de la infección, pero a veces el periodo de incubación puede ser hasta de 10 meses. Las principales manifestaciones son:
• Fiebre.
• Crecimiento ganglionar.
• Faringitis.
• Erupción maculopapular en cara y tronco.
• Ulceraciones en mucosas.
• Mialgias.
• Artralgias.
• Linfopenia, especialmente de linfocitos CD4+ y altos niveles de carga viral.
La presencia de síntomas durante la infección primaria se asocia a una progresión rápida de la enfermedad, lo cual nos está hablando de la importancia de los eventos que en este periodo ocurren. 29 En efecto, se ha determinado que los niveles de carga viral principalmente, y también los de células CD4+ seis a ocho meses después de la infección primaria, en lo que se ha denominado "setpoint" o periodo estable inicial, correlacionan fuertemente con el pronóstico de desarrollo de SIDA en los siguientes cinco años. 30,31 Este "setpoint" es el resultado de una lucha inicial que se libra entre dos fuerzas: la respuesta inmune y la virulencia de la cepa viral adquirida, e implica desde luego la predominancia de alguna de estas cepas determinando así el curso posterior que va a seguir la infección por VIH y la prontitud del desarrollo de SIDA. Se ha demostrado claramente que durante la infección primaria es necesaria la acción de linfocitos CD4 para lograr una mayor supresión viral y, por lo tanto, disminuir la carga viral inicial y prolongar el tiempo a desarrollo a SIDA. 32 Se ha propuesto que el tratamiento dentro de los primeros meses de la infección primaria pudiera tener un efecto disminuyendo la carga viral y alargando la progresión a enfermedad, sin embargo, esto no ha sido documentado categóricamente y no hay bases para ser recomendado.
HISTORIA NATURAL DE LA INFECCIÓN POR VIH-1 Y VARIANTES DE PROGRESIÓN A SIDA
El VIH es un virus predador y altamente evolucionado que elude los intentos de nuestro sistema inmune para defendernos. La evolución desde la adquisición del virus hasta el desarrollo de SIDA es muy variable para cada individuo e independiente de la vía de transmisión. La gran variabilidad en el curso de la infección por VIH-1 resulta de una compleja relación entre factores del huésped y del virus 33 que desemboca en diferentes formas y tiempos de progresión desde el momento de la infección al desarrollo de SIDA. El entendimiento de las causas de estas diferencias en progresión será de gran ayuda para establecer un manejo preventivo y terapéutico óptimo y para ello es necesario comprender diferentes aspectos del binomio implicado, es decir, tanto del huésped como del virus. La magnitud en que cada uno de estos dos protagonistas influye en el desarrollo de enfermedad y en la velocidad en que ésta ocurre es muy difícil de precisar y en la literatura existen como consecuencia aquellos que consideran que es prácticamente un evento regulado por el huésped 34 y otros que lo atribuyen directamente al virus. 35
Existen diferentes tipos de progresión determinados por el tiempo que ocurre desde la infección hasta el desarrollo de SIDA, denominado también periodo de latencia clínica. Los progresores típicos constituyen a 80-85% de las personas infectadas por VIH y desarrollan SIDA en una mediana de tiempo de siete a 10 años mientras que los progresores rápidos (10-15%) lo hacen en tres años o menos y los lentos progresores(5-10%) en más de 10 años. En este grupo se incluyen también una serie de individuos denominados No progresores a largo plazo (NPLP), que son alrededor de 2% y que abarca individuos que no han desarrollado SIDA por más de 13 años y en algunos casos han permanecido asintomáticos hasta 23 años. 36 La definición de estos dos grupos aún no es clara y se usa no sólo el tiempo mencionado, sino éste combinado con las cuentas de células CD4+ que generalmente se mantienen constantes (= o > 600/mm 3 ) aunque en niveles por debajo de los normales y los niveles de carga viral, que generalmente son bajos (< 10,000 copias/mL). Asimismo, el aislamiento viral en los NPLP es únicamente posible en 65% de los casos. 37 Estos individuos, al pasar del tiempo, van progresando por razones desconocidas, de tal manera que permanecen libres de progresión sólo 28% después de los 16 años.
Factores del huésped y del virus responsables de una lenta progresión a SIDA
Las diferencias en progresión observadas en individuos infectados por VIH-1 son evidentemente multifactoriales. Entre los factores que más se han estudiado se encuentran los polimorfismos en genes humanos, especialmente en los que codifican las quimiocinas y los receptores de éstas, y que se mencionaron previamente, los inmunológicos y desde luego los originados en el virus, por su gran variación genética y que se asocian a variantes virales atenuadas o que escapan a la respuesta inmune. Estos factores relacionados a lenta o no progresión se han estudiado mediante cohortes de individuos que son seguidos en forma prolongada después de seroconvertir, siendo evaluados de acuerdo con niveles de carga viral y decremento de células CD4+ o bien en estudios comparativos entre grupos de individuos infectados con diferente velocidad de progresión.
Factores genéticos
Dentro de estos factores destacan una serie de polimorfismos en los receptores de quimiocinas, que son los correceptores de la molécula CD4, tal y como se menciona previamente en este capítulo. En el caso de CCR5, el correceptor principal de las cepas con tropismo por macrófagos, se ha detectado una deleción de 32 pares de bases del gene, polimorfismo llamado CCR5delta32, que codifica consecuentemente para una proteína incompleta que no es capaz de llegar a la superficie celular, no existiendo entonces el receptor para el VIH, lo que impide la entrada del virus a la célula. 37 Esta deleción no se distribuye de manera homogénea en la población mundial: se encuentra prácticamente ausente en África, Asia y en nativos de América; es rara en Australia y en afroamericanos, y tiene una prevalencia variable en caucásicos: en Europa se ha observado un gradiente, es mayor en el norte y disminuye progresivamente hasta ser indetectable en Arabia Saudita, con una frecuencia aproximada de 20% en forma heterocigota y 1% en forma homocigota. En México se ha encontrado una frecuencia de 3 a 4% de la población general, sin relación con el antecedente caucásico de los individuos estudiados. 38
Otras variantes alélicas de receptores de quimiocinas y una para un ligando de quimiocina han sido descritas como involucradas en la patogénesis del VIH-1. Una variante alélica del correceptor para VIH-1 llamada CCR2 (CCR2-64I o 46295 G/a,) tiene una mutación de una sola base que resulta en una sustitución de una valina por isoleucina que parece retrasar el desarrollo de SIDA, pero no ha sido asociado a protección de infección. A diferencia del alelo Delta 32, este alelo llamado 64I se ha encontrado también en afroamericanos y asiáticos, con una frecuencia alélica de 0.10 a 0.25 en estas poblaciones. No se sabe cómo esta variante alélica del receptor C2b afecta la progresión a SIDA, ya que valina e isoleucina tienen las mismas características funcionales y químicas y en teoría no deben alterar la estructura del receptor CCR2b. Se especula que la mutación altera la función del CCR2b o que indirectamente tiene influencia en la afinidad del CCR5 por el VIH-1. 39 El factor derivado del estroma (SDF-1 también llamado fac-tor estimulante del crecimiento pre-B, es una citocina quimioatrayente muy poderosa y es el ligando natural para CXCR4. La variación alélica del gen de SDF-1 ha sido reconocida como importante en la progresión a SIDA. Se trata del cambio de una sola base en la posición 801 de la región no traducida 3' del ARNA de SDF-1 (SDF1-3' A). No se conoce con precisión cuál es el efecto de esta variante alélica, algunos estudios sugieren que SDF-1 es capaz de inhibir la expresión de CXCR4 en las células mediante la inducción de endocitosis, bloqueando la entrada de cepas T trópicas, pero no de M-trópicas. Otro posible mecanismo de acción es que se produce un aumento en la producción de SDF-1 dando como resultado un bloqueo del receptor CXCR4. 40
El polimorfismo CCR5-delta32 en forma heterocigota confiere una reducción de 24% en el riesgo de progresión a SIDA en un metaanálisis de 2,213 seroconvertores, lo que implica un retraso en la progresión habitual de dos a cuatro años. En ese mismo estudio el polimorfismo CCR2-64I produjo 26% de reducción, en un efecto que aunque tiene pobre explicación fisiopatológica pudiera estar en relación con la formación de dímeros entre esta variante y el CCR5 a nivel intracelular. 41 Estos efectos podrían tener relación con el tipo de raza, ya que CCR5-delta32 es más común en caucásicos, mientras CCR2 64I parece ser más protector para mujeres africanas. El papel de CCR264I en la población caucásica está en debate. Mientras que se ha encontrado que este polimorfismo se asocia en ingleses con prolongación del tiempo de caída de los CD4 a menos de 200 células, en un efecto independiente de CCR5 delta 32 o a mutaciones en el promotor del mismo CCR5, esta información contrasta importantemente con la cohorte danesa en la cual CCR264I no tuvo ninguna relación con desarrollo de SIDA, sobrevida o decremento anual en cifras de células T CD4+. A pesar de algunos estudios muy convincentes de la asociación de los polimorfismos de CCR5 y CCR2, en forma reciente se han reportado casos de no progresión con pobre relación a estos polimorfismos, por ejemplo, en NPLP australianos. El análisis de la cohorte MACS demostró un efecto de la expresión heterocigota de CCR5-delta32 en la disminución de las cuentas de células CD4+ y en el desarrollo de SIDA, que, sin embargo, desapareció cuando este efecto se ajustó de acuerdo con la carga viral inicial. 42
El polimorfismo SDF1 3'A cuando se presenta en forma homocigota es un factor de mayor protección que los polimorfismos heterocigotos de CCR5 o CCR2, pero a diferencia de ellos es más palpable en etapas tardías de la infección muy probablemente en relación con el bloqueo de cepas R4 o linfotrópicas que están presentes en dicha etapa. En especial cuando se combinan los tres polimorfismos se ha visto que ocurre un retraso en la progresión a SIDA en hasta 10 a 15 años. 40
Otros factores genéticos asociados a las variantes en progresión a SIDA radican en los genes del complejo mayor de histocompatibilidad. En un análisis de la cohorte MACS se encontró que cuando las tres clases de alelos clase I del antígeno mayor de histocompatibilidad eran heterocigotas, esto se asoció con la progresión más lenta comparado a cuando existía la forma homocigota para cualquiera de los alelos. Se documentó, asimismo, que entre mayor número de alelos homocigotos más pobre era el pronóstico. 43 Por otra parte, se encontró que cuando estaban presentes B35 y Cw04 existía un riesgo mayor de progresión rápida. 44 En los australianos y sin contar aquellos con variantes nef se encontró un alto número de HLA-A32 y A25 y una frecuencia baja de HLA-B8 que en controles. En otro estudio, 45 combinando poblaciones de EU y Australia, encontró que 85% (11/13 NPLP) tenían un HLA B*5701 en comparación con 9.5% de los progresores normales o típicos, sugiriéndose poderosamente un mecanismo de inmunidad viral específica que opera directamente a través de la molécula B*5701.
Factores virales
En estas variaciones en la progresión a enfermedad de la infección por VIH se han encontrado, asimismo, algunos factores virales que son debidos a la gran variación viral y a la formación de cuasiespecies. Tanto la existencia de virus defectivos con deleciones del gene nef o alteraciones en las regiones LTR que integran el provirus con el genoma humano, así como la diversidad genética de las regiones hipervariables de la cubierta, de gag (codificadora de cápside) y nef (gene regulatorio) son polimorfismos poco comunes y que en forma muy interesante son muy difíciles de revertir a diferencia de otras alteraciones genéticas que desaparecen rápidamente. Cuasiespecies de deleciones e inserciones nef coexistiendo con secuencias no modificadas de nef fueron vistas en 2/3 partes de lentos progresores, pero no en NPLP americanos. En ambos grupos se encontraron hallazgos únicos en las secuencias de cubierta, desaparición de un sitio de glicosilación en V3 (frecuencia de 60%) e importantemente una extensión en la región V2. 46 Por otra parte, se ha encontrado que la región V3 presenta mayor divergencia intra-paciente en NPLP (8.6 vs . 5.3% de progresores típicos) y que algunas mutaciones cruciales en el asa de V3 originan variantes virales incapaces de infectar células CD4+. 47 Otro trabajo fue capaz de demostrar gran variación viral, pero en regiones constantes de la cubierta tales como C3. Esta aparente paradoja, en vista de niveles más bajos de carga viral, en la que las secuencias de virus de NPLP tienen mayor variación, podría ser secundaria a la existencia de gran presión inmunológica, es decir, mayor que en los casos de progresión típica. Aun cuando el grupo más famoso de NPLP descrito en Australia posterior a transmisión por productos sanguíneos de virus deletados en nef, estas variantes no han sido encontradas en otros grupos similares como drogadictos italianos. 48
En los lentos progresores mexicanos (n = 17) definidos como aquellos con más de siete años de infección, cuentas de células CD4+ por arriba de 450/mm 3 y sin tratamiento antirretroviral y en comparación con 11 progresores típicos no se encontró ninguna diferencia en la frecuencia de los polimorfismos CCR5-delta32, CCR264I y SDF13'A. 49 Asimismo, en el seguimiento virológico de los lentos progresores nos ha revelado la existencia de cargas virales de mayor magnitud a las reportadas en la literatura (> 15,000 copias/mL.) que no tienen ninguna traducción en el decremento de las cuentas células CD4+. Finalmente, en la búsqueda de las causas asociadas a esta lenta progresión hemos descartado la participación de anticuerpos neutralizantes contra las proteínas de la cubierta viral.
CONCLUSIONES
Como se puede observar, el entendimiento de la patogénesis del VIH es amplio y a la vez muy limitado. Es claro que sólo es la superficie de todo lo que necesitamos conocer al respecto del mismo para poder elaborar estrategias exitosas de prevención y tratamiento.
REFERENCIAS
1. Fauci AS. The AIDS epidemic-considerations for the 21st Century. N Engl J Med 1999; 341: 1046-50. [ Links ]
2. Anonymus. AIDS epidemic update. Joint United Nations Programme on HIV/AIDS. 2002. Geneva, Switzerland. [ Links ]
3. Stevenson M. HIV-pathogenesis. Nature Medicine 2003; 9: 853-60. [ Links ]
4. Tang H, Kuhen KL, Wong Staal F. Lentivirus replication and regulation. Annu Rev Genet 1999; 33: 133-70. [ Links ]
5. Wilk T, Fuller SD. Towards the structure of the human immunodeficiency virus: divide and conquer. Curr Opin Struct Biol 1999; 9(2): 231-43. [ Links ]
6. Poon DT, Coren LV, Ott DE. Efficient incorporation of HLA class II onto human immunodeficiency virus type 1 requires envelope glycoprotein packaging. J Virol 2000; 74: 3918-23. [ Links ]
7. Pope M. Mucosal dendritic cells and immunodeficiency viruses. J Infect Dis 1999; 179(Suppl. 3): S427-S30. [ Links ]
8. Lee B, Montaner LJ. Chemokine immunobiology in HIV-1 pathogenesis. J Leukoc Biol 1999; 65(5): 552-65. [ Links ]
9. Eckert DM, Malashkevich VN, Hong LH, et al. Inhibiting HIV-1 entry: discovery of D-peptide inhibitors that target the gp41 coiled-coil pocket. Cell 1999; 99(1): 103-15. [ Links ]
10. Jonckheere H, Anné J, De Clercq E. The HIV-1 reverse transcription (RT) process as target for RT inhibitors. Med Res Rev 2000; 20(2): 129-54. [ Links ]
11. Schacker T, Little S, Connick E, et al. Rapid accumulation of human immunodeficiency virus (HIV) in lymphatic tissue reservoirs during acute and early HIV infection: implications for timing of antiretroviral therapy. J Infect Dis 2000; 181: 354-7. [ Links ]
12. Finzi D, Blankson J, Siciliano JD, et al. Latent infection of CD4+ T cell provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nat Med 1999; 5: 512-25. [ Links ]
13. Todd S, Anderson C, Jolly DJ, Craik CS. HIV protease as a target for retrovirus vector-mediated gene therapy. Biochim Biophys Acta 2000; 1477(1-2): 168-88 [ Links ]
14. Thomson MM, Pérez-Alvarez L, Nájera R. Molecular epidemiology of HIV-1 genetic forms and its significance for vaccine development and therapy. Lancet Infect Dis 2002; 2: 461-71. [ Links ]
15. Korber B, Muldoon M, Theiler J, et al. Timing the ancestor of the HIV-1 pandemic strains. Science 2000 Jun 9 ; 288(5472): 1789-96. [ Links ]
16. Costa LJ, Munerato P, Díaz RS, Tanuri A. Generation of intersubtype human immunodeficiency virus type 1 recombinants in env gene in vitro : influences in the biological behavior and in the establishment of productive infections. Virology 2000; 268: 2, 440-51. [ Links ]
17. Smith PD, Li L, Meng G. Mucosal events in the pathogenesis of human immunodeficiency virus type 1 infection. J Infect Dis 1999; 179(Suppl 3): S436-S40. [ Links ]
18. Soto-Ramírez LE, Renjifo B, McLane M, Marlink R, O'Hara C, Sutthent R, Wasi C, Vithayasai V, Apichartpiyakul C, Auewarakul P, Peña V, Chui D-S, Osathanondh R, Meyer K, Lee TH, Essex M. HIV-1 Langerhans' cell tropism associated with heterosexual transmission of HIV. Science 1996; 271: 1291-3. [ Links ]
19. Renjifo B, Mwakgile D, Msamanga G, et al. Common genetic arrangements among human immunodeficiency virus type 1 subtype A and D recombinant genomes vertically transmitted in Tanzania. AIDS Res Hum Retroviruses 2002;18(13): 947-56. [ Links ]
20. Mc Cutchan F, Carr JK, Robb M, et al. Among 46 near full length HIV type 1 genome sequences from Rakai District, Uganda, subtype D and AD recombinants predominate. AIDS Res Hum Retroviruses 2002; 18(17): 1281-90. [ Links ]
21. Abdelwahab SF, Cocchi F, Bagley KC, et al. HIV-1-suppressive factors are secreted by CD4+ cells during primary immune responsens. Proc Natl Acad Sci USA (United States) 2003; 100(25): 15006-10. [ Links ]
22. Stocker H, Scheller C, Jassoy C. Destruction of primary CD4(+) T cells by cell-cell interaction in human immunodeficiency virus type 1 infection in vitro. J Gen Virol (England) 2000; 81(Pt 8): 1907-11. [ Links ]
23. Jaworowski A, Crowe SM. Does HIV cause depletion of CD4+ T cells in vivo by the induction of apoptosis? Immunol Cell Biol 1999; 77(1): 90-8. [ Links ]
24. Gougeon ML, Montagnier L. Programmed cell death as a mechamism of CD4 and CD8 T cell deletion in AIDS. Molecular controla and effect of highly active anti-retroviral therapy. Ann NY Acad Sci 1999; 887: 199-212. [ Links ]
25. Dockrell DH, Badley AD, Algeciras Ascimmich A, Simpson M, Schut R, Lynch DH, Paya CV. Activation-induced CD4+ T cel ldeath in HIV-positive individuals correlates with Fas susceptibility, CD4+ T cell count, and HIV plasma viral copy number. AIDS Res Hum Retroviruses 1999; 15(17): 1509-18. [ Links ]
24. Ho DD, Neumann AU, Perelson AS, et al. Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature 1995; 373: 123-6. [ Links ]
25. Pitcher CJ, Quittner C, Petterson DM, et al. HIV-1-specific CD4+ T cells are detectable in most individuals with active HIV-1 infection, but decline with prolonged viral suppression. Nature Medicine 1999: 5: 518-25. [ Links ] 26. Balter M. How does HIV overcome the body's T cell bodygards? Science 1997; 278: 1399-400. [ Links ]
27. Wei X, Ghosh SK, Taylor ME, et al. Viral dynamics in HIV-1 infection. Nature 1995; 373: 117-22. [ Links ]
28. Schwartz SA, Nair MPN. Current concepts in Human Immunodeficiency Virus Infection and AIDS. Clin Diag Lab Immunol 1999; 6: 295-305. [ Links ]
29. Burchell AN, Calzavara L, Ramuscak N, et al. Symptomatic primary HIV infection or risk experiences? Circumstances surrounding HIV testing and diagnosis among recent seroconverters. Int J STD AIDS 2003; 14: 601-8. [ Links ]
30. Apoola A, Ahmad S, Radcliffe K. Primary HIV infection. Int J STD AIDS 2002; 13: 71-8. [ Links ]
31. Lindback S, Thorstensson R, Karlsson AC, et al. Diagnosis of primary HIV-1 infection and duration of follow-up after HIV exposure. Karolinska Institute Primary HIV Infection Study Group. AIDS 2000; 14: 2333-9. [ Links ]
32. Putter H, Prins JM, Jurriaans S, et al. Slower decline of plasma HIV-1 RNA following highly suppressive antiretroviral therapy in primary compared with chronic infection. AIDS 2000; 14: 2831-9. [ Links ]
33. Hubert JB, Burgard M, Dussaix E, et al. Natural history of serum HIV-1 RNA levels in 330 patients with a known date of infection. The SEROCO Study Group. AIDS 2000; 14: 123-31. [ Links ]
34. Sheppard HW, Lang W, Ascher MS, et al. The characterization of non-progressors: long-term HIV-1 infection with stable CD4+ T-cell levels. AIDS 1993; 7: 1159-66. [ Links ]
35. Candotti D, Costagliola D, Joberty C, et al. Status of long-term asymptomatic HIV-1 infection correlates with viral load but not with virus replication properties and cell tropism. French ALT Study Group. J Med Virol 1999; 58: 256-63. [ Links ]
36. Buchbinder S, Vittinghoff E, HIV-infected long-term nonprogressors: epidemiology, mechanisms of delayed progression, and clinical and research implications, microbes infect (France) 1999; 1(13): 1113-20. [ Links ]
37. McNicholl JM, Smith DK, Qari SH, Hodge T. Host genes and HIV: the role of the chemokine receptor gene CCR5 and its allele (delta32 CCR5). Emerg Infect Dis 1997; 3: 261-71. [ Links ]
38. González-Diaz E, Delgado F, Ruiz-Palacios GM, Soto-Ramírez LE. CKR-5-Gene allele mutants in Mexican population. 5 th Conference on retroviruses and opportunistic infections, 1998, abstract 214. [ Links ]
39. Kostrikis LG, Huang Y, Moore JP, et al. A chemokine receptor CCR2 allele delays HIV-1 disease progression and is associated with a CCR5 promotor mutation. Nat Med 1998; 4: 350-3. [ Links ]
40. Winkler C, Modi W, Smith MW, et al. Genetic restriction of AIDS Pathogenesis by an SDF-1 chemokine gene variant. Science 1998; 279: 389-93. [ Links ]
41. Ioannidis J, Rosenberg P, Goedert J, et al. Effects of CCR5-Delta32, CCR2-64I, and SDF-1 3'A alleles on HIV-1 disease progression: an international meta-analysis of individual-patient data. Ann Intern Med 2001; 135(9): 782-95. [ Links ]
42. Taylor JM, Wang Y, Ahdieh L, et al. Causal pathways for CCR5 genotype and HIV progression. J Acquir Immune Defic Syndr 2000; 23: 160-71. [ Links ]
43. O'Brien S, Moore JP. The effect of genetic variation in chemokines and their receptors on HIV transmission and progression to AIDS. Immunol Rev 2000; 177: 99-111. [ Links ]
44. Carrington M, Nelson G, Martin MP, et al. HLA and HIV-1: heterozygote advantage and B*35-Cw*04 disadvantage. Science 1999; 279: 1748-52. [ Links ]
45. Migueles SA, Sabbaghian MS, Shupert WL, et al. HLA B*5701 is highly associated with restriction of virus replication in a subgroup of HIV-infected long-term nonprogressors . Proc Nat Acad Sci USA , 2000; 97: 2709-14. [ Links ]
46. Wang B, Spira TJ, Owen S, Lai RB, Saksena NK. HIV-1 strains from a cohort of American subjects reveal the presence of a V2 region extension unique to slow progressors and non-progressors. AIDS 2000; 14: 213-23. [ Links ]
47. Menzo S, Sampaolesi R, Vicenzi E, et al. Rare mutations in a domain crucial for V3-loop structure prevail in replicating HIV long-term non-progressors. AIDS 1998; 12: 985-97. [ Links ]
48. Catucci M, Venturi G, Romano L, Valensin PE, Zazzi M. Analysis of the HIV-1 nef gene in five intravenous drug users with long-term nonprogressive HIV-1 infection in Italy. J Med Virol 2000; 60: 294-9. [ Links ]
49. Villasís-Keever, A. Torres-Villalobos GM, Soto-Ramírez LE. Caracterización genotípica de los receptores de quimiocinas en individuos mexicanos con infección por VIH y progresión lenta de la enfermedad. XXIV Congreso Anual de la Asociación Mexicana de Infectología y Microbiología Clínica, Morelia, Mich. México 1999, Resumen E053. [ Links ]














