Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de investigación clínica
On-line version ISSN 2564-8896Print version ISSN 0034-8376
Rev. invest. clín. vol.56 n.1 Ciudad de México Feb. 2004
Rev Invest Clín 2004; Vol. 56(1):83-92
RINCÓN DEL RESIDENTE
La regulación del factor de transcripción NF-κB. Un mediador molecular en el proceso inflamatorio
Lucia Nikolaia López-Bojorquez
Departamento de Biología Celular Instituto de Fisiología Celular, UNAM. México, D.F.
Reimpresos:
Lucia Nikolaia-Bojorquez
Instituto de Fisiología Celular, UNAM.
Departamento de Biología Celular.
Circuito Exterior
04510, México, D.F.
Tel.: 5622-5609,
Fax: 5622 56 11
Correo electrónico: llopez@ifisiol.unam.mx
Recibido el 9 de enero de 2003.
Aceptado el 22 de agosto de 2003.
Los factores de transcripción son proteínas muy especializadas que reconocen secuencias específicas de DNA en la región reguladora de todos los genes. La unión de estos factores a esta región promotora regula, positiva o negativamente, la expresión y la subsecuente producción de la proteína codificada por el gene en cuestión. Hay muchos distintos tipos de factores transcripcionales, pero pueden dividirse entre constitutivos e inducibles. En términos generales los constitutivos son aquellos que regulan la expresión basal de los genes que codifican para todas las proteínas estructurales o de mantenimiento, es decir, las enzimas y los componentes proteicos presentes en todas las células y que son fundamentales para la función celular en general. Los factores de transcripción inducibles son aquellos que regulan la expresión de genes que solamente se utilizan en ciertos tipos celulares o en ciertos momentos de la vida de la célula. Recordemos que en una célula somática diferenciada se encuentra presente toda la información genética necesaria para formarse cualquier otro tipo celular. Esto quiere decir que en cada célula debe existir un programa de regulación de la expresión génica que se adapte a sus funciones particulares y su entorno. 1 Los factores de trascripción forman parte importante de este programa.
Hace casi veinte años fue descrito NF-κB como un factor nuclear capaz de unirse al enhancer κ (región reguladora) del promotor de la cadena pesada de los genes que codifican para inmunoglobulinas. 2 En un principio se creyó que este factor transcripcional era exclusivo de linfocitos B por haberse encontrado en el núcleo de este tipo celular. Sin embargo, ahora se sabe que se expresa de manera constitutiva en prácticamente las células del sistema inmune. A diferencia de otros factores de transcripción, que generalmente se encuentran en el núcleo, NF-κB se localiza de manera basal en el citoplasma en un estado inactivo y necesita un estímulo específico para traslocarse al compartimiento nuclear. Sólo en las células B y sus progenitoras se encuentra NF-κB constitutivamente en el núcleo.
El panorama actual muestra que este factor regula la transcripción de una gran variedad de genes, en particular aquellos involucrados en la respuesta inmune y control de la proliferación celular. NF-κB es un homo o heterodímero constituido por diferentes subunidades que han sido agrupadas dentro de la familia Rel.
LA FAMILIA REL
En esta familia de proteínas se agrupan genes que están altamente conservados a lo largo de la evolución de organismos multicelulares. En la mosca de la fruta Drosophila, se han descrito varias moléculas de la familia NF-κB: relish, dorsal y dif involucradas en la inmunomodulación. En mamíferos se han descrito las subunidades RelB, c-Rel, p65, p50 y p52. También se han encontrado homólogos en plantas e incluso en levaduras. 3
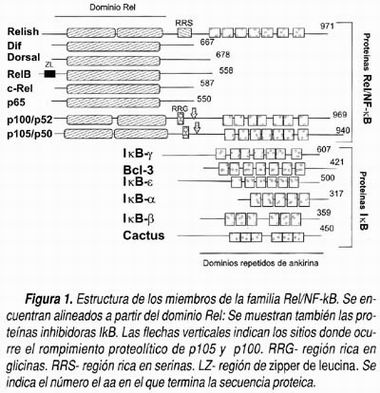
NF-κB funciona como un homo o heterodímero de miembros de la familia Rel. Cada proteína Rel tiene una región conservada de 300 aa en el N-terminal llamado dominio Rel (Figura 1) que es la responsable de la dimerización, la unión a DNA, y la interacción con las proteínas inhibidoras IκB. 4 El dímero más abundante y el primero que fue descrito es el formado por las subunidades p50 y p65. Es importante resaltar la existencia de diferentes subunidades de la familia Rel y el hecho de que éstos pueden formar heterodímeros tiene consecuencias fisiológicas importantes, ya que cada combinación de dímeros tiene distinto potencial transcripcional. Esto quiere decir que algunas combinaciones resultan en factores de transcripción más activos que otros o bien que se utilizan en distintos momentos de la respuesta inmune. Las combinaciones más comunes y con mayor actividad son p50:p65, p50:c-Rel, p50:p50 y p65:c-Rel. 5 La secuencia consenso de DNA a la que se unen todos los dímeros es 5' GGGRNNYYCC 3' (Donde N indica A , C o T; R es una purina y Y una pirimidina). 6 Los distintos dímeros tienen diferente especificidad por la secuencia consenso. 7 Toda esta complejidad quiere decir que en realidad cuando nos referimos al factor NF-κB en realidad se incluye a una familia de heterodímeros que producen efectos transcripcionales diferentes entre sí. Desentrañar esta complejidad es uno de los grandes interrogantes sobre esta familia de factores de transcripción y sobre la regulación molecular del sistema inmune en general.
¿Cómo se trasloca al núcleo NF-κB?
El factor NF-κB es secuestrado en el citoplasma de la célula como un precursor inactivo que forma un complejo con la proteína inhibidora IκB. La retención de NF-κB en el compartimiento citoplásmico y su eventual traslocación al núcleo es el resultado del ocultamiento o exposición de ciertas secuencias de aminoácidos denominados péptidos señal que determinan el destino nuclear de las proteínas que los presentan. La interacción con IκB oculta una de las dos secuencias que determinan el destino nuclear de NF-κB. Al estar en contacto con IκB no puede ser reconocido por la maquinaria molecular que transporta (trasloca) proteínas hacia el núcleo. Los pasos necesarios para la traslocación de NF-κB al núcleo incluyen: fosforilación, ubiquitinación y degradación en el proteosoma de la proteína inhibidora IκB para permitir entonces la traslocación de NF-κB al núcleo (Figura 2). Una vez en el núcleo, el factor se une a secuencias específicas en las regiones promotoras de los genes blanco y activa la transcripción.
¿Qué estímulos activan a NF-κB?
En prácticamente todos los organismos en los que ha sido caracterizado, NF-κB participa principalmente en la modulación de la respuesta inmune a distintos niveles. En Drosophila, por ejemplo, se ha encontrado que transcribe genes con actividad bactericida o fungicida. 8 En mamíferos tiene participación importante en la inflamación, la respuesta a estrés, la diferenciación y activación de células inmunes. La variedad de señales que pueden activar NF-κB es reflejo de la cantidad de eventos con que ha sido relacionado. Los mejor caracterizados son aquellos que involucran citocinas inflamatorias como Interleucina-1 beta (IL-1β) y factor de necrosis tumoral alfa (TNF-α), los estímulos mitogénicos como ésteres de forbol ( PMA ), los relacionados con agentes infecciosos como lipopolisacárido bacteriano ( LPS, un constituyente de la membrana externa de bacterias grammnegativas) y expresión de antígenos virales. Se ha descrito que también puede ser activado por eventos relacionados con daño celular como radiación ultravioleta (UV) o estrés oxidativo, 9 exposición a metales 10 y fenómenos particulares como el aumento de los niveles citoplásmicos de calcio. La activación de NF-κB es sensible en muchos casos al estado redox o a la sobreexpresión de enzimas antioxidantes, por lo tanto puede ser regulado por el estado de oxidorreducción general de la célula. 11
La transducción de las señales que activan a NF-κB
Las citocinas son hormonas peptídicas involucradas en distintos aspectos de la regulación del sistema inmune. Modulan diferenciación, activación, muerte y proliferación celular entre una gran variedad de eventos. Se unen a receptores muy específicos expuestos en la superficie de la célula blanco que generalmente presentan muy alta afinidad por la citocina ligando. A partir de este momento, la señal es llevada al núcleo celular mediante una cadena de proteínas cinasas (que catalizan la unión de fosfatos en otra proteínas) y que en su conjunto forman una cascada de señalización que termina generalmente en la activación de uno o varios factores de transcripción y la subsecuente expresión de genes.
En el caso de la activación de NF-κB mediada por IL-1-β y TNF-α la unión del ligando a sus receptores membranales, denominados IL-1R y TNFR1, respectivamente, activan una cascada de interacciones proteína-proteína. Por ejemplo, tras la unión de TNF-α a su receptor, distintas proteínas acopladoras (como TRADD, RIP, TRAF2) a este complejo puede asociarse también a la proteína cinasa NIK. A nivel de la proteína cinasa TRAF2 ocurre una bifurcación de la vía y pueden activarse otras cascadas de transducción a través de las proteínas JNK/SAPK (Cuadro 1). La cinasa NIK (por sus siglas en inglés, NF-κB inducible kinase ) 12 es el primer componente de la vía inducida por TNFκ que está encaminada exclusivamente a la activación de NF-αB.
La vía activada por IL-1-β tiene muchos puntos en común con la de TNF-α, la unión de IL-1β media la agregación de su receptor con distintas proteínas acopladoras accesorias (IL-1R, IL-1RacP, IRAK, TRAF6) . 13
También estímulos infecciosos como LPS, inducen la activación de NF-κB. De hecho la activación del sistema de monocitos/macrófagos depende del reconocimiento de estas células a antígenos específicos. El LPS activa a los macrófagos a través de una vía que culmina en la traslocación de NF-κB. Prácticamente todos los productos proinflamatorios que los macrófagos secretan son regulados por este factor. De hecho, no sólo las bacterias grammnegativas y, por lo tanto, no sólo el LPS activan macrófagos. 14
La presencia de otros antígenos bacterianos como peptidoglicanos solubles (sPGN) o ácido lipoteicoico (LTA) también inducen la traslocación de NF-κB a través del receptor membranal TRL2. 15 Este receptor y por lo tanto el factor de transcripción están involucrados en el reconocimiento del sistema mieloide a lipoproteínas y glicolípidos presentes en mycoplasmas, y bacterias tanto grampositivas como gramnegativas. Media la respuesta a lipoproteínas derivadas de organismos como M. tuberculosis, Borrelia burgdorfei, Trepomena pallidium y Micoplasma fermentans 16 y de lipopolisacáridos derivados del patógeno Leptorspira interrogants. 17 En cultivos celulares de macrófagos es el responsable de la respuesta por bacterias en suspensión ( S. aureus y B. subtilis ).
La participación de NF-κB resulta entonces fundamental para la expresión de genes que responden a estímulos infecciosos. Prácticamente todos los miembros de la familia de receptores Toll like (TLR) que reconocen una gran variedad de antígenos infecciosos, convergen en algún momento en la traslocación de NF-κB. El LPS se une específicamente a su receptor TLR4, induciendo con esto NF-κB y activación mieloide La activación del sistema de monocitos/macrófagos ocurre por moléculas como proteoglicanos, zimosan lipoproteínas, taxol, ácido lipoeitoico, todos ellos antígenos bacterianos que se unen a distintos miembros de la familia de receptores TLR. 15,16,18
Por otro lado, el tratamiento con peróxido de hidrógeno (H 2 O 2 ) induce traslocación de NF-κB por ejemplo, y el tratamiento con agentes antioxidantes puede bloquear la fosforilación de IκB. La vía (o las vías de señales) que controla estos mecanismos no está caracterizada hasta el momento. NF-κB parece prácticamente el único factor de transcripción en mamíferos que puede responder al estado redox de la célula. 6
La variedad de estímulos que activan NF-κB sugiere que muchas vías de transducción están involucradas en su traslocación, sin embargo, no queda claro si todas ellas convergen en un intermediario común o si la fosforilación de IκB puede proceder de distintos estímulos. 19 Lo que es claro es que la fosforilación de IκB es el evento que dispara la traslocación y por tanto la regulación de la proteína cinasa que fosforila IκB es actualmente el centro de atención en la activación de NF-κB. 20 . Por ejemplo, dos estímulos distintos que activan NF-κB, como IL-1β y TNF-α activan vías de transducción que convergen en la cinasa TAK1. 21 Esta cinasa directamente regula a la cinasa de IκB, entonces ¿qué distingue un estímulo del otro?, ¿son diferentes las formas de NF-κB activadas?, ¿por qué las respuestas celulares a IL-1β y TNFα son similares, pero no idénticos? Seguramente cada tipo celular tiene una organización distinta de la vía de transducción de señales que regulan en casos específicos la activación del factor.
El hecho de que existan distintos homo o heterodímeros cada uno con un potencial transactivador particular y que sea tal la variedad de vías de transducción de señales que pueden inducir la traslocación al núcleo de NF-κB puede sugerir que para cada tipo de estímulo corresponde una combinación particular de isoformas de NF-κB.
Lo que nos dice el uso in vitro de fármacos inhibidores
Las primeras evidencias que se tuvieron acerca de la regulación de NF-κB provienen del uso in vitro de agentes inhibidores que interfieren en alguno de los distintos eventos necesarios para la traslocación del factor. La regulación de la activación de NF-κB es un fenómeno cuya complejidad queda revelada al poder bloquear de manera diferencial eventos tan distintos como fosforilación, degradación de proteínas, estrés oxidativo o transducción de señales 22 utilizando fármacos específicos.
La degradación de IκB ocurre en los complejos proteicos multicatalíticos dependientes de ATP que forman parte de una estructura celular denominada proteosoma y que se encarga de degradar las proteínas celulares de manera regulada. El uso de inhibidores del proteosoma como calpaína, PSI o MG-123 o de inhibidores de proteasas como TPCK y TLCK, inhibe la degradación de IκB y permite la acumulación en el citoplasma de su estado fosforilado. 23,24
Con la utilización de agentes reductores como salicilatos, PDTC y agentes alquilantes, 25 puede bloquearse in vitro la fosforilación de IκB. Además, la sobreexpresión de la enzima glutatión peroxidasa (una enzima antioxidante) tiene un efecto inhibitorio sobre la fosforilación de IκB y la subsecuente activación de NF-κB 26 . Sin embargo, la sobreexpresión de la enzima superóxido dismutasa (SOD) que aumenta la producción de H 2 O 2 , es capaz de potenciar la activación de NF-κB.
Entre los fármacos que pueden inhibir la activación de NF-κB (por distintos mecanismos) están los antiinflamatorios e inmunosupresores como los glucocorticoides, que en algunos tipos celulares pueden inhibir la transcripción de IκB. La ciclosporina A y la rapamicina, ambos inmunosupresores, inhiben la activación de NF-κB en células T. También drogas que han sido ensayadas por su actividad antitumoral como la daunorrubicina, pueden activar NF-κB.
¿Cuál es la enzima que fosforila a IκB?
Se sabe que pese a ser la señal inicial, la fosforilación de IκB no es suficiente para la traslocación de NF-κB, sino el marcador para su posterior degradación. 27,28
La identificación de la cinasa responsable de la fosforilación de IκB resultó un problema durante mucho tiempo. Nunca se pudo obtener por mutagénesis en Drosophila, donde se han aislado muchos de los homólogos de la vía de transducción de señales de IL-1, incluyendo las proteínas dorsal y cactus (homólogos de NF-κB e IκB). Posiblemente esto refleja que la falta de la cinasa de IκB resulta letal para el organismo. 29
Analizando mutantes de la proteína inhibitoria IκB en las que artificialmente se habían cambiado distintos aminoácidos (mutagénesis dirigida), pudieron identificarse los residuos serina 32 y serina 36 (S32 y S36) como los aceptores de la fosforilación que sirve como señal de degradación Los análisis bioquímicos de mutaciones puntuales sobre IκB demostraron muy pronto que la cinasa en cuestión debía ser específica para residuos de serina, ya que la sustitución por otros aminoácidos como alaninas o por treoninas disminuía notablemente su degradación. 30
Otra proteína miembro de la familia IκB, IκB-α es fosforilada en los sitios homólogos de ser19 y ser23, y de hecho todas las proteínas IκB, incluyendo a cactus de Drosophila son fosforiladas residuos de serina localizados en regiones homólogas del C-terminal y en la misma secuencia consenso DSGXXS. 30
La identificación de la cinasa responsable de la fosforilación de IκB comenzó a seguir un camino concreto, cuando a partir de células HeLa se purificó un complejo multiproteico con un peso molecular de aproximadamente 700 kDa que específicamente fosforila a IκB-α en los residuos S32 y S36. ADDIN ENRfu. 31 A partir de purificaciones bioquímicas de este complejo, se identificaron los dos polipéptidos que específicamente fosforilan IκB en los residuos S32 y S36 con pesos moleculares de 87 y 85 kDa. El gene que codifica para el polipéptido de 85 kDa fue secuenciado con oligonucleótidos diseñados a partir de la secuencia de aminoácidos de la proteína purificada y fue identificado como una cinasa clonada previamente llamada CHUK. Tras comparar la secuencia de DNA de los genes que codifican para ambos polipéptidos se encontró que ambos comparten similitud de 52%, e interactúan con las otras proteínas del complejo de un dominio de zipper de leucina. A este complejo multiproteico se le llamó IKK ( por IκB Kinase ) y a los polipéptidos con pesos de 85 y 87 κDa, respectivamente, se les llamó IKK-α y IKK-β. Casi al mismo tiempo, pero utilizando el sistema de dobles híbridos en levadura se identificó el polipéptido p85 (IKKα) asociado a la cinasa NIK, corroborando que ésta era la cinasa de IβB.
Recientemente se ha sugerido que la regulación fina de las distintas señales que convergen en la vía de NF-κB se encuentra al nivel de este complejo multiproteico responsable de la fosforilación de la proteína inhibidora IκB. Este complejo está compuesto entonces por dos subunidades cataléticas, las proteínas cinasas IKKα y IKKβ. Se ha identificado a la proteína IKKα como una subunidad regulatoria del complejo, y a la proteína E3 ligasa como parte del aparato que permitirá el reconocimiento de IκB en el proteosoma donde será finalmente degradada. Algunos autores han denominado este complejo como signalosoma de IKK. 32
Actualmente la cinasa IKK ha sido estudiada in extenso , sin embargo, su participación particular en eventos patológicos no se conoce del todo.
La regulación de IκB
La familia Rel incluye también las proteínas inhibidoras que secuestran en el citoplasma a NF-κB (las proteínas inhibidoras IκB). De éstas se han descrito al menos seis miembros: IκB-α IκB-β IκB-ε IκB-γ, Bcl-3 y cactus de Drosophila . Todas ellas siguen básicamente la misma vía de fosforilación-ubiquitinación-degradación. Todas también presentan dominios conservados de ankirina que son regiones que sirven para mediar interacciones proteína-proteína, el C-terminal donde se fosforilan para ser degradadas (léase ser 32 y 36) y el dominio PEST en el N-terminal, en donde ocurre la fosforilación que regula el recambio y la homeostasis de esta proteína. Diferentes isoformas de IκB secuestran distintos heterodímeros de NF-κB, por ejemplo, IκB-α e IκB-β interactúan preferencialmente con p50:p65 y p50:c-Rel mientras que IκB-ε captura a p65 y c-Rel homo y heterodímero, por su parte Bcl-3 secuestra los homodímeros p50 y p52. 33 Se ha propuesto que para las distintas isoformas de IκB existen distintas formas de regulación, pero la cuestión no es muy clara hasta el momento. Las más estudiadas son IκB-α e IκB-β, ambas se fosforilan en residuos de serina en posiciones homólogas sin que sea claro si son sustrato de distintas cinasas. Se han encontrado diferencias en las cinéticas de degradación de ambas proteínas en células sometidas a distintos estímulos; una clase de inductores (entre ellos el TNF-α) afectan de manera transitoria a IκB-α, mientras que otro tipo de estímulos (como IL-β) induce una activación más prolongada de IκB-α e IκB-β. La cinética de la degradación de IκB-α parece ser más rápida que la de IκB-β. 34
La ubiquitinación y degradación
La vía proteolítica que involucra la ubiquitinación y degradación proteolítica por el proteosoma ha sido caracterizada como parte de los mecanismos celulares para degradar selectivamente moléculas proteicas. Algunos factores de transcripción, receptores y moléculas de superficie y otras entidades proteicas que tienen un ciclo de vida controlado o que deben desaparecer en momentos particulares de la vida de la célula. Tal es el caso de IκB que debe ser degradado para permitir la traslocación de NF-κB al núcleo. Estas degradaciones específicas involucran dos pasos: la señalización o marcaje de la molécula a degradar mediante unión covalente de moléculas de ubiquitina y la degradación de las proteínas que lleva a la liberación y reutilización de la ubiquitina. Esta vía involucra las enzimas conjugadoras de ubiquitina E2, E1 y E3 y la degradación por parte de complejos multicataléticos dependientes de ATP en el proteosoma, donde distintas enzimas como la proteasa S20 y la proteasa S26 degradan proteínas marcadas específicamente. 35
En IκB, como en la mayoría de las proteínas destinadas a ser degradadas, la ubiquitinación ocurre en residuos de lisina, que en el caso de IκB-α ocurre en las lisinas 21, 22 y 23. 36 Por mutagénesis dirigida se ha encontrado que la falta de estos dominios interfiere con la degradación de IκB, mas no con su fosforilación. Debido a que la degradación de IκB ocurre antes de su disociación de NF-κB, la señal de ubiquitinación permite una degradación específica por parte del proteosoma. Estos experimentos demostraron que si bien la fosforilación es un paso necesario en la activación de NF-κB la traslocación al núcleo no ocurre sino hasta después de que IκB es degradado.
Los fenómenos regulados por NF-κB
Los genes activados por NF-κB incluyen los que codifican los mismos factores responsables de su activación, es decir, que activa la transcripción de los genes que codifican para citocinas como IL-1β y TNF-α. También participa en la producción de otras citocinas inflamatorias como interferón gama (IFN-γ), IL-6 y algunas como linfotoxina, IL-2, e IL-8. NF-κB también activa la transcripción de moléculas de adhesión como I-CAM, Selectina-E, V-CAM y participa en su propia regulación al inducir los genes de proteínas de la familia Rel como c-Rel y p105. La secuencia de DNA a la que se une el factor NF-κB (sitio κB) se encuentra en el promotor de genes involucrados en inflamación y actividad cardiovascular como la sintasa de óxido nítrico (NOS) el angiotensinógeno y el receptor a tromboxanos.
NF-κB participa de manera importante en el desarrollo del sistema inmune, aunque los resultados obtenidos con ratones deficientes ( knockouts modificados genéticamente) no dejan claro el mecanismo exacto. Por ejemplo, la falta de p65 provoca muerte en el día 16 de gestación, en cambio el knockout de p50 permiten un desarrollo normal salvo por el hecho de que las células B de estos animales no pueden responder a estímulos mitogénicos o a LPS. El knockout de RelB ocasiona muerte por inflamación de múltiples órganos. También se han hecho estos estudios con las proteínas inhibidoras donde el de efectos más dramáticos parece ser el de la falta de IκB-α que ocasiona atrofia de timo, bazo y defectos en la piel. 5
La variedad de genes y de eventos celulares que son regulados por NF-κB sugiere que la regulación de su estado activado debe incluir distintos niveles, seguramente la presencia por sí sola de un sitio κB en el promotor de un gene no determina su actividad transcripcional, sino que debe interactuar con otros factores de transcripción.
¿Qué efecto tienen los genes que regula NF-κB sobre su propia actividad?
NF-κB es una proteína encargada de regular la transcripción de distintos genes que están involucrados a su vez en una gran variedad de procesos. Su regulación se encuentra bajo estricto control. Por un lado la proteína que directamente lo inhibe manteniéndolo en el citoplasma (IκB), esté regulada transcripcionalmente por NF-κB. 21 Además, una vez en el núcleo, NF-κB se degrada rápidamente de manera que la activación de NF-κB tiene un pico de actividad muy corto (alrededor de 30 minutos). En algunas células se ha observado un segundo pico que se cree tiene que ver con la degradación de otra isoforma de IκB.
Muchos de los genes que activa NF-κB tienen un efecto regulatorio sobre sí mismos (en algunos casos este efecto se traduce en una amplificación de la señal) por ejemplo, los genes de TNF-α, IL-1, del receptor de IL-2 son activados por NF-κB. También los genes de otros factores de transcripción tienen en sus promotores sitios κB.
Posiblemente relacionado con el hecho de que algunos de los eventos que regula NF-κB tengan carácter transitorio, es que muchos de los genes que transcribe sean miembros de la familia Rel (p105, c-Rel, IκB). Donde estas proteínas pueden tener efectos antagónicos entre sí, es decir, inducir la transcripción de IκB bloquea la actividad de NF-κB mientras que inducir la transcripción de c-Rel puede tener un efecto sinérgico sobre ésta. 5 Todos estos mecanismos aseguran que las señales de amplificación tendrían un efecto local o un tiempo de acción más bien corto.
De p100 y p105
Cuando se clonó el gene que codifica para la subunidad p50, se encontró que codificaba para una proteína mucho más grande, de 105 kDa, donde el extremo N-terminal era idéntico a p50. El C-terminal de esta molécula reveló que contenía los dominios de ankirina repetidos, iguales a los encontrados en la proteína IκB. Después se demostró que p50 y p52 provenían de la degradación postranscripcional de p105 y p100, respectivamente, realizada en el C-terminal, y que esta degradación ocurría de manera muy similar a la degradación de IκB: requiere fosforilación, ubiquitinación y degradación proteosomal. 36 Esto puede entenderse más fácilmente si se observa la figura 1, en la que se muestra la estructura de p100 y de 105 indicando el dominio Rel, en el que se encuentra la parte de la proteína que funciona como factor de trascripción y dentro de la misma molécula, las secuencias de ankirina, que se encargan de ocultar el dominio Rel para que la proteína permanezca dentro del citoplasma, es decir, factor e inhibidor como parte de la misma molécula. De manera que para traslocar al núcleo a NF-κB puede degradarse IκB o el C-terminal de p105 y de p100. Es curioso que este último mecanismo sea el que conservan las subunidades con actividad transcripcional negativa. Sin embargo, p50 también puede generarse por proteólisis de p100 independiente de estímulo, manteniendo así la población de dímeros de p50 con actividad transcripcional positiva. 5
EL PAPEL CLAVE DE NF-κB EN ENFERMEDADES INFECCIOSAS E INFLAMATORIAS
La vía de activación de NF-κB por estímulos inflamatorios se ha caracterizado en detalle. La lista de enfermedades inflamatorias en las que ha sido involucrado es larga: artritis reumatoide, arteriosclerosis, esclerosis múltiple, asma, gastritis asociada a Helicobacter pylori, polirradiculoneuritis desmielinizante, choque séptico, etc.
En los últimos años se ha estudiado mucho la relación de este factor con una gran cantidad de estados patológicos, muchos de ellos desórdenes inmunes, como artritis reumatoide, cáncer, asma, arterioesclerosis, infección de VIH. 37,38 Una gran variedad de genes involucrados en adhesión celular, diapédesis, trombosis, activados por NF-κB han sido caracterizados.
Por ejemplo, in vivo se ha demostrado que NF-κB induce la expresión de moléculas de adhesión como Selectina-E, I-CAM, V-CAM y que la inhibición de estos genes reduce la migración de linfocitos y la transmigración celular. La unión primaria de las bacterias a los epitelios cercanos al sitio de infección se ve facilitada por la expresión de ICAM-1 mediada por NF-κB. La expresión de los genes que codifican para moléculas de superficie en las células endoteliales, en particular moléculas de adhesión resulta de vital importancia para el reclutamiento de células del sistema inmune durante el proceso de inflamación, sin embargo cuando este proceso ocurre a nivel sistémico, es decir, cuando ocurre en grandes porciones de la red vascular, comienza una serie de alteraciones en el flujo sanguíneo que conllevan entrada masiva de líquido y de células en los tejidos. 39 En el epitelio alveolar expuesto a agentes irritantes se expresan moléculas de adhesión como ICAM-1, 40,41 donde NF-κB y el factor de transcripción AP-1 participan. También en la expresión de la glicoproteína factor tisular (TF) en células de hígado, pulmón e intestino delgado, donde el inicio de cascada de coagulación contribuye a la patofisiología del trauma severo.
Durante eventos infecciosos los epitelios producen también quimiocinas, quiomioatractores celulares que facilitan la infiltración celular. La producción de estas quimiocinas (como MIP-1, IL-8, Rantes) también está regulada por NF-κB. 42
También participa en la expresión de proteínas de fase aguda que se secretan en el hígado en respuesta a IL-6 producido por las células de Kupffer. Esta batería de proteínas circulantes producidas por hepatocitos tiene como consecuencia niveles elevados en sangre de fibrinógeno además de amiloide sérico A, β-fibrinógeno, metalotioneína-1, α1-antiquimiotripsina, α-2-macroglobulina, haptoglobina, hemopexina y otras proteínas involucradas en el transporte, la coagulación y la remodelación tisular. 43
Juega también un papel importante en la desregulación del tono vascular e hipotensión que se observa durante el choque séptico, fundamentalmente a partir de la expresión de dos enzimas: la sintasa de óxido nítrico (NOS) y la ciclooxigenasa 2 (Cox-2). La primera cataliza la formación de óxido nítrico, un potente agente vasodilatador que difunde del endotelio a la capa de músculo liso de toda la vasculatura. La segunda participa en la producción de prostaglandina 2-E. La enzima NOS endotelial se expresa en respuesta a la activación de NF-κB que ocurre por citocinas inflamatorias. Se sabe que el gene Cox-2 presenta en su región reguladora dos regiones de unión para el factor de transcripción NF-κB y puede ser inhibida por agentes antioxidantes. 44 Muy poco se conoce acerca del mecanismo de acción de la prostaglandina 2E como agente vasodilatador. Los inhibidores de la Cox-2 y de la NOS que bloquean la vía de transducción de NF-βB, incrementan la respuesta contráctil en pacientes con choque séptico, y los estudios in vitro sugieren que la sobreproducción de prostanoides contribuye a contrarrestar la reactividad de agentes vasoconstrictores como norepinefrina. 45
En los últimos años ha crecido el campo de la exploración de fármacos antiiflamatorios cuyo blanco de acción resulta algún componente de la vía IκB/NFκB.
Así, la importancia de NF-κB como blanco terapéutico ha cobrado suma importancia con el advenimiento de nuevas drogas antiinflamatorias no esteroideas, muchas de las cuales hacen blanco directo en la actividad de dicho factor. 46 Específicamente sustancias como sulfazalazina, ácido acetilsalicílico, leflumonida, etc. son capaces de inhibir la traslocación al núcleo de NF-κB tanto in vivo, como in vitro. Aunque muchas de estas drogas son específicas, requieren niveles relativamente altos para arrojar resultados in vivo, por lo tanto, resultan un campo importante de experimentación. 47
Como parte de las aproximaciones terapéuticas para el tratamiento del choque séptico también se han utilizado fármacos inhibidores de la activación de NF-κB. 47,48 En este caso, la secuencia de tratamientos recomendada clínicamente consiste en aplicar en el siguiente orden, agentes antibióticos y estimuladores del sistema inmune, inhibidores de LPS, inhibidores de la coagulación, antioxidantes, antagonistas de citocinas y citocinas antiinflamatorias, muchos de ellos involucrados con la vía de activación de NF-κB a distintos niveles. En ocasiones el efecto combinado de todos estos agentes puede aumentar las oportunidades de sobrevivencia. 49
En suma, la activación de grupos específicos de genes en respuesta a inductores dados comienza con la activación de una o más vías de transducción de señales que convergen en la fosforilación de la proteína IκB permitiendo su degradación y la traslocación de NF-κB al núcleo. 38 El gene blanco es seleccionado por las secuencias κB presentes en su región reguladora y la presencia de otros factores de transcripción permiten entonces a NF-κB activar la transcripción genética. Una variedad de detalles están presentes en la regulación de cada uno de estos pasos y de su comprensión puede devenir un mejor entendimiento del sistema inmune y su regulación.
REFERENCIAS
1. Sen CK, Packer L. Antioxidant and redox regulation of gene transcription. Faseb J 1996; 10(7): 709-20. [ Links ]
2. Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein Nf-kappa B by a posttranslational mechanism. Cell 1986; 47(6): 921-8. [ Links ]
3. Friedrich L, et al. NIM1 overexpression in arabidopsis potentiates plant disease resistance and results in enhanced effectiveness of fungicides. Mol Plant Microbe Interact 2001; 14(9): 1114-24. [ Links ]
4. Muller CW, et al. Structure of the NF-kappa B p50 homodimer bound to DNA. Nature 1995; 373(6512): 311-7. [ Links ]
5. Ghosh S, May MJ, Kopp EB. NF-kappa B and Rel proteins: evolutionarily conserved mediators of immune responses. Annu Rev Immunol 1998; 16: 225-60. [ Links ]
6. Baldwin AS Jr. The NF-kappa B and I kappa B proteins: new discoveries and insights. Annu Rev Immunol 1996; 14: 649-83. [ Links ]
7. Kunsch C, Ruben SM, Rosen CA. Selection of optimal kappa B/Rel DNA-binding motifs: interaction of both subunits of NF-kappa B with DNA is required for transcriptional activation. Mol Cell Biol 1992; 12(10): 4412-21. [ Links ]
8. Gonzalez-Crespo S, Levine M. Related target enhancers for dorsal and NF-kappa B signaling pathways. Science 1994; 264(5156): 255-8. [ Links ]
9. Schmidt KN, et al. The roles of hydrogen peroxide and superoxide as messengers in the activation of transcription factor NF-kappa B. Chem Biol 1995; 2(1): 13-22. [ Links ]
10. Goebeler M, et al. Activation of nuclear factor-kappa B and gene expression in human endothelial cells by the common haptens nickel and cobalt. J Immunol 1995; 155(5): 2459-67. [ Links ]
11. Li N, Karin M. Is NF-kappaB the sensor of oxidative stress? Faseb J 1999; 13(10): 1137-43. [ Links ]
12. Cao Y, et al. IKKalpha provides an essential link between RANK signaling and cyclin D1 expression during mammary gland development. Cell 2001; 107(6): 763-75. [ Links ]
13. Woronicz JD, et al. Ikappa B kinase-beta: NF-kappaB activation and complex formation with IkappaB kinase-alpha and NIK. Science 1997; 278(5339): 866-9. [ Links ]
14. Zhang G, Ghosh S. Toll-like receptor-mediated NF-kappaB activation: a phylogenetically conserved paradigm in innate immunity. J Clin Invest 2001; 107(1): 13-9. [ Links ]
15. Bochud PY, Hawn TR, Aderem A. Cutting edge: a toll-like receptor 2 polymorphism that is associated with lepromatous leprosy is unable to mediate mycobacterial signaling. J Immunol 2003; 170(7): 3451-4. [ Links ]
16. Takeuchi O, Akira S. Toll-like receptors; their physiological role and signal transduction system. Int Immunopharmacol 2001; 1(4): 625-35. [ Links ]
17. Werts C, et al. Leptospiral lipopolysaccharide activates cells through a TLR2-dependent mechanism. Nat Immunol 2001; 2(4): 346-52. [ Links ]
18. Guha M, et al. Lipopolysaccharide activation of the MEK-ERK1/2 pathway in human monocytic cells mediates tissue factor and tumor necrosis factor alpha expression by inducing Elk-1 phosphorylation and Egr-1 expression. Blood 2001; 98(5): 1429-39. [ Links ]
19. de Martin R, et al. Cytokine-inducible expression in endothelial cells of an I kappa B alpha-like gene is regulated by NF kappa B. Embo J 1993; 12(7): 2773-9. [ Links ]
20. Verma IM, Stevenson J. IkappaB kinase: beginning, not the end . Proc Natl Acad Sci USA 1997; 94(22): 11758-60. [ Links ]
21. Dixit V, Mak TW. NF-kappaB signaling. Many roads lead to Madrid. Cell 2002; 111(5): 615-9. [ Links ]
22. Kretz-Remy C, et al. Inhibition of I kappa B-alpha phosphorylation and degradation and subsequent NF-kappa B activation by glutathione peroxidase overexpression. J Cell Biol 1996; 133(5): 1083-93. [ Links ]
23. Finco TS, Beg AA, Baldwin AS Jr. Inducible phosphorylation of I kappa B alpha is not sufficient for its dissociation from NF-kappa B and is inhibited by protease inhibitors. Proc Natl Acad Sci USA 1994; 91(25): 11884-8. [ Links ]
24. Miyamoto S, et al. Tumor necrosis factor alpha-induced phosphorylation of I kappa B alpha is a signal for its degradation but not dissociation from NF-kappa B. PROC NATL ACAD SCI USA 1994; 91(26): 12740-4. [ Links ]
25. Thanos D, Maniatis T. NF-kappa B: a lesson in family values. Cell 1995; 80(4): 529-32. [ Links ]
26. Toledano MB, et al. N-terminal DNA-binding domains contribute to differential DNA-binding specificities of NF-kappa B p50 and p65. Mol Cell Biol 1993; 13(2): 852-60. [ Links ]
27. Traenckner EB, et al. Phosphorylation of human I kappa B-alpha on serines 32 and 36 controls I kappa B-alpha proteolysis and NF-kappa B activation in response to diverse stimuli. Embo J 1995; 14(12): 2876-83. [ Links ]
28. Ling L, Cao Z, Goeddel DV. NF-kappaB-inducing kinase activates IKK-alpha by phosphorylation of Ser- 176. Proc Natl Acad Sci USA 1998; 95(7): 3792-7. [ Links ]
29. Kopp EB, Ghosh S. NF-kappa B and rel proteins in innate immunity. Adv Immunol 1995; 58: 1-27. [ Links ]
30. Baeuerle PA, Baltimore D. NF-kappa B: ten years after. Cell 1996; 87(1): 13-20. [ Links ]
31. DiDonato JA, et al. A cytokine-responsive IkappaB kinase that activates the transcription factor NF-kappaB. Nature 1997; 388(6642): 548-54. [ Links ]
32. Mercurio F, Manning AM. Multiple signals converging on NF-kappaB. Curr Opin Cell Biol 1999; 11(2): 226-32. [ Links ]
33. Karin M. The beginning of the end: IkappaB kinase (IKK) and NF-kappaB activation. J Biol Chem 1999; 274(39): 27339-42. [ Links ]
34. Sun Z, Andersson R. NF-kappaB activation and inhibition: a review. Shock (Augusta, Ga.), 2002; 18(2): 99-106. [ Links ]
35. Ciechanover A, et al. The ubiquitin-mediated proteolytic system: involvement of molecular chaperones, degradation of oncoproteins, and activation of transcriptional regulators. Cold Spring Harb Symp Quant Biol 1995; 60: p. 491-501. [ Links ]
36. Orian A, et al. Structural motifs involved in ubiquitin-mediated processing of the NF- kappaB precursor p105: roles of the glycine-rich region and a downstream ubiquitination domain. Mol Cell Biol 1999; 19(5): 3664-73. [ Links ]
37. Yamamoto Y, Gaynor RB. Therapeutic potential of inhibition of the NF-kappaB pathway in the treatment of inflammation and cancer. J Clin Invest 2001; 107(2): 135-42. [ Links ]
38. Baldwin AS, Jr. Series introduction: the transcription factor NF-kappaB and human disease. J Clin Invest 2001; 107(1): 3-6. [ Links ]
39. McCaffree DR, et al. Role of pulmonary edema in the acute pulmonary response to sepsis. J Appl Physiol 1981; 50(6): 1198-205. [ Links ]
40. Parikh AA, et al. IL-1beta induction of NF-kappaB activation in human intestinal epithelial cells is independent of oxyradical signaling. Shock 2000; 13(1): 8-13. [ Links ]
41. Armstead WM. Role of endothelin-1 in age-dependent cerebrovascular hypotensive responses after brain injury. Am J Physiol 1999; 277(5 Pt 2): H1884-94. [ Links ]
42. Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest 2001; 107(1): 7-11. [ Links ]
43. Derfalvi B, et al. Interleukin-6-induced production of type II acute phase proteins and expression of junB gene are downregulated by human recombinant growth hormone in vitro. Cell Biol Int 2000; 24(2): 109-14. [ Links ]
44. Liu SF, Ye X, Malik AB. Inhibition of NF-kappaB activation by pyrrolidine dithiocarbamate prevents In vivo expression of proinflammatory genes. Circulation 1999; 100(12): 1330-7. [ Links ]
45. Taddei S, et al. Vasodilation to bradykinin is mediated by an ouabain-sensitive pathway as a compensatory mechanism for impaired nitric oxide availability in essential hypertensive patients. Circulation 1999; 100(13): 1400-5. [ Links ]
46. Riedemann NC, Guo RF, Ward PA. Novel strategies for the treatment of sepsis. Nat Med 2003; 9(5): 517-24. [ Links ]
47. Sharma VK, Dellinger RP. Recent developments in the treatment of sepsis. Expert Opin Investig Drugs 2003; 12(2): 139-52. [ Links ]
48. Hotchkiss RS, Karl IE. The pathophysiology and treatment of sepsis. N Engl J Med 2003; 348(2): 138-50. [ Links ]
49. Cross AS, Opal SM. A new paradigm for the treatment of sepsis: is it time to consider combination therapy? Ann Intern Med 2003; 138(6): 502-5. [ Links ]