Introducción
El endotelio pulmonar es un componente importante de la unidad alveolocapilar. Está implicado en el mantenimiento de la homeostasis de los vasos sanguíneos, donde se sintetizan sustancias biológicamente activas que regulan el tono vasomotor como el óxido nítrico (ON) y la endotelina (ET-1), las cuales modulan las interacciones célula-célula (neutrófilos-endotelio), previenen trombosis y promueven la proliferación celular.1 En el síndrome de insuficiencia respiratoria aguda (SIRA) disminuye la producción de ON, por lo que el endotelio pierde su capacidad antiagregante plaquetaria, anticoagulante y fibrinolítica, y pasa de tener efectos vasodilatadores a causar vasoconstricción, adhesión celular, inflamación, edema, hipertensión pulmonar y trombosis.2,3 El sustrato para la síntesis de ON es la L-arginina (2-amino-5-guanidino ácido pentanoico) un aminoácido (aa) no esencial bajo condiciones fisiológicas, pero que se convierte en un aa condicionalmente esencial bajo estrés, y desempeña un papel importante en el metabolismo intermediario y en la disponibilidad de arginina en el paciente crítico.4-6 Aunado a esto, la disminución en la producción de vasodilatadores propicia la sobreexpresión de ET-1,7 la cual a través del receptor tipo B (ETB), provoca la infiltración de neutrófilos en la circulación y aumento en la permeabilidad vascular alveolar.8 Los receptores ETB se encuentran en las células endoteliales9 y median la vasodilatación a través de la liberación de ON y prostaciclina. Este subtipo de receptor también es responsable de la depuración de ET-1 circulante a través de endocitosis.
A pesar de que los efectos benéficos de la L-arginina, principalmente efectos antiinflamatorios y en el tono vasomotor, han sido descritos desde hace varias décadas, actualmente continúa un creciente interés en los posibles efectos terapéuticos de su suplementación, en particular en enfermedades con trastornos endoteliales, como los observados en SIRA provocado por coronavirus 2 (SARS-CoV-2), debido a que la síntesis alterada de ON se considera una característica de un endotelio disfuncional.2,10
Por lo que este estudio es el primero en plantear la hipótesis de que debido a que los niveles de ET-1 están regulados por la síntesis de ON, y puesto que la administración de L-arginina puede influir en la liberación de ET-1, conduciría a su vez a la prevención o atenuación de daño endotelial en SIRA inducido por ácido oleico (AO). Por ende, teniendo en cuenta las múltiples funciones de la ET-1, en este estudio se analizan los cambios en hemodinamia, gasometría, cambios microscópicos, detección inmunohistoquímica de la expresión de ET-1, ETB y en la concentración plasmática de ET-1 en un modelo experimental de SIRA en perros inducido por AO.
Para estudiar este efecto se utilizó el modelo de AO debido a que está bien caracterizado y reproduce las lesiones patológicas de la fase inicial del SIRA originadas por alteración en la integridad de la membrana alveolar-capilar presentes en humanos.11-13
Material y métodos
Este estudio se realizó en el Departamento de Cirugía Experimental del Instituto Nacional de Enfermedades Respiratorias (INER) Ismael Cosío Villegas. Se utilizaron 18 perros mestizos adultos sanos, con un peso entre 18 y 20 kg. Se decidió utilizar como modelo animal al perro porque su hilio pulmonar es largo y de fácil acceso; mientras que en cerdos y ovejas el sistema digestivo tiene un mayor desarrollo y esto puede causar diferencias hemodinámicas significativas. Todos los animales fueron tratados de acuerdo con las especificaciones técnicas para el Cuidado y Uso de Animales de Laboratorio de la Norma Oficial Mexicana NOM-062-ZOO-199914 y la Guía para el Cuidado y Uso de Animales de Laboratorio de los Estados Unidos de América.15 Antes del experimento, los animales fueron confinados en jaulas individuales (1.0 m de ancho × 3.5 m de largo × 2.7 m de alto)14 con las mismas condiciones ambientales, con agua y comida ad libitum. Este protocolo fue revisado y aprobado por el Comité de Bioética del INER (número de protocolo: B12-06). El tamaño de la muestra se redujo de acuerdo con los principios de las técnicas experimentales propuestas por Balls16 y Kilkenny.17
Para su estudio, los animales fueron divididos en tres grupos: grupo I (n = 6): control sin SIRA; grupo II (n = 6): SIRA inducido por AO; y grupo III (n = 6): SIRA inducido por AO con administración de L-arginina (Sigma-Aldrich, Alemania).
Los animales fueron anestesiados con clorhidrato de tiletamina y zolazepam (Zoletil 50, Virbac, México) 8 mg/kg IV, fentanilo (Janssen-Cilag, México) 0.02 mg/kg IV, atropina (Atropisa, Pisa, México) 0.02 mg/kg IV, acepromacina (Calmivet Vetoquinol, México) 0.02 mg/kg IV. Los signos vitales y parámetros hemodinámicos fueron evaluados por medio de un monitor para electrocardiografía (Datascope Passport, EUA). Los perros se colocaron en posición dorsoventral (supino) y se intubaron orotraquealmente (Endotracheal tube, Rush. Kamunting, Malaysia) y se conectaron a un ventilador de volumen (Harvard Apparatus, EUA), con un volumen corriente de 10 mL/kg y frecuencia respiratoria de 20 rpm, fracción inspirada de oxígeno (FiO2) 100%.18,19 Para mantener la anestesia, se utilizó un vaporizador (Isotec 3 Ohmeda) con isoflurano 1.5% (PISA Laboratorios, México). Mediante disección se colocaron catéteres vasculares en arteria y vena femorales (Cordis Corp, Johnson & Johnson, CA, USA) y en vena yugular derecha un catéter Swan-Ganz 5 Fr (Edwards Lifesciences, Irvine Cal, USA), a través de los cuales se registraron los parámetros hemodinámicos sistémicos, pulmonares y se realizó toma de muestras sanguíneas. El gasto cardíaco (GC) e índices de resistencia vascular pulmonar (RVP) y sistémica (RVS) fueron calculados mediante computadora (Hemodynamic Profile Computer Spectramed model SP-1445, Oxnard, EE.UU.).
Inducción del SIRA
El grupo II y III recibieron a través del catéter en la vena femoral 0.09 mL/kg de AO (ácido cis-9-octadecenoico; CAS 112-80-1, Sigma Aldrich, Alemania) emulsificado con etanol 1:1 y diluido a 10 mL de solución salina fisiológica, se administró con un flujo constante de 0.5 mL/min durante 20 minutos.20 El grupo III recibió pretratamiento con 0.125 g/min/IV de L-arginina (CAS 74-79-3, Sigma-Aldrich, Alemania) en 250 mL de solución salina 0.09% en el intervalo entre 60 minutos antes y 60 minutos después de la infusión de AO.1 La tasa de infusión se mantuvo por debajo de los límites de hipervolemia.21
Se diseñó como un estudio agudo con una duración de 165 minutos y al concluir este tiempo los animales fueron sometidos a eutanasia con una sobredosis de pentobarbital sódico (Anestesal, Pfizer, México).14
Evaluación
Hemodinamia y gasometría
Se evaluaron los siguientes parámetros: GC; presión arterial media (MAP); presión media de la arteria pulmonar (PMAP); presión de oclusión de la arteria pulmonar (POAP); cortocircuito intrapulmonar (QS/QT); índice de resistencia vascular sistémica (SVRi) y pulmonar (PVRi); presión de oxígeno arterial (PaO2).
Radiográfica
Se tomaron radiografías ventrodorsales basales a los 60 y 150 minutos después de la administración del AO. La presencia de opacidades se cuantificó de acuerdo con su extensión sobre una escala de 0 a 4: sin opacidades (grado 0), opacidades hasta 25% (grado 1), opacidad de 26 a 50% (grado 2), de 51 a 75% (grado 3), y de 76 a 100% (grado 4). Dos investigadores determinaron el grado de manera independiente en un análisis doble ciego.
Determinación del edema pulmonar
El edema pulmonar se cuantificó por análisis gravimétrico. Los lóbulos pulmonares caudales se pesaron y secaron a una temperatura entre 60 y 65 oC hasta obtener peso constante. Finalmente, la ganancia de peso del pulmón se calculó mediante la siguiente fórmula: ΔPP = (PH-PS)/PS, donde ΔPP = ganancia de peso de pulmón, PH = peso final del pulmón y PS = peso inicial de pulmón.
Evaluación microscópica
El tejido pulmonar en todos los casos se tomó del lóbulo caudal, se fijó en formaldehído al 10% y se embebió en parafina. Secciones de 4 micras de espesor, se tiñeron con hematoxilina-eosina (HE) y se analizaron por microscopia de luz para determinar la presencia de daño alveolar difuso caracterizado por edema, colapso alveolar, hemorragia, membranas hialinas, microtrombos e infiltración de neutrófilos. Los resultados se clasificaron en cuatro categorías: histología normal (grado 0), lesión leve (grado 1), lesión moderada (grado 2) y lesión grave (grado 3).22
Cuantificación de ET-1
Al final del estudio se obtuvieron muestras de sangre de la arteria pulmonar (catéter de Swan-Ganz) y se colocaron en tubos con EDTA, se centrifugaron a 1,800 rpm durante 15 minutos a 4 oC (CS-6R Beckman, EUA), posteriormente la muestra se concentró con una columna Sep-Pak C18 (Millipore, EUA). Se cuantificó con técnica de ELISA (Endothelin-1 ELISA kit, 900-020A, Enzo Life Sciences, EUA).
Detección inmunohistoquímica de ET-1 y ETB
La detección de la expresión in situ de ET-1 y ETB en el tejido pulmonar se realizó en secciones de 2 a 4 micras de espesor con anticuerpo anti-ET-1 monoclonal, MA3-005, Research Diagnostics, EUA) y anticuerpo Endothelin B receptor (Endothelin Receptor Polyclonal Antibody, 20R-ES002, Fitzgerald, EUA), con el sistema estreptavidina-biotina-peroxidasa (Vectastain Universal Quick Kit, Vector Laboratories, EUA).23 Para revelar se utilizó el cromógeno 3-amino-9-etil-carbazol (AEC) (Substrate Pack Biogenex, 932-HK092-F San Ramón CA, EUA). Se tiñeron con hematoxilina (Biocare Medical, CA, EUA) y para virar el contraste se utilizó carbonato de litio (Fisher chemical, NY, EUA). Las secciones fueron evaluadas semicuantitativamente por microscopia de luz de acuerdo con una escala de inmunotinción que describe proporción e intensidad.24 La puntuación se determinó sumando los resultados del porcentaje de células (0 = 0%; 1 ≤ 30%; 2 = 30-60% y 3 ≥ 60%) con el valor ordinal de intensidad de tinción (0 = negativo, 1 = débil, 2 = medio y 3 = fuerte.) Así como la descripción de los diferentes componentes de tejido donde se expresó.
Los datos fueron expresados como media ± EE. Para las variables de hemodinamia y gasometría se utilizó un análisis de la varianza de medidas repetidas (ANDEVA MR), para comparar contra el grupo control (ANDEVA, Dunnett) y con prueba de Bonferroni, cuando se detectó efecto entre sujetos. La prueba de normalidad que se utilizó fue Shapiro-Wilk (p < 0.05); y la prueba de Levene para igualdad de varianzas (p < 0.05). Para el análisis radiográfico se realizó prueba de Wilcoxon (p < 0.05) para mediciones en el mismo grupo a lo largo del tiempo e índice kappa para estimar la concordancia entre observadores.
Resultados
Todos los animales sobrevivieron al tiempo de estudio y los grupos II y III desarrollaron SIRA posterior a la administración del AO.
Hallazgos hemodinámicos y gasométricos
Los parámetros hemodinámicos MAP, POAP y GC durante los 165 min del experimento permanecieron sin cambios significativos en todos los grupos (p > 0.05, ANDEVA MR). En el grupo II se observó incremento de la PMAP a partir de los 15 minutos posteriores a la administración de AO rebasando los límites de referencia. Sin embargo, a partir del minuto 90 se mostró un mayor incremento que se mantuvo hasta el final del estudio en comparación con el grupo control (p < 0.05, ANDEVA Dunnett) y el grupo III mostró valores menores de la PMAP en comparación al grupo I a partir del minuto 45 (P = NS, ANDEVA MR) (Figura 1).
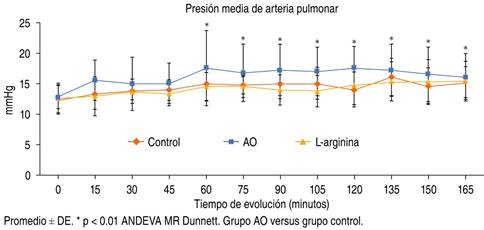
Figura 1: Muestra la evolución en el tiempo de la presión media de arteria pulmonar en los tres grupos de estudio.
La PVRi presentó diferencias significativas en el tiempo (p = 0.05, ANDEVA MR) y al comparar entre grupos (p = 0.001, ANDEVA MR Dunnett), con diferencia entre el grupo AO (control) y el grupo II (AO); por otra parte, el grupo III no difirió de los grupos I y II (p = 0.566, ANDEVA MR Dunnett). Además, la SVRi presentó diferencias del grupo II (AO) versus el grupo I (control) (p = 0.05, ANDEVA MR) (Tabla 1).
Tabla 1: Hallazgos hemodinámicos.
| Parámetro | Grupo de estudio | Tiempos de evolución (minutos) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 15 | 30 | 45 | 60 | 75 | 90 | 105 | 120 | 135 | 150 | 165 | ||
|
PVRi PVRi din/sec/cm-(5) |
Control Grupo I |
224.6 ± 91.3 | 227.1 ± 118.3 | 183.8 ± 67.8 | 193.6 ± 111.8 | 174.5 ± 59.1 | 188.5 ± 88.6 | 183.3 ± 63.1 | 221 ± 93 | 234.8 ± 114.4 | 229.3 ± 71.7 | 234 ± 94.8 | 246.1 ± 86.5 |
| AO Grupo II |
275.6 ± 100.9 | 598.5 ± 288.6* | 441.1 ± 17* | 421.8* ± 201.7 | 471.3 ± 250.7* | 399.3 ± 239.7 | 366.8 ± 147 | 450.1 ± 155.1* | 395 ± 96.7 | 380.6 ± 156.7 | 482.1 ± 280.6 | 419.5 ± 165.5 | |
| L-arginina Grupo III |
189 ± 52.54 | 431 ± 85.32 | 344.2 ± 113.32 | 392 ± 201.85 | 365.8 ± 120.65 | 279.6 ± 98.8 | 267.6 ± 114.07 | 233 ± 127.03 | 276 ± 164.52 | 236.4 ± 106.75 | 243 ± 98.54 | 252.4 ± 101.93 | |
|
SVRi SVRi din/sec/cm-(5) |
Control Grupo I |
1,426.8 ± 347.8 | 1,425.5 ± 249.4 | 1,197.5 ± 206.3 | 1,264.3 ± 288.6 | 1,379.0 ± 183.6 | 1,319.8 ± 266.8 | 1,516.8 ± 337.9 | 1,596.8 ± 311.1 | 1,794 ± 286.1 | 1,789 ± 287.9 | 1,962.5 ± 375.9 | 1,904.1 ± 342.3 |
| AO Grupo II |
3,310.8 ± 494.0* | 4,356 ± 814.9* | 3,663.1 ± 647.7* | 3,504 ± 687.8* | 3,011.6 ± 632.1* | 2,785.1 ± 567.4* | 2,805.8 ± 649.6 | 3,075.3 ± 822 | 2,468.3 ± 537.2 | 2,512.6 ± 500.9 | 2,489.8 ± 483.4 | 2,071.1 ± 399.3 | |
| L-arginina Grupo III |
1,891.4 ± 133.3 | 2,978.8 ± 74.3* | 3,033 ± 718.4 | 2,805.2 ± 501.1* | 2,788.8 ± 392.2* | 2,312.6 ± 242.3 | 2,136.6 ± 95.1 | 2,296.8 ± 38.2 | 2,384.8 ± 80.4 | 1,898.6 ± 94.3 | 1,897.2 ± 88.1 | 1,781.0 ± 289.1 | |
|
QS/QT % |
Control Grupo I |
9.8 ± 9.7 | 8.8 ± 6.4 | 8.3 ± 6.4 | 12.8 ± 11.6 | 12.5 ± 12.6 | 15.5 ± 12.5 | 15.5 ± 12.1 | 15 ± 11.1 | 16 ± 10 | 10 ± 13.9 | 15.1 ± 12 | 15.6 ± 11.6 |
| AO Grupo II |
21.3 ± 5.9 | 25.1 ± 23.7 | 23.3 ± 23.2 | 32.6 ± 28 | 45.3 ± 35.6 | 41 ± 24.2 | 43.5 ± 22.1 | 46.3 ± 25.4* | 48 ± 24.1* | 56.1 ± 29.5* | 51 ± 24.8* | 52.3 ± 22.3* | |
| L-arginina Grupo III |
24.4 ± 20.8 | 26.8 ± 19.3 | 28 ± 14.7 | 44.6 ± 29.2 | 52.6 ± 24.1 | 55 ± 30.5 | 59 ± 29.1 | 64 ± 16.6* | 65.8 ± 16.9* | 68.8 ± 28.7* | 67.6 ± 11.6* | 68.8 ± 11.9* | |
* p < 0.05. ANDEVA MR, Dunnett. Promedio ± DE.
PVRi = índice de resistencia vascular pulmonar; SVRi = índice de resistencia vascular sistémica; QS/QT = cortocircuito intrapulmonar.
La PaO2 disminuyó a los 15 minutos después de la administración del AO en los grupos II (AO) y III (L-arginina) por debajo de sus valores basales en comparación con el grupo I (control) durante todo el estudio. Si bien, la PaO2 fue menor en el grupo III (L-arginina) que en el II (AO) (p < 0.01, ANDEVA Dunnett) al final del estudio.
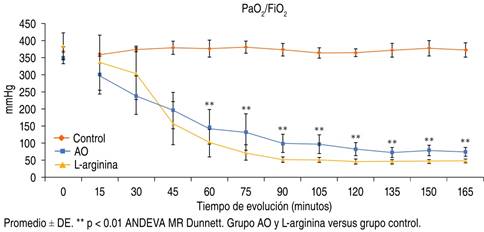
El cociente PaO2/FiO2 se utiliza para determinar la presencia del SIRA y de acuerdo al cociente se divide en: leve PaO2/FiO2 ≤ 300, pero > 200; moderada PaO2/FiO2 ≤ 200, pero > 100; y severa PaO2/FiO2 ≤ 100.25 En este estudio encontramos el desarrollo de SIRA en los grupos II (AO) y III (L-arginina), por la disminución de la relación PaO2/FiO2 a lo largo de los 165 min del experimento, con diferencia significativa en la relación PaO2/FiO2 de estos dos grupos con el grupo I (control) (p < 0.05, ANDEVA MR Dunnett) (Figura 2). Además, el QS/QT de los grupos II (AO) y III (L-arginina) tendió a aumentar significativamente después de 45 min de haber iniciado el experimento (Tabla 1).
Análisis radiográfico
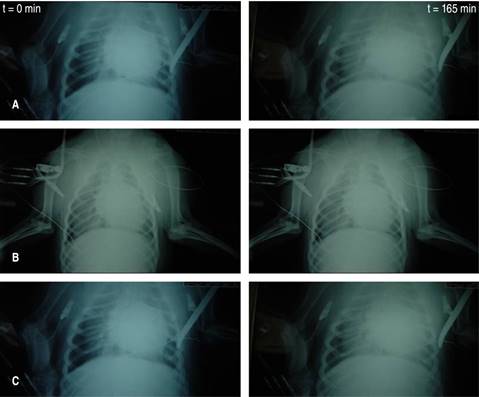
Ningún animal en el grupo I (control) presentó cambios radiográficos. En el grupo II (AO) a los 60 minutos del estudio, tres animales mostraron opacidades alveolares bilaterales periféricas, difusas y asimétricas, con broncograma aéreo (grado 3); los tres animales restantes mostraron opacidades (grado 2), significativas estadísticamente versus radiografías basales y el grupo I (control) (Wilcoxon z = -2.75, p < 0.006). Al final del estudio, en los grupos II (AO) y III (L-arginina) las opacidades fueron de grado 4 (Wilcoxon z = 3.002, p < 0.003). El índice Kappa arrojó un valor de 0.87 (p < 0.001), lo que indica un buen nivel de concordancia entre los observadores (Figura 3).
Análisis gravimétrico
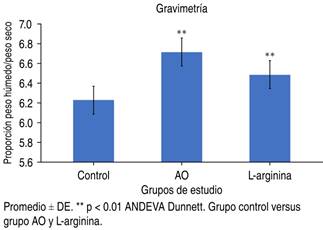
El peso de los pulmones de los grupos de estudio II (AO) y III (L-arginina) aumentó (127.17 ± 32.34 g y 107.00 ± 29.06 g, respectivamente) en comparación con el grupo I (42.08 ± 13.26 g), (p < 0.001 ANDEVA MR, Dunnett). En la Figura 4 se presenta el peso húmedo/peso seco.
Análisis histológico
Histológicamente el grupo I (control) no presentó cambios. El grupo II (AO) desarrolló colapso alveolar (grado 2), edema alveolar (grado 3), hemorragia (grado 1), infiltración de polimorfonucleares (PMN) (grado 3), microtrombos (grado 2). El grupo III (L-arginina) presentó colapso alveolar (grado 2), edema (grado 2), hemorragia (grado 1), infiltración de PMN (grado 2), microtrombos (grado 1) (p < 0.05 Kruskal-Wallis) (Figura 5).

Figura 5: Gráfica y micrografía de tejido pulmonar. La gráfica muestra la escala histopatológica con las medianas para cada parámetro en cada grupo (arriba). La micrografía (abajo) exhibe la histología sin alteraciones patológicas en septos, espacios alveolares y vías aéreas del grupo control; edema alveolar severo en el grupo II (AO) e infiltración de neutrófilos moderada, y grupo III (L-arginina) sin alteraciones patológicas.
Cuantificación de ET-1
Los niveles plasmáticos de ET-1 mostraron diferencias significativas entre el grupo I (control) (0.61 ± 0.35 pg/mL) y grupo II (AO) (4.15 ± 0.49 pg/mL) (p < 0.001, ANDEVA Dunnett) y entre el grupo II (AO) y grupo III (L-arginina) (5.5 ± 2.50 pg/mL) (p < 0.002, ANDEVA Dunnett).
Hallazgos inmunohistoquímicos
La detección inmunohistoquímica de la expresión de ET-1 mostró en el grupo I (control) que 33% de las muestras tuvo una positividad en porcentaje menor de 30%, con una intensidad de tinción media. En el grupo II (AO) hubo positividad en 83.33% con una proporción menor de 30%, con intensidad fuerte, y el grupo III (L-arginina) 100% mostró una proporción menor de 30% con una intensidad débil. Respecto al inmunomarcaje de ETB, 100% del grupo I (control) tuvo una proporción de tinción menor de 30% con una intensidad media; el grupo II (AO) 100% tuvo una proporción de tinción mayor de 60%, con una intensidad fuerte, y en el grupo III (L-arginina) sólo 16.6% de las muestras mostró una proporción en la tinción menor de 30% con intensidad leve.
En ambos marcajes la tinción se observó principalmente en epitelio de bronquiolos y células endoteliales, seguida de las células epiteliales alveolares, en todos los casos con un patrón citoplasmático difuso (Figura 6).
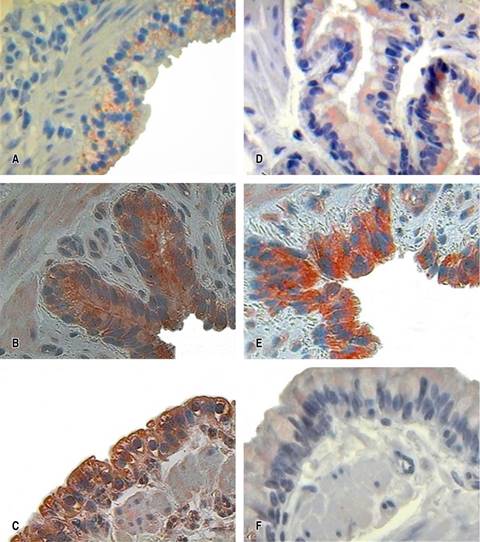
Figura 6: Inmunohistoquímica de tejido pulmonar (40×) con 3-amino-9-etilcarbazol (AEC). Muestra el inmunomarcaje en epitelio respiratorio para ET-1 medianamente positivo en: A) (I control); fuertemente positivo en B) (II AO) y C) (III L-arginina); y ETB medianamente positivo en D) (I control); fuertemente positivo en E) (II AO) y débilmente positivo en F) (III L-arginina).
Discusión
En el presente trabajo se estudiaron los efectos de la administración de L-arginina en los cambios hemodinámicos, gasométricos, radiográficos, microscópicos, niveles plasmáticos de ET-1 y detección inmunohistoquímica para ET-1 y ETB durante el SIRA inducido por AO, hipotetizando que debido a la disfunción endotelial, la administración de L-arginina antes de la inducción de SIRA podría influir en la liberación de ET-1, lo que a su vez conduciría a la prevención o atenuación de daño endotelial inducido por AO.
Para esto se eligió el modelo de SIRA inducido por AO, ya que desde su primera descripción por Ashbaugh et al. (1968),26 este modelo continúa vigente debido a que está bien caracterizado, ya que reproduce las lesiones patológicas de la fase inicial del SIRA presentes en humanos.10-12,27 La ventaja de este modelo frente a otros es que puede utilizarse en animales pequeños y grandes con la aparición aguda de las lesiones patológicas de SIRA después de la inyección de AO, y la posibilidad de estudiarlo sin inflamación sistémica como en muchos otros modelos de sepsis.12 El mecanismo de acción que media la lesión pulmonar del AO ocurre por la unión directa de éste a las membranas biológicas, lo que provoca que se disparen las vías intracelulares que terminan en la muerte de las células pulmonares, es decir, es directamente tóxico para las células endoteliales, causando necrosis e induciendo congestión capilar y edema intersticial e intraalveolar.28-30 El AO induce principalmente necrosis, pero también provoca apoptosis por disminución del marcador antiapoptótico Bcl-2 y un aumento del marcador proapoptótico Bad. También activa las caspasas, aumentando la generación de especies reactivas de oxígeno e induce despolarización mitocondrial y apoptosis en leucocitos,31 por lo que no se requiere que las células inflamatorias o sus productos medien el daño. Tal como lo describen Matute-Bello et al.32 «existe una infiltración de neutrófilos, pero la lesión no depende de los polimorfonucleares». De tal forma que es un modelo que da la posibilidad de estudiar SIRA sin inflamación sistémica como en muchos otros modelos de sepsis,12 pero con el daño al parénquima pulmonar que lleva al aumento de la permeabilidad vascular, lo que a su vez induce acumulación de líquido extravascular, alteración del tono vascular pulmonar, y deterioro de la función pulmonar con cambios hemodinámicos concomitantes. Para la inducción de SIRA con AO en este estudio se empleó la técnica descrita por Hernández et al.20 y se pudo establecer en todos los grupos SIRA con sus consecuencias patológicas, cumpliendo con los lineamientos para establecer el diagnóstico según lo establece el Consenso de Berlín.25
En este trabajo, los grupos II (AO) y III (L-arginina) desarrollaron SIRA caracterizado por lesión de la membrana alveolocapilar, lo que causó edema pulmonar con incremento en la PMAP desde los 15 minutos posteriores a la administración de AO, debido a que la inyección intravenosa de este ácido graso produce lesión endotelial, inflamación y daño al parénquima pulmonar, pero el incremento más notorio presente a los 90 minutos, posiblemente fue provocado por los cambios en la permeabilidad vascular pulmonar y a la presencia de edema pulmonar como lo describe Kluttig.33
El aumento del PVRi en el grupo II (AO) se debió al hecho de que SIRA inducido por AO provoca hipoxia y alteración de tono vascular.34,35 No obstante, en el grupo III (L-arginina) la administración exógena de L-arginina atenuó significativamente el incremento de la resistencia vascular, al ser un regulador crítico de la producción de ON endotelial vascular. Sin embargo, este aminoácido exclusivo precursor del ON endógeno en ausencia de lesión vascular, por lo regular no afecta la producción de ON.2 Otros investigadores también han mostrado que la administración exógena de L-arginina atenúa la disfunción endotelial en diferentes modelos, como Abdullahi et al.36 quienes aluden que la suplementación oral de L-arginina mejoró la relajación dependiente del endotelio en ratas al mejorar la expresión del gen para óxido nítrico sintetasa endotelial (eNOS). Chao et al.37 también han reportado que la L-arginina puede atenuar la lesión pulmonar mediante la restauración de la función endotelial y disminución en la liberación de citocinas inflamatorias. Más recientemente también se conoce que las manifestaciones sistémicas observadas en el SIRA en la enfermedad por coronavirus (COVID-19), provocado por coronavirus 2 (SARS-CoV-2) pueden explicarse por una disfunción endotelial y por estos motivos, basándose en los efectos positivos de la L-arginina en la función endotelial, otros investigadores también especulan que la suplementación con arginina podría ser útil para contrastar la disfunción endotelial en pacientes con COVID-19.38,39 Al ser la L-arginina un aminoácido condicionalmente esencial en el paciente crítico la vía de administración no parece estar asociada con una alteración sustancial de los niveles disponibles de L-arginina. La biodisponibilidad relativa en el endotelio depende de que los mecanismos de síntesis de ON puedan estar saturados por la L-arginina endógena, también de que las células endoteliales y las células inflamatorias agudas como los macrófagos sean capaces de expresar arginasas que disminuyen localmente las reservas de L-arginina y privan de sustrato a la eNOS. Por tanto, el mecanismo potencial de la L-arginina implica la biodisponibilidad de la propia L-arginina o su inhibidor dimetilarginina asimétrica (ADMA).2
El aumento de QS/QT en los grupos II (AO) y III (L-arginina) confirmó la presencia de edema, hemorragia y colapso alveolar, lo que impide el intercambio gaseoso. Sin embargo, el deterioro de QS/QT en el grupo III (L-arginina) en comparación con el grupo II (AO) sugiere que durante la hipoxia secundaria a SIRA, el ON liberado desde la célula endotelial atenuó la vasoconstricción pulmonar hipóxica (VPH). Se sabe que después de la administración de inhibidores del ON endógeno se mejora el intercambio gaseoso con redistribución, éste desde zonas hipóxicas a áreas bien ventiladas, lo que sugiere que el ON endógeno inhibe la VPH y puede agravar la relación ventilación/perfusión manteniendo el flujo sanguíneo en regiones deficientemente oxigenadas. El mecanismo molecular exacto de la VPH es menos conocido que la vasodilatación hipóxica en la circulación sistémica. Si bien, las células epiteliales alveolares pueden ser clave para detectar una baja concentración de oxígeno, y las células del músculo liso vascular pulmonar obviamente son las efectoras de la vasoconstricción, el endotelio vascular pulmonar desempeña un papel crucial como intermediario entre estos tipos de células. De hecho, Böger et al.40 observaron una liberación disfuncional de ON endotelial en humanos expuestos a hipoxia aguda, y los estudios en animales sugieren que la vasoconstricción pulmonar hipóxica se ve reforzada por la inhibición de la de NOS. Esto puede deberse, en parte a la elevación de ADMA, un inhibidor endógeno de la síntesis de ON, ya que los niveles altos de ADMA se asocian con disfunción endotelial, enfermedad vascular e hipertensión.
La potenciación de la VPH por el ON se ha demostrado en diferentes modelos de alteración de la relación ventilación/perfusión intrapulmonar como la lesión pulmonar por AO.41 No obstante, la eficacia del ON depende del grado de alteración de la relación ventilación/perfusión predominante, siendo mayor en presencia de cortocircuito. Si el ON accede y vasodilata áreas con baja relación ventilación perfusión, la PaO2 puede aumentar, disminuir o no modificarse en absoluto.42 Pero la VHP también puede verse afectada por el incremento en la síntesis de ET-1 o la disminución en su depuración43 así como la disminución en la expresión de ETB, ya que las endotelinas median la vasoconstricción pulmonar hipóxica y la hipoxia incrementa los niveles de endotelina en el plasma y los niveles de ARNm en el pulmón. El bloqueo selectivo y no selectivo de los receptores para ET-1 inhibe la HPV en algunos estudios, pero no en otros, esta discrepancia puede explicarse en parte por la liberación variable del ON. Estos datos apoyan los hallazgos de este trabajo que sugieren que el ON endógeno atenuó la HPV y empeoró la relación ventilación/perfusión, lo que mantuvo el flujo sanguíneo en regiones mal oxigenadas.
La disminución en el peso de los pulmones en el grupo III (L-arginina) mostró que la administración aguda de L-arginina protegió los pulmones de incremento en la permeabilidad durante la lesión por AO, ya que se sabe que el ON es capaz de cambiar la presión de la microvasculatura, lo que puede resultar en la formación de edema, y además regula el balance de líquido en el pulmón. El mecanismo por el cual el ON estabiliza la permeabilidad microvascular todavía no es muy claro. Se sabe del efecto directo e indirecto del ON en el endotelio y epitelio, y puede actuar directamente sobre las uniones intercelulares por estimulación de GMPc (guanosín monofosfato cíclico), el cual causa relajación celular; hay evidencia de que esto puede estrechar las uniones intercelulares y disminuir la permeabilidad.44
Las alteraciones histopatológicas del SIRA inducido por AO encontradas en este trabajo están asociadas con lesión al endotelio pulmonar que lleva a evidentes alteraciones funcionales como la extravasación de líquido del espacio extravascular a los espacios aéreos como consecuencia del aumento de la permeabilidad de la barrera alveolocapilar. Este aumento de la permeabilidad se ve facilitado tanto por lesión como la activación del endotelio pulmonar, además la lesión epitelial conduce a una disminución de surfactante y por tanto, a una baja en el transporte de líquido. Asimismo, la presencia de infiltrado de polimorfonucleares en el grupo II (AO) reveló que el AO originó lesión endotelial y daño al parénquima pulmonar similar a la fase exudativa de SIRA. Aunque si bien el reclutamiento de neutrófilos en el pulmón es un sello distintivo de SIRA en modelos con lipopolisacárido (LPS), en el modelo de AO existe una infiltración de neutrófilos, pero la lesión no depende de PMN como lo describieron Matute et al.32 Igualmente Huan-Ping Yu, et al.45 describieron que el AO puede tener efectos tanto favorables como desfavorables en el sistema inmunológico, ya que puede suprimir, mejorar o sinergizar la hiperactividad de los neutrófilos dependiendo de la dosis aplicada. Por otra parte, Guimaraes8 mostró que el SIRA inducido por AO activa al sistema ET-1, vía activación de receptores ETB, lo cual también puede influir en la infiltración de neutrófilos circulantes y en el aumento de la permeabilidad vascular alveolar como ocurrió en el grupo II (AO).
Los hallazgos histopatológicos en el grupo III demostraron que la administración de L-arginina disminuyó la infiltración de polimorfonucleares asociada con lesión vascular,46 lo cual concuerda con Wu et al.47 quienes estudiaron los efectos de la L-arginina en la respuesta inflamatoria, después de desafiar células epiteliales con LPS demostraron que un mecanismo de acción antiinflamatorio de la L-arginina es inhibir las vías de señalización de NF-κB. Además, la arginina también fue capaz de mejorar la β-caseína y la expresión de caseína total en células epiteliales mamarias bovinas inducidas por LPS.
El incremento en la concentración de ET-1 en los grupos II y III a partir del minuto 15 pos SIRA concuerda con trabajos previos, donde se ha observado que hay un aumento en la circulación en el SIRA tanto clínico como experimental y correlaciona con su severidad,48-50 y se sabe que la mejoría clínica correlaciona con la disminución de los niveles de ET-1. No obstante, el acrecentamiento de ET-1 en SIRA parece ser ocasionado más por un incremento en la síntesis pulmonar en la disminución de su depuración. En pacientes que murieron por SIRA se observó un incremento en la expresión de ET-1 en el endotelio vascular, músculo liso, epitelio de la vía aérea y macrófagos alveolares en comparación con pacientes que no murieron por SIRA y curiosamente estos pacientes tuvieron una disminución en la expresión de eNOS y óxido nítrico sintetasa inducible (iNOS) en el pulmón.51 Esta elevación de ET-1 también está relacionada con el incremento significativo en RVPi, ya que la ET-1 tiene un papel importante en el desarrollo de la vasoconstricción porque el lecho vascular es muy sensible a los efectos vasoconstrictores de ET-1 y ésta potencia el efecto vasoconstrictor de la activación simpática y su mismo efecto vasoconstrictor está potenciado por una disminución en la síntesis de ON. Asimismo, la disminución de la relación PaO2/FiO2, como la que se presentó en los grupos de AO y L-arginina, y la progresión del QS/QT pueden estar asociadas al incremento en la concentración plasmática de ET-1. Del mismo modo, es posible que la disminución de la expresión de receptores B haya causado una disminución en la depuración de ET-1.
Debido a que los niveles de ET-1 plasmática así como el inmunomarcaje de ET-1 en el tejido pulmonar aumentaron significativamente, además de que ETB disminuyó en el grupo en el grupo III, L-arginina sugiere que hubo una regulación negativa de los receptores ETB in vivo inducida por ET-1. La posible explicación es que la disfunción endotelial que ocurre en el pulmón congestivo, puede resultar en la disminución de la expresión de ETB, ya que el receptor existe principalmente en las células endoteliales, si éstas degeneran con rapidez, se espera entonces que los niveles de ARNm del receptor ETB disminuyan. Carpenter et al.52 mostraron datos similares y llegaron a la conclusión de que los animales con deficiencia del receptor ETB tenían fuga de proteína vascular pulmonar exagerada en la normoxia, que la hipoxia exacerba esa fuga y que este efecto es en parte atribuible a un aumento mediado por ET-1.
Por ende, los resultados del presente estudio sugieren que el marcado incremento de ET-1 plasmática y por determinación inmunohistoquímica en el tejido pulmonar en el grupo III (L-arginina) puede ser atribuible a la disminución del aclaramiento por los receptores ETB, pero también el aumento en los niveles de ET-1 influye en la progresión de la enfermedad pulmonar.
Conclusiones
El pretratamiento con L-arginina en un modelo experimental de SIRA inducido por AO atenuó la VPH, disminuyó la infiltración inflamatoria en el tejido pulmonar, y puede proteger a los pulmones del incremento en la permeabilidad vascular. Por tanto, puede considerarse un posible papel terapéutico de la L-arginina en el edema e inflamación pulmonar.
Limitaciones
Es necesario considerar la existencia de limitaciones derivadas de un estudio de este tipo situado en el ámbito de la investigación. Se eligió un modelo de SIRA inducido por AO que ya ha sido empleado con anterioridad con buenos resultados, pero sabemos que no es una representación perfecta del SIRA clínico. Ambas condiciones tienen muchas similitudes, pero el AO causa la lesión directamente sin requerir que células inflamatorias o sus productos medien el daño, mientras que el SIRA está relacionado, la mayoría de las veces, con sepsis e inflamación.
Otra limitación a destacar es la asistencia mecánica ventilatoria, ya que ésta representa un componente primordial en el manejo del SIRA, lo que deriva en la dificultad de trasladar estos resultados a humanos.











 nueva página del texto (beta)
nueva página del texto (beta)