Introducción
El óxido nítrico (NO) se forma cuando la L-arginina se oxida a L-citrulina a través de la acción enzimática de la óxido nítrico sintasa.1 En el epitelio respiratorio, el NO lleva a cabo una función broncodilatadora, antimicrobiana e inmunomoduladora2-4 y se encuentra presente en mastocitos, neutrófilos, células cebadas y macrófagos del epitelio respiratorio. El NO difunde en forma gaseosa hacia la luz de la vía aérea,5-8 lo que facilita su medición que puede ser de forma indirecta por sus derivados biológicos, o directamente por quimioluminiscencia.2
Dentro del epitelio respiratorio, la mayor parte de la producción de NO se lleva a cabo en los senos paranasales, por lo que en la nariz las concentraciones de este gas son de 10 a 100 veces mayores que las concentraciones de NO exhalado de la vía respiratoria inferior.9 Existen diversas enfermedades que pueden estar asociadas con aumento o disminución de la concentración de NO en el epitelio respiratorio; por ejemplo, la inflamación del tracto respiratorio en sujetos con asma puede causar aumento de la concentración del NO exhalado por boca y nariz; mientras que en la inflamación debida a otras causas, como en el caso de las bronquiectasias idiopáticas, puede existir un aumento de NO exhalado por boca, pero estar disminuido o normal por vía nasal.10,11
En algunos casos, los pacientes con sinusitis pueden presentar incremento o disminución de óxido nítrico nasal (nNO) dependiendo de los mecanismos inflamatorios subyacentes.12,13 En pacientes con discinesia ciliar primaria (DCP), las concentraciones de NO exhalado y nasal son considerablemente más bajas en comparación con sujetos sanos y pacientes con otras enfermedades respiratorias. Actualmente, la medición de nNO se considera como parte de las pruebas diagnósticas para esta enfermedad.14,15
Discinesia ciliar primaria
La DCP es una enfermedad que afecta aproximadamente a 1/15,000 a 1/30,000 nacidos vivos. La mayoría de los casos son por herencia autosómica recesiva que se caracteriza por un espectro de defectos en la ultraestructura o la función ciliar.16,17 El deterioro de la función ciliar impide la depuración mucociliar, lo que predispone en el 75% de la población enferma a la presentación de los síntomas clásicos de la DCP que incluyen congestión nasal crónica, sinusitis crónica, otitis media recurrente, tos productiva, neumonías o bronquitis recurrentes, así como dificultad respiratoria en el período neonatal. El 50% de los individuos afectados tiene situs inversus totalis; y en algunos casos, se han reportado situs ambiguos o heterotaxia.1,18
La microscopía electrónica de transmisión (ME) de células epiteliales ciliadas, ha sido considerada el estándar de oro en el diagnóstico de esta enfermedad. Mediante la ME se evalúan las anormalidades ultraestructurales de los cilios respiratorios, los brazos de dineína internos y externos, el haz radial o el aparato central.1 El procesamiento e interpretación de las muestras ciliares mediante ME requiere una amplia capacitación y experiencia por lo que se limita a pocos centros de atención de tercer nivel y es poco accesible en algunos países. De igual manera, estudios recientes han demostrado que los resultados de ultraestructura ciliar pueden ser normales en algunos casos de DCP confirmados por pruebas genéticas.19 Por lo tanto, se ha puesto mayor énfasis en otras pruebas para el abordaje diagnóstico de esta enfermedad como la medición nNO. Esta es una prueba accesible, mínimamente invasiva y con alta sensibilidad y especificidad para el diagnóstico de DCP.
Medición de nNO para diagnóstico de discinesia ciliar primaria
El estándar de oro para la medición de NO es el método de quimioluminiscencia. Se basa en la medición de la intensidad de radiación fluorescente emitida después de la oxidación química del NO por el ozono. El producto de esta reacción es el dióxido de nitrógeno (NO2), se emite un fotón por cada reacción. La cantidad de fotones es proporcional a la concentración de NO en el tejido o gas que se esté analizando.4
La DCP se caracteriza por concentraciones bajas de nNO. En niños mayores de cinco años y en adultos, un punto de corte < 77 nL/min otorga sensibilidad de 97.5% y especificidad de 96.4%,20,21 mientras que los controles sanos suelen presentar niveles superiores a 250 nL/min.22,23
La guía de práctica clínica para diagnóstico de DCP de la Sociedad Americana de Tórax (ATS), recomienda que en sujetos mayores de cinco años de edad con fenotipo clínico consistente con DCP y habiendo descartado fibrosis quística, una concentración de nNO < 77 nL/min, medido en dos ocasiones en días distintos, es suficiente para sostener el diagnóstico de DCP. En esas circunstancias, la ME o las pruebas genéticas contribuyen a precisar el pronóstico y mejorar la comprensión de la enfermedad.21
Procedimiento para la medición de nNO mediante el analizador de óxido nítrico Sievers® NOA 280i
La medición en línea del nNO es una prueba rápida y no invasiva para la detección de DCP. El procedimiento completo toma de 10 a 20 minutos y los resultados están disponibles inmediatamente. Este estudio se realiza con analizadores de óxido nítrico (AON) por el método de quimioluminiscencia y la maniobra debe realizarse bajo una metodología estandarizada.
1. Calibración del equipo
Existen diversos factores como la humedad, el ambiente, el voltaje de línea y la cámara de reacción que pueden afectar la calibración de los equipos para medición de ON. Se debe llevar a cabo una calibración diariamente de estos equipos que consiste en dos partes; la primera, es con un gas con una concentración de ON < 1 parte por billón (ppb) (Gas Cero); y la segunda con un gas con concentración conocida de ON.
- Gas cero: para la calibración del Gas Cero se utiliza un filtro que contiene permanganato de potasio y carbón activado, conectado a la línea de muestreo de NO. Se activa entonces el equipo para que se genere un flujo de aspiración de 200 mL/min. Al pasar el aire a través del filtro, éste produce oxidación a NO2, el cual es absorbido por el carbón activado dejando pasar a la línea de muestreo aire sin NO; por lo tanto, el resultado de la maniobra es cero. Se deben realizar mínimo dos calibraciones para replicar resultados estables y después el equipo hace un ajuste de compensaciones de ppb y partes por millón (ppm).
- Calibración de gas a una concentración conocida: se utiliza un gas con una concentración de NO entre 10-100 ppm, usualmente 45 ppm. Se conecta a la línea de muestreo del AON mediante una pieza «T» proporcionando un flujo de más de 200 mL/min (casi siempre 300 mL/min dada por el regulador). El equipo Sievers® NOA 280i está ajustado de fábrica para tener una respuesta de 2 mV/ppm por lo que para un gas de calibración de 45 ppm, la señal de voltaje final debe ser de ~ 90 mV. Por lo tanto, el AON calcula la respuesta para el rango ppb basándose en la nueva calibración en ppm24 (Figura 1).
2. Recomendaciones antes de la prueba
Se debe realizar el estudio cuando el sujeto se encuentra clínicamente estable. Se recomienda:
No haber presentado infección respiratoria en las últimas dos semanas.
No haberse realizado instrumentación nasal en las últimas dos semanas cirugía nasal, biopsia de cornetes y nasofibroscopía).
Evitar tabaquismo, consumo de alimentos ricos en nitratos (lechuga) y bebidas con cafeína dos horas antes de la prueba.
No haber ingerido alcohol 12 horas antes de la prueba.
No haber hecho ejercicio 30 minutos antes de la prueba.
3. Equipo y materiales
- Analizador de NO por quimioluminiscencia (Sievers® NOA 280i®) (Figura 2).
- Catéter de plástico con oliva o esponja nasal suave.
- Resistor desechable para generar una resistencia superior a 5 cmH2O y garantizar un cierre del paladar blando (cilindro de cartón con una abertura de 1 mm en el extremo distal o juguete de fiesta para soplar «espanta suegras») (Figura 3).
4. Técnica
- Estando el sujeto sentado se coloca el catéter de plástico con esponja en una narina, lo suficientemente profundo para garantizar un sellado hermético (Figura 4).
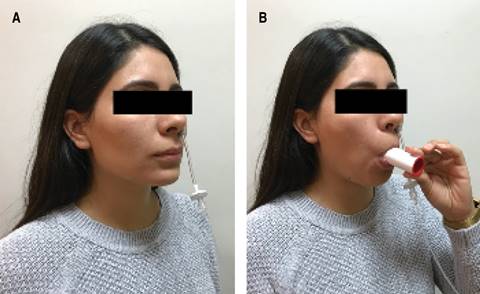
Figura 4: Preparación del individuo para realización de la maniobra de nNO. A) Colocación de catéter con esponja nasal en una fosa nasal dejando libre la otra fosa nasal; B) exhalación sostenida a través de la boquilla de cartón desechable con el resistor.
- Se solicita al sujeto que inspire profundo y después que coloque el resistor desechable en su boca y que exhale lentamente durante aproximadamente 20-40 segundos.
- Mientras el sujeto exhala por la boca, el gas nasal es aspirado por el equipo a través del catéter insertado en la fosa nasal.
5. Criterios de aceptabilidad y repetibilidad
- Exhalación de más de 10 segundos.
- Representación gráfica en pantalla de una meseta de la señal de NO constante durante 3 a 10 segundos (Figura 5).
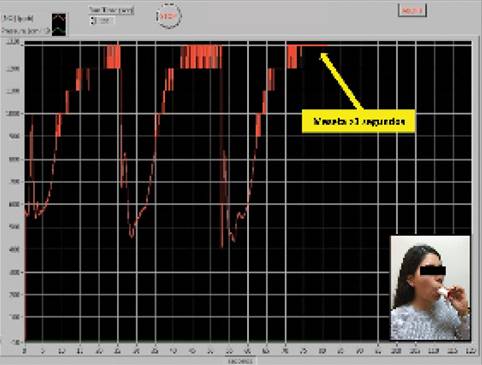
Figura 5: Gráfico de la medición de nNO durante la exhalación. Se observa la meseta de al menos tres segundos (flecha).
- Después de dos maniobras aceptables se evalúa la repetibilidad. Consiste en que la diferencia entre las dos mediciones aceptables sea menor al 10%. El mismo procedimiento se realiza en la otra narina.
6. Informe de resultados
El resultado del valor medido de cada fosa nasal se considera como la media de los valores medidos y se reporta como resultado final la media de las medias de los valores de nNO de ambas fosas nasales (derecha e izquierda).25 Debido a que los valores de nNO son reportados en ppb será necesario hacer la conversión a nL/min multiplicando la concentración de nNO en ppb por el flujo de muestreo del equipo de quimioluminiscencia que se esté utilizando (0.5 L/min en el caso del equipo Sievers® NOA 280i) (Figura 6).
El reporte generado debe contener la información necesaria para poder identificar al sujeto a quien se le realizó el estudio, las características del equipo, fecha de última calibración y datos de la maniobra, que permitan evaluar la calidad del estudio realizado:
Nombre completo del paciente.
Parámetros antropométricos (edad, género, peso y estatura).
Fecha de última calibración.
Valores individuales de cada una de las mediciones realizadas.
Gráfica que muestre la concentración de ON (ppb) versus gráfico de tiempo (segundos).
Media de los valores medidos de cada fosa nasal en ppb (nNO derecho, nNO izquierdo).
Resultado final de nNO en ppb y en nL/min.











 nueva página del texto (beta)
nueva página del texto (beta)






