Introducción
El cáncer de pulmón sigue siendo la principal causa de mortalidad en todo el mundo. En 2017, las estimaciones indicaban que sólo en América del Norte ocurrieron 222,500 nuevos casos de cáncer de pulmón y 155,870 muertes.1 El CPCNP constituye 85% de los tipos de cáncer de pulmón, y se ha clasificado tradicionalmente como carcinoma de células escamosas, adenocarcinoma o carcinoma de células grandes. El perfil molecular ahora puede identificar subgrupos clave de pacientes de acuerdo con el genotipo tumoral, en particular las mutaciones de EGFR y los reordenamientos de ALK y ROS1. Sin embargo, en el Instituto Nacional de Enfermedades Respiratorias (INER) Ismael Cosío Villegas, Ciudad de México, esto aún no se informa de forma rutinaria al momento del diagnóstico, con excepción de la mutación en EGFR, lo cual conlleva a retraso en los inicios del tratamiento al no poder personalizar el perfil molecular desde la primera visita. Las mutaciones en EGFR ocurren en el cáncer de pulmón avanzado en más de la mitad de todos los pacientes asiáticos, en 30-35% en población latinoamericana, y en aproximadamente 15% de los pacientes caucásicos.2,3 El fenotipo clásico para pacientes con mutaciones sensibles en EGFR es de mujeres no fumadoras con adenocarcinoma.4-8
El dominio de tirosinacinasa de EGFR abarca los exones 18-24, y la mayoría de las mutaciones se han identificado dentro de los exones del 18 al 21. Las mutaciones sensibilizadoras EGFR «clásicas» incluyen deleciones en el exón 19, y la mutación puntual L858R en el exón 21. Las mutaciones no clásicas o poco comunes representan aproximadamente 15% de las alteraciones restantes, que consisten en un gran grupo heterogéneo de inserciones, deleciones, mutaciones puntuales y otras aberraciones complejas.9-13
En los últimos años, muchos ensayos han demostrado la superioridad de TKI de primera y segunda generación. Afatinib difiere de gefitinib y erlotinib, debido a su unión irreversible y al EGFR, y al receptor del factor de crecimiento epidérmico humano 2-4 (su 2, su 3, su 4); los estudios no mostraron una diferencia significativa al compararse entre ellos.14,15 Recientemente, dacomitinib, otro inhibidor de tirosina cinasa de segunda generación (TKI), en comparación con gefitinib, mostró ser superior 5.5 meses en SLP (14.7 contra 9.2 meses), pero de nuevo con toxicidades aumentadas. Afatinib podría tener un papel importante en pacientes con mutaciones poco comunes; sin embargo, los informes de su actividad han sido inconsistentes hasta el momento.16
A pesar de las tasas de respuesta inicial de hasta 70% en pacientes con mutaciones clásicas, la resistencia a los TKI de primera y segunda generación se desarrollará en promedio después de nueve a 16 meses de tratamiento. La resistencia intrínseca podría ser el resultado de la presencia de una mutación concurrente no sensibilizante, incluido T790M. La fracción alélica de T790M podría predecir la respuesta, y la selección clonal a lo largo del tiempo puede influir en el desarrollo de la resistencia. La farmacogenómica también podría afectar la sensibilidad a los TKI. Las deleciones en marco en los exones 2-7 del dominio extracelular de EGFR son otro mecanismo de resistencia intrínseca. Los inhibidores de tercera generación contra EGFR, como AZD9291 (osimertinib) y CO-1686 (rociletinib), han mostrado potentes efectos anticancerígenos en pacientes con cáncer de pulmón no microcítico positivo para T790M. El estudio AURA 3, donde se compara osimertinib con quimioterapia basada en platino, en pacientes con adenocarcinoma EGFR positivos que habían recibido un TKI de primera generación y habían progresado con mutación en T790M, mostró ser hasta dos veces superior al tratamiento con el primero, con un mejor perfil de toxicidad (SLP 10.1 versus 4.4 meses). El uso de ADN libre circulante para detectar alteraciones genéticas llamada «biopsia líquida» se ha extendido a todo el mundo. Para el diagnóstico molecular antes del tratamiento, la evaluación de las alteraciones genéticas debe ser exhaustiva, para así detectar los cambios específicos de cada individuo mediante la secuenciación profunda u otros. Para controlar los efectos terapéuticos, podemos centrarnos en los loci específicos de los cambios genéticos, como la mutación T790M.17-19
El objetivo general de este estudio es describir la frecuencia de mutación T790M, determinada por biopsia líquida en pacientes con CPCNP después de la progresión a inhibidores de tirosincinasa contra EGFR en primera línea, en el INER Ismael Cosío Villegas.
Material y métodos
Diseño del estudio: se trata de un estudio observacional, retrospectivo y transversal, realizado en el Departamento de Oncología Torácica del INER Ismael Cosío Villegas, Ciudad de México, México, en el período 2015-2018. Se incluyeron todos los sujetos con diagnóstico de CPCNP, mutación EGFR sensible, que iniciaron tratamiento con un TKI en primera línea, y a quienes se les determinó progresión de la enfermedad, definida por los criterios RECIST versión 1.1 durante el seguimiento por parte del médico oncólogo en consulta externa. Una vez confirmado el desarrollo de la enfermedad a través de estudios tomográficos con criterios RECIST 1.1, se envió muestra sérica para determinación de resistencia en T790M, mediante biopsia líquida con apoyo farmacéutico de AstraZeneca, S.A. de C.V. y laboratorios Quest Diagnostics en la Ciudad de México. La variable desenlace fue la prevalencia de T790M en sujetos con CPCNP, TKI de primera línea y progresión de enfermedad. Los resultados se expresaron mediante estadística descriptiva, medias de desviación estándar o medianas y rango intercuartilar. Las variables categóricas se expresaron mediante frecuencia relativa y frecuencia absoluta. Se exploró la experiencia de supervivencia a través de curvas de Kaplan-Meier y se estimó la mediana e intervalo de confianza al 95%.
Una vez documentado el desarrollo de la enfermedad, no se realizó seguimiento de los pacientes para este estudio.
Criterios de RECIST 1.1: evaluación
Lesiones diana. Son las lesiones medibles hasta un máximo de cinco (y no más de dos por órgano), representativas de todos los órganos implicados (por ejemplo, en pacientes con un solo órgano implicado, se seleccionará un máximo de dos lesiones diana; y en el caso de dos órganos se seleccionará hasta un máximo de cuatro). Las lesiones diana son las seleccionadas y medidas en el estudio de base y, posteriormente, en la evaluación de los controles sucesivos. La selección está basada en su tamaño (las mayores) y facilidad para reproducir su medición en controles sucesivos.
Lesiones no diana. Incluyen tanto las lesiones no medibles como las medibles; de las lesiones medibles se incluyen aquéllas que excedan las dos por órgano o el total de cinco (éstas no necesitan medirse en los estudios de seguimiento, pero debe notificarse cualquier cambio en ellas).
Tipos de respuesta-progresión de la enfermedad
Lesiones diana. Se considera PE cuando aumenta 20%, se produce un incremento absoluto de al menos 5 mm (en la suma de los diámetros de las lesiones diana), cuando aparecen nuevas metástasis o progresan las lesiones no diana.
Lesiones no diana. Se considera PE o progresión inequívoca de enfermedad no diana, si el aumento en la carga tumoral basado en el cambio de las lesiones no diana es comparable en magnitud al incremento que sería necesario para considerar PE en caso de enfermedad medible (p. ej. cambio de mínimo derrame pleural a masivo o de carcinomatosis localizada a expansión generalizada).
Análisis de biopsia líquida en laboratorios Quest Diagnostics
Análisis sérico que permite detectar y controlar rápidamente biomarcadores de cáncer a partir de una muestra de sangre. El menú de pruebas de Focus Biocept se centra en biomarcadores de cáncer impulsados por las directrices de NCCN, y que son clínicamente utilizables. La plataforma Biocept Target Selector™ ofrece una capacidad única para analizar tanto al ADN tumoral circulante (ctDNA) como a las CTC. Esta flexibilidad aumenta la oportunidad de identificar un biomarcador que pueda afectar las decisiones de tratamiento. Esta opción de tecnología única de la plataforma Target Selector™ permite un rendimiento de la más alta calidad, para la detección de cada tipo de alteración somática en pacientes diagnosticados con cáncer. Se realizó PCR y después secuenciación para brindar mayor confianza en el resultado final. La tecnología Switch-Blocker enriquece las mutaciones oncogénicas y suprime el ADN de tipo silvestre, dando como resultado una sensibilidad y especificidad ultraelevadas. Todas las pruebas de ctDNA son cuantitativas y pueden usarse para controlar la carga de la mutación.
Resultados
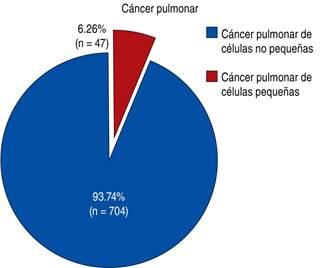
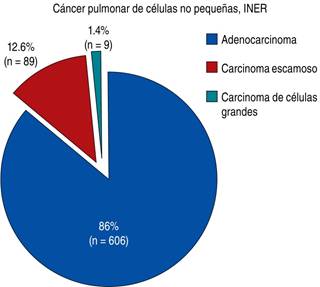
De la cohorte general de pacientes con diagnóstico de cáncer pulmonar (N = 751) en el INER Ismael Cosío Villegas, durante el período 2013-2018, se encontró registro de que 93.74% (n = 704) tenían diagnóstico de CPCNP, del cual 86% (n = 606) fueron de histología de adenocarcinoma. Se determinó la mutación de EGFR en un total de 73.92% muestras (n = 448), se observó positividad para mutación sensible a TKI en 42.63 % (n = 191) (Figuras 1 y 2).
Sesenta y nueve punto siete por ciento (n = 133) recibió TKI de primera generación en primera línea de tratamiento. Al seguimiento, se detectaron 31 pacientes con diagnóstico de adenocarcinoma pulmonar EC IV, con mutación EGFR sensible en tratamiento con TKI de primera línea con progresión de la enfermedad, y que ante la sospecha de resistencia adquirida a TKI se les había solicitado análisis sérico para resistencia en T790M. Un total de 30 muestras séricas fueron analizadas, se observó positividad para la mutación de resistencia en T790M en 50% de las mismas (n = 15).
En relación con las características sociodemográficas de los pacientes con positividad a la mutación de resistencia, se encontró que de 100% (n = 15), la edad promedio fue de 58 años; 53% (n = 8) eran de género femenino; 73.33% (n = 11) nunca fumadores y 86.67% (n = 13) sin ninguna exposición laboral reconocida (asbesto, biomasa o hidrocarburos). Sesenta y seis punto sesenta y siete por ciento (n = 8) tenía residencia en el centro del país (Tabla 1).
Tabla 1: Características sociodemográficas de pacientes con resistencia T790M a la progresión después de TKI en primera línea.
| Variable | n | % | |
|---|---|---|---|
| Edad (media) | 58 años | ||
| Género | |||
| Masculino | 7 | 46.67 | |
| Femenino | 8 | 53.33 | |
| Tabaquismo | |||
| Nunca | 11 | 73.33 | |
| Exfumador | 4 | 26.67 | |
| Actual fumador | 0 | 0 | |
| Exposición laboral | |||
| Sí | 2 | 13.33 | |
| No | 13 | 86.67 |
Nunca fumador: individuo que jamás ha fumado o ha fumado menos de 100 cigarrillos en toda su vida. Exfumador: individuo que ha fumado, pero ha cumplido 12 meses sin consumo. Actual fumador: individuo que continúa fumando. Los resultados son expresados en porcentaje de la muestra total de pacientes con CPCNP EGFR positivos con resistencia T790M demostrado por biopsia líquida (N = 15). Exposición laboral: antecedente de exposición a metales pesados, petróleo, material de biomasa diferente a humo de leña referido en historia clínica.
Con respecto al cuadro clínico de los pacientes con diagnóstico de adenocarcinoma pulmonar EC IV EGFR mutado sensible, y posteriormente con evidencia de mutación de resistencia en T790M a la progresión de la enfermedad, se encontró que 100% (n = 15) presentaba tos; 93.33% (n = 14) disnea; 80% (n = 12) pérdida de peso; 60% (n = 9) dolor torácico; y 6.67% (n = 1) reportó hemoptisis (no activa) al momento del diagnóstico de progresión de la enfermedad (Figura 3).
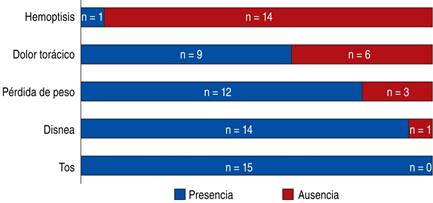
Figura 3: Síntomas clínicos a la progresión en pacientes con resistencia adquirida en T790M. La Figura muestra el número de pacientes que presentaba cada uno de los síntomas más frecuentes de cáncer de pulmón evaluados al seguimiento y en la progresión de la enfermedad.
El estado funcional valorado con la escala de ECOG en 93.33% de los pacientes al momento de la progresión era ≥ 2 (Figura 4).

Figura 4: Estado funcional de pacientes con resistencia T790M a la progresión después de TKI en primera línea.
El patrón histológico de la enfermedad y el exón de sensibilidad previo al momento del inicio de tratamiento con TKI de primera generación, se observó de la siguiente manera: 100% de pacientes estudiados con resultado de mutación positiva (n = 15), el patrón histológico en biopsia sólida (tejido pulmonar) diagnóstica fue: acinar en 53.33% (n = 8), lepídico en 20% (n = 3), sólido y papilar en 13.33% cada uno y no hubo registro de patrón micropapilar (Figura 5).

Figura 5: Patrón histológico del adenocarcinoma pulmonar EGFR mutado con resistencia adquirida T790M.
Los exones de sensibilidad en tejido pulmonar al inicio del tratamiento fueron en exón 19 en 93.33% (n = 14) y en el exón 21, en 6.67% (n = 1) de los casos.
En estudios de imagen por RECIST versión 1.1 se encontró PE por enfermedad medible en 73.4% (n = 11) de los pacientes; y en el resto derrame pleural maligno de nueva aparición 26.6% (n = 4) (Figura 6).
Al analizar el tiempo a la progresión de la enfermedad se construyeron curvas de Kaplan-Meier en pacientes con diagnóstico de adenocarcinoma pulmonar EC IV, con mutación de sensibilidad a TKI, y se recibió gefitinib/erlotinib en primera línea de tratamiento, lo que desarrolló resistencia adquirida en T790M, demostrada por biopsia líquida, alcanzando una mediana de supervivencia libre de progresión: 13 meses IC 95% 10-16 meses (Figura 7).

Figura 7: Supervivencia libre de progresión de pacientes con CPCNP EGFR (+) que recibieron TKI en primera línea y progresaron por resistencia en T790M.
Respecto a la toxicidad reportada, las más frecuentes fueron diarrea 66.67% (n = 10); dolor abdominal 80% (n = 12); náusea 20% (n = 3); y rash 73.33% (n = 11). Todas las toxicidades clínicas fueron grado 1 y 2. Las toxicidades grado 3 y 4 (hiperbilirrubinemia y transaminasemia) se presentaron en 26.67% (n = 4), que ameritaron suspensión temporal del tratamiento.
Discusión
El cáncer de pulmón es la causa más común de muertes relacionadas con cáncer; y el CPCNP representa alrededor de 85% de todos los tipos de cáncer de pulmón. Más de 70% de los pacientes con CPCNP tienen enfermedad avanzada al momento del diagnóstico, y el pronóstico por lo general es malo.1-3 Recientemente, se han desarrollado terapias moleculares dirigidas, que han aportado un beneficio notable a los pacientes con CPCNP con alteraciones genéticas específicas. En particular, el CPCNP con mutación en el gen del EGFR es sensible al bloqueo de EGFR con inhibidores específicos de TKI.4,5
El tratamiento con inhibidores de EGFR (EGFR-TKI) mejora la supervivencia general de los pacientes con CPCNP mutado. Los inhibidores de tirosina quinasa del receptor de crecimiento epidérmico (EGFR-TKI) de primera generación (p. ej. gefitinib y erlotinib) o los de EGFR-TKI de segunda generación (p. ej. afatinib y dacomitinib) son efectivos en el tratamiento, en especial en pacientes con deleciones de exón 19 o exón 21-L858R. Sin embargo, casi todos los casos experimentan recurrencia de la enfermedad después de uno o dos años, debido a la resistencia adquirida.11-13
Se han identificado varios mecanismos de resistencia a EGFR-TKI, y su comprensión es fundamental para el desarrollo de estrategias de tratamiento efectivas para el CPCNP resistente a EGFR-TKI. El principal mecanismo de resistencia adquirida informado es la mutación secundaria T790M en el exón 20, en el gen EGFR.14 Esta mutación secundaria mejora la afinidad de unión a ATP de las células mutadas por EGFR. Dado que los EGFR-TKI son inhibidores competitivos de ATP, su eficacia disminuye si hay mutación T790M. Otros mecanismos adicionales de resistencia incluyen: amplificación del gen MET, mutación PIK3CA, mutación BRAF, EMT y transformación del CPCP.15
Varios estudios han examinado los mecanismos y la frecuencia de la resistencia a EGFR-TKI; sin embargo, esto no había sido explorado en pacientes latinoamericanos. En una cohorte de Japón en 2016 por Ko et al., cuyo objetivo fue analizar las frecuencias de la resistencia adquirida a EGFR-TKI en T79M en pacientes japoneses con CPCNP, se observó una frecuencia de 34%.20
En la actualidad, se sabe que el tratamiento con EGFR-TKI mejora la supervivencia general de este tipo de pacientes. En población mexicana no se ha realizado ningún estudio que evalúe el perfil clínico epidemiológico con CPCNP mutado en EGFR que recibieron TKI en primera línea, y que hayan desarrollado resistencia adquirida en T790M con progresión de la enfermedad. En comparación con la cohorte japonesa previamente mencionada, la frecuencia de mutación de resistencia observada en este estudio fue de 50%, de un total de 30 pacientes analizados por biopsia líquida.20
Respecto al cuadro clínico de los sujetos, se encontró que al momento de la progresión 100% (n = 15) presentaba tos; 93.33% (n = 14) disnea; 80% (n = 12) pérdida de peso; 60% (n = 9) dolor torácico; y 6.67% (n = 1) reportó hemoptisis (no activa). A pesar de ser un país donde comorbilidades infecciosas respiratorias crónicas como la tuberculosis siguen siendo endémicas, ninguno de ellos tuvo este problema de salud como comorbilidad. Dentro del análisis clínico tampoco se detectó enfermedad pulmonar obstructiva crónica (EPOC) ni EPID como comorbilidades, consideradas datos clínicos relevantes, puesto que disminuyen la calidad de vida del paciente con cáncer de pulmón.
Respecto a la evaluación de las características clínicas y tomográficas, Koo et al. evaluaron una cohorte retrospectiva de 304 pacientes con CPCNP EGFR mutado, con resistencia por mutación en T790M y posteriormente rebiopsiados, y observaron que la ubicación del tumor periférico con convergencia vascular, la presencia de una etiqueta pleural y el broncograma aéreo de las lesiones pulmonares en TAC en el momento de la rebiopsia, se asociaron de manera significativa con la mutación T790M en individuos con CPCNP, después de la falla de tratamiento de primera línea.21
Huang et al. recientemente realizaron una investigación cuyo objetivo principal fue conocer la relación entre las características clínicas y la frecuencia de la mutación T790M en pacientes con CPCNP mutado en EGFR, y con resistencia adquirida después del tratamiento de primera línea con EGFR-TKI, y encontraron en una cohorte de 205 pacientes, una tasa de rebiopsia de cerca de 47% por sospecha de progresión secundaria a resistencia adquirida en T790M. De éstos con mutación previamente sensible, la más frecuente de ellas fue la deleción en exón 19, como en nuestra población. La SLP de EGFR-TKI de primera línea, el sitio de rebiopsia, la eliminación del exón 19 de EGFR y su subtipo del E746-A750 de mutación están asociados con la frecuencia de mutación T790M, según este estudio.22
La mediana de supervivencia libre de progresión observada en nuestra población fue de 13 meses. No se realizó seguimiento de los pacientes una vez que se indicó una segunda línea. El 73.33% (n = 11) recibió en segunda línea de esquema de paclitaxel/carboplatino y el resto 26.67% (n = 4) esquema de pemetrexed/carboplatino. No se registraron muertes a la progresión de la enfermedad.
Limitaciones del estudio
En primer lugar, nuestros resultados son de un solo centro; sin embargo, la frecuencia de resistencia en T790M encontrada es similar a la reportada a nivel mundial.
Segundo, no se realizó seguimiento de los pacientes para determinar la evolución clínica al desarrollo de la progresión de la enfermedad.
Conclusiones
En este estudio se encontró una frecuencia de resistencia adquirida a TKI en T790M en 50% de pacientes analizados. La mayoría fue de género femenino, nunca fumadores y en su mayoría tampoco se documentó ninguna otra exposición laboral de riesgo. La mediana de SLP fue de 13 meses para TKI de primera generación en primera línea de tratamiento, en pacientes seleccionados por EGFR mutado sensible. Estos resultados permitirán dar a conocer la importancia de la determinación de T790M en pacientes que reciben TKI en primera línea ante la progresión, y podrán ofrecer una segunda línea de tratamiento de manera temprana con implicación pronóstica y en calidad de vida.











 nueva página del texto (beta)
nueva página del texto (beta)