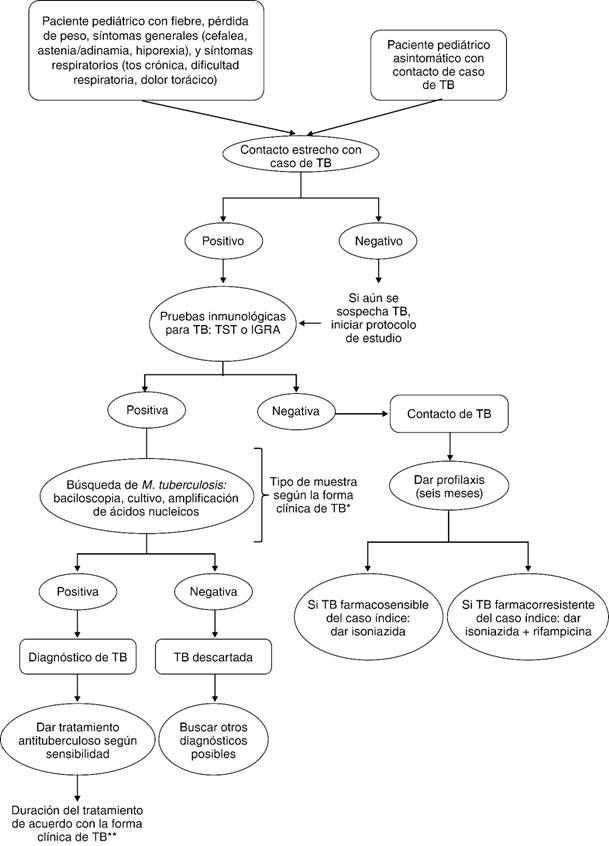
Introducción
La tuberculosis (TB) es una enfermedad infecciosa causada por Mycobacterium tuberculosis (M. tuberculosis), afecta principalmente los pulmones debido a que la vía de transmisión es aérea. La TB se considera un problema de salud pública por su distribución mundial. En el año 2016, la Organización Mundial de la Salud (OMS) registró 10.4 millones de casos nuevos de TB en todo el mundo, de los cuales el 56% se presentó en hombres, 34% en mujeres y 10% en niños, lo que genera un alto costo para diagnóstico y tratamiento de estos pacientes, que merma la economía de muchos países.1,2
La TB infantil abarca desde la infección primaria subsecuente a la exposición a M. tuberculosis, hasta la enfermedad. La primoinfección puede permanecer latente o evolucionar a la enfermedad activa de manera inmediata (primaria) o varios años después (secundaria), lo cual está determinado por diversos factores, como la edad, el estado nutricional e inmunológico del paciente, predisposición genética, las condiciones socioeconómicas y el antecedente de vacunación con BCG. En general, se estima que el 5% de las personas con TB latente desarrolla la enfermedad activa en los primeros dos años, siendo el grupo de edad con tasas más altas de morbilidad y mortalidad asociadas a TB.3 Aproximadamente 5-10% de los niños inmunocompetentes progresarán de la primoinfección a la enfermedad, y se puede determinar la gravedad de ésta según el tiempo que tarda en esta progresión (entre dos y 10 años, después de los cuales, la enfermedad es similar a la del adulto).4
A lo largo del tiempo, la trascendencia de la TB en niños ha sido difícil de medir; generalmente se infiere que es el reflejo de la enfermedad en adultos, pero la verdadera dificultad radica en la certeza del diagnóstico y el manejo adecuado a la edad de cada paciente.5,6 El diagnóstico temprano y el inicio oportuno de la terapia antituberculosa es determinante para el control efectivo de la TB. El retraso en el diagnóstico incrementa el riesgo de muerte y la transmisión del microorganismo en la comunidad.7
Las guías internacionales de diagnóstico y tratamiento de TB hacen referencia a la búsqueda del bacilo;8,9 sin embargo, el diagnóstico de TB infantil es complicado. La baciloscopia en expectoración es la única prueba de diagnóstico disponible en áreas endémicas, y se reporta positiva en más del 10-15% de los niños con sospecha de TB;10 el número de casos pediátricos detectables por cultivo también es bajo, alrededor del 30-40%.10 Existen reportes donde la identificación del bacilo en niños se logra sólo en el 19.2% de los casos,11 por distintos motivos como la naturaleza paucibacilar de las lesiones infantiles, la dificultad en la obtención de muestras y el tipo de muestras que se pueden obtener en niños menores de seis años (principalmente jugo gástrico). Para el diagnóstico de TB en niños con baciloscopia negativa, se considera 1) contacto cercano (intradomiciliario) con un adulto con TB (COMBE), 2) una prueba cutánea de tuberculina (TST, del inglés Tuberculin Skin Test) o ensayo de liberación de interferón gamma (IGRA, del inglés Interferon-Gamma Release Assay) positivos y 3) radiografía de tórax con signos compatibles con TB.10 Otro criterio es el cuadro clínico del paciente, caracterizado por tos persistente por más de dos semanas, falla para crecer documentada o pérdida de peso (a pesar del uso de suplementos alimenticios), fatiga y falta de mejoría clínica a pesar del uso de tratamientos antibióticos con esquemas adecuados.4 El uso de la TST como método diagnóstico de TB en niños presenta algunas limitantes, como su empleo en las comunidades donde se aplica BCG de manera universal al nacimiento, y en las poblaciones endémicas de micobacterias no tuberculosas.3,12 Los IGRA, basados en una respuesta de células T, ofrecen una prueba más específica, pero tienen la limitante de que requieren una gran cantidad de sangre (4-5 ml) y no distinguen adecuadamente entre pacientes pediátricos con infección activa y latente.13 Es posible que las diferencias inmunológicas entre los grupos de edad pediátricos14 generen una variación en el reconocimiento específico de los antígenos de M. tuberculosis,2 lo que sólo permite su detección en el 32% de los casos de pacientes menores de cinco años.10 Estas variaciones inmunológicas asociadas con la edad también modifican los hallazgos radiológicos de los pacientes con TB, y determinan la gravedad de las lesiones pulmonares, e incluso la diseminación de la enfermedad a otros órganos, ocasionando formas clínicas más graves, como la miliar y la meníngea.3,12
Las técnicas diagnósticas más novedosas para detectar M. tuberculosis han sido la microscopia de fluorescencia y las herramientas moleculares, como la amplificación del material genético del complejo M. tuberculosis15 e incluso la detección de algunos patrones genéticos de resistencia a fármacos antituberculosos.16 Sin embargo, en niños, la enfermedad paucibacilar limita la aplicación de estas nuevas tecnologías; además, la variabilidad alta de los resultados restringe su utilidad diagnóstica.10,17
Debido a lo anterior, la OMS ha sugerido algoritmos diagnósticos para TB infantil según los recursos económicos con que cuente cada país, pero finalmente, la decisión terapéutica se sustenta en tres pilares fundamentales: los síntomas del paciente, la radiografía de tórax o la TST, y el contacto cercano con una persona diagnosticada con TB, particularmente si es el cuidador primario del niño.12 Desafortunadamente, estos hallazgos clínicos, radiológicos e inmunológicos son muy variables y poco específicos en la TB infantil, lo que ocasiona que el diagnóstico y el tratamiento sean basados únicamente en la sospecha de la enfermedad, limitando las posibilidades terapéuticas cuando se trata de casos de TB multifarmacorresistente (TB-MDR).7,18
El objetivo de este trabajo es describir los casos de TB infantil que se atendieron en el Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas (INER) de la Ciudad de México en un período de dos años, los métodos diagnósticos y los criterios que se utilizaron para establecer el tratamiento de los pacientes debido a que, a pesar de la existencia de protocolos de actuación ante la sospecha de TB infantil, así como de distintos métodos para la búsqueda directa o indirecta de M. tuberculosis, el diagnóstico de TB en niños sigue siendo un problema de interés nacional.
Material y métodos
Pacientes
Se realizó una revisión en el archivo electrónico del INER para pacientes pediátricos con diagnóstico de TB en un período de dos años (2015-2017). Se incluyeron pacientes pediátricos de cero a 14 años 11 meses, que estuvieron hospitalizados en el Pabellón de Neumología Pediátrica del INER, cuyo diagnóstico de egreso fue «tuberculosis», según la Clasificación Internacional de Enfermedades (CIE-10).19 Se analizaron los expedientes clínicos de dichos pacientes para obtención de datos demográficos, clínicos y de laboratorio, así como el proceso diagnóstico de TB y la decisión terapéutica subsecuente. Este proyecto fue aprobado por los comités de Ciencia y Ética en Investigación del INER.
Análisis estadístico
Se describieron frecuencias simples, las cuales se presentan en porcentaje. Utilizando el programa SPSS Statistics (versión 22.0), se realizó un análisis de concordancia con la prueba Kappa de Cohen entre los diferentes métodos diagnósticos utilizados para TB en los pacientes estudiados, a saber: contacto estrecho con un caso de TB (COMBE), TST, baciloscopia, cultivo de micobacterias, prueba de amplificación de ácidos nucleicos de M. tuberculosis (Genexpert MTB/RIF, Cepheid Inc.) e IGRA (QuantiFERON TB Gold, Qiagen). Se consideró p < 0.05 como significancia estadística.
Resultados
Datos demográficos de los pacientes con diagnóstico de TB
Se encontraron 22 pacientes con sospecha de TB, de los cuales 10 (45.5%) eran del sexo masculino y 12 (54.5%) del femenino. El rango de edad fue de 17 meses a 15 años, con una mediana de seis años, (rango de 7.3 ± 4.7 años). En un paciente no se sospechó TB inicialmente, pero se obtuvo un cultivo positivo de micobacterias (M. intracellulare). La mayoría de los pacientes eran originarios y/o residían en la Ciudad de México y área conurbada del Estado de México. La mayor parte de los pacientes (63.6%) fue vacunada con BCG, y 13 pacientes (59.1%) tenían COMBE positivo, siendo la madre y el padre los contactos domiciliarios más frecuentes; seis pacientes convivían al mismo tiempo con dos personas con TB pulmonar.
Síntomas clínicos
En la historia clínica de los pacientes se encontró que los síntomas más frecuentes fueron la tos (63.6%), la fiebre (40.9%) y la pérdida de peso (27.2%), seguidos en menor frecuencia por los síntomas generales de cefalea, astenia/adinamia, hiporexia, y los síntomas respiratorios de dolor torácico y rinorrea. Un paciente (4.5%) se encontraba asintomático al momento del interrogatorio; fue hospitalizado para abordaje de TB por ser contacto de paciente con TB-MDR. La Tabla 1 muestra la descripción de las características clínicas de los pacientes estudiados.
Tabla 1: Características clínicas de los pacientes pediátricos con diagnóstico de tuberculosis.
| Signos y síntomas | Número de pacientes (%) |
|---|---|
| Generales | |
| Fiebre | 9 (40.9) |
| Pérdida de peso | 6 (27.2) |
| Cefalea | 4 (18.1) |
| Astenia/adinamia | 3 (13.6) |
| Hiporexia | 3 (13.6) |
| Diaforesis nocturna | 2 (9.1) |
| Ictericia | 1 (4.5) |
| Respiratorios | |
| Tos | 14 (63.6) |
| Dolor torácico | 4 (18.1) |
| Rinorrea | 4 (18.1) |
| Dificultad respiratoria | 3 (13.6) |
| Expectoración hemoptoica | 3 (13.6) |
| Estornudos | 2 (9.1) |
| Sibilancias | 2 (9.1) |
| Epistaxis | 1 (4.5) |
| Abdominales | |
| Dolor abdominal | 3 (13.6) |
| Diarrea | 2 (9.1) |
| Vómito | 2 (9.1) |
| Otros | |
| Aumento de volumen cervical | 2 (9.1) |
| Artralgias | 1 (4.5) |
| Asintomático | 1 (4.5) |
Pruebas clínicas e inmunológicas
Dentro del abordaje de los pacientes con sospecha de TB, se realizaron estudios de laboratorio como biometría hemática, química sanguínea, electrolitos séricos, pruebas de función hepática y tiempos de coagulación. Se encontró leucocitosis > 15,000 células/ml en cuatro pacientes (18.1% de los casos), con predominio de neutrófilos (hasta 91.7%). Siete pacientes (31.8%) tenían anemia con hemoglobina < 12 g/dl; el rango de medición de ésta fue de 7.5-15.5 g/dl. Un paciente (4.5%) tenía trombocitopenia leve y cuatro (18.1%) tenían trombocitosis; el rango de medición de las plaquetas fue de 103,000-809,000 células/ml. Se encontró un paciente con hipokalemia, la cual fue resuelta durante su estancia intrahospitalaria; el rango de medición del potasio fue de 1.89-5.3 mmol/l, el del sodio fue de 132-143 mmol/l y el del cloro fue de 95-111 mmol/l. Cinco pacientes (22.7%) presentaron hipoalbuminemia y sólo un paciente tenía elevación de todas las enzimas hepáticas. No se encontraron alteraciones en la química sanguínea ni en los tiempos de coagulación.
En 14 pacientes se realizó una evaluación inmunológica, cuyos resultados fueron normales de acuerdo con la edad de cada paciente. Estos estudios comprendieron la cuantificación de inmunoglobulinas séricas: IgA (rango 47.1-663 mg/dl), IgG (rango 658-2,930 mg/dl), IgM (rango 49.2-265 mg/dl) e IgE (rango 5.38-224 UI/dl), y de las fracciones del complemento: C3 (rango 52.8-181 mg/dl) y C4 (rango 7.01-52.5 mg/dl). En siete pacientes se cuantificaron también las poblaciones linfocitarias, utilizando los marcadores CD45+ (rango 737-7,334 células/ml), CD3+ (rango 369-4,393 células/ml), CD4+ (rango 142-2,573 células/ml) y CD8+ (rango 150-2,116 células/ml).
Diagnóstico de TB
En la Figura 1 se muestran las formas clínicas de TB que se presentaron en los pacientes pediátricos: pulmonar (14 casos, 63.6%), ganglionar (cuatro casos, 18.2%), pleural (dos casos, 9.1%), intestinal (un caso, 4.5%), pulmonar y ganglionar (un caso, 4.5%).
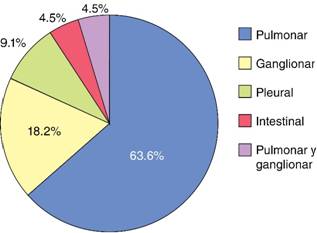
Figura 1: Formas clínicas de tuberculosis infantil diagnosticadas en el INER en el período 2015-2017.
Para el diagnóstico de TB se consideró el COMBE, el cual se encontró en 13 pacientes (59.1% de los casos). Dentro de las pruebas realizadas para diagnóstico de TB se encontraron las baciloscopias (utilizando la tinción de Ziehl-Nielsen y/o auramina-rodamina) en 18 muestras (excepto las de jugo gástrico), de las cuales sólo cinco fueron positivas (27.7% de positividad de la prueba). La prueba de amplificación del ácido nucleico de M. tuberculosis (Genexpert MTB/RIF, Cepheid Inc.) se realizó en 19 muestras y sólo en seis se detectó el microorganismo (31.5% de positividad de la prueba), sin presencia de genes de resistencia a rifampicina. La TST se aplicó en 16 pacientes (72.7% de los casos) y fue positiva en 12 casos (75% de positividad de la prueba). Para la realización de los procedimientos diagnósticos, los pacientes estuvieron hospitalizados en promedio 12 días. En la Figura 2A se describen los resultados de los estudios diagnósticos específicos para TB.
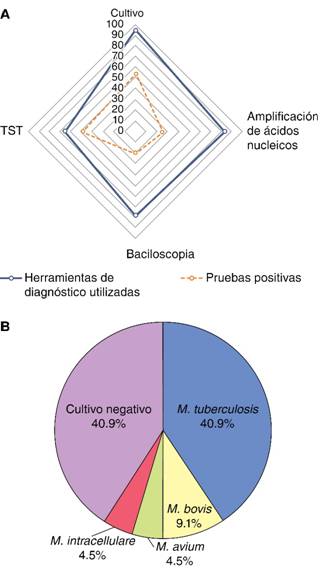
Figura 2: Diagnóstico de TB infantil. A: Herramientas de diagnóstico preferentemente utilizadas en los pacientes pediátricos del INER. La gráfica de araña muestra el porcentaje de los casos en los que se utilizaron y el porcentaje de casos positivos. B: Principales micobacterias causantes de TB en niños. Las pruebas diagnósticas se utilizaron en diferentes muestras clínicas (lavado broncoalveolar; expectoración; aspirado bronquial; biopsia de pulmón, pleura o ganglio; líquido pleural; jugo gástrico; sangre). TST, prueba cutánea de tuberculina.
A todos los pacientes se les realizó cultivo para micobacterias en diferentes muestras clínicas, como lavado broncoalveolar, expectoración, aspirado bronquial, jugo gástrico, líquido pleural, orina, sangre y tejido de biopsias (pleural, de pulmón y de ganglio), de acuerdo con la sintomatología y la factibilidad de obtener ciertas muestras según la edad de los pacientes; se obtuvieron 13 cultivos positivos (59.1% de positividad de la prueba), de los cuales nueve correspondieron a M. tuberculosis (Figura 2B). Únicamente a cinco pacientes se les tomó una muestra de tejido (biopsia), donde se realizó la tinción de Ziehl-Nielsen, además del cultivo, para evidenciar las micobacterias presentes en dichos tejidos. Esta tinción fue positiva en dos casos, lo que coincidió con el cultivo positivo de M. tuberculosis de esas muestras. Los reportes del estudio histopatológico de las biopsias únicamente refirieron alteraciones inflamatorias inespecíficas.
Enfermedades concomitantes y coinfecciones
Las enfermedades concomitantes fueron poco frecuentes en los pacientes pediátricos con TB. Dos pacientes (9.1%) tenían como enfermedades subyacentes proteinosis alveolar y crisis de ausencia.
Se encontró que los pacientes pediátricos presentaron coinfección de TB con otros microorganismos. En cinco pacientes se detectó la presencia de bacterias (Streptococcus pneumoniae, Stenotrophomonas maltophilia y Enterococcus faecalis) mediante cultivo, y de la misma manera se identificaron hongos (Paecilomyces sp. y Pseudallescheria boydii). Se diagnosticó infección por el hongo Coccidioides immitis mediante serología (IgG e IgM), y por el virus parainfluenza 2 mediante reacción en cadena de la polimerasa múltiple en muestra de hisopado nasofaríngeo. Seis pacientes fueron evaluados para infección por VIH, y sólo uno fue positivo con carga viral indetectable.
Tratamiento
A un paciente se le dio profilaxis con isoniazida durante seis meses por ser contacto de un caso de TB confirmada. A 16 pacientes se les dio tratamiento completo contra TB farmacosensible; dos pacientes fueron tratados con esquema de segunda línea por tener antecedente de contacto domiciliario con un caso confirmado de TB-MDR, a pesar de que no se documentó la presencia de la micobacteria en esos pacientes pediátricos. El tiempo de tratamiento antituberculoso fue de seis meses (12 pacientes), o un año (cinco pacientes). Para los pacientes que eran contactos de casos de TB-MDR, el tratamiento fue de nueve meses (un paciente) y 18 meses (un paciente).
A tres pacientes no se les dio tratamiento; uno tuvo todos los estudios de TB negativos, y dos no regresaron para la administración de tratamiento; de estos últimos, uno desarrolló un cultivo positivo para M. bovis y el otro para M. intracellulare.
Análisis estadístico
De las pruebas diagnósticas para TB, tres de ellas se basan en la detección de M. tuberculosis (baciloscopia, cultivo y amplificación del material genético micobacteriano). El análisis de concordancia entre estas pruebas reveló una concordancia de 70.9% (k = 0.709) entre los resultados de la baciloscopia y la amplificación de ácidos nucleicos, y una concordancia de 59.6% (k = 0.596) entre esta última y el cultivo.
Considerando el cultivo como la prueba estándar de oro para el diagnóstico de TB, dividimos los resultados en dos grupos: los que tuvieron cultivo positivo (13/22) y los que tuvieron cultivo negativo (9/22). De los pacientes que tuvieron cultivo positivo de TB, 76.9% tuvo positiva al menos una de las otras pruebas y sólo en 53.8% se detectó la presencia de micobacterias por amplificación de ácidos nucleicos o por baciloscopia. De los pacientes que tuvieron cultivo negativo para TB, 100% fueron positivos para TST o antecedente de COMBE, y sólo en 11.1% se detectó la presencia de micobacterias por amplificación de ácidos nucleicos o por baciloscopia.
Discusión
De los casos de TB en pacientes pediátricos que fueron diagnosticados en el INER, se observó que la frecuencia es similar en niños y en niñas. La forma clínica más frecuente en los pacientes pediátricos fue la pulmonar, seguida de la ganglionar, pleural e intestinal. A pesar de que la mayoría contaba con la vacuna BCG, no tuvieron una protección adecuada contra la infección.
Los signos y síntomas clínicos de los pacientes concuerdan con lo reportado en la literatura acerca de la TB,20 siendo los más frecuentes la tos, fiebre y pérdida de peso, similar al cuadro clínico de los adultos. Sin embargo, éstos son síntomas muy inespecíficos y no necesariamente sugieren el diagnóstico de TB, especialmente porque gran parte de las enfermedades infantiles son infecciosas y muchas de ellas se localizan en el tracto respiratorio, ocasionando los síntomas descritos. Durante el interrogatorio a los padres se debe hacer hincapié en la duración de los síntomas, ya que un padecimiento subagudo o crónico debe incrementar la sospecha de TB.
Es necesario resaltar la importancia de estudiar los contactos domiciliarios de pacientes con diagnóstico de TB, particularmente los niños, quienes son susceptibles a contraer la infección; aunque no desarrollen la enfermedad inmediatamente, y por la probabilidad de que adquieran las formas más graves y complejas de TB.
A todos los pacientes pediátricos se les evaluó el estado general de salud con exámenes de laboratorio (biometría hemática, química sanguínea, pruebas de función hepática, tiempos de coagulación); sin embargo, éstos presentaron pocas alteraciones, y es difícil determinar si éstas fueron debidas a la infección por TB ya que, por ejemplo, en algunos pacientes con alteraciones en la cuenta absoluta de células blancas se detectaron otros microorganismos concomitantes en las pruebas microbiológicas.
Respecto a la evaluación del estado inmunológico de los pacientes pediátricos, únicamente se realizó en siete individuos. Las pruebas realizadas fueron inmunoglobulinas séricas y las poblaciones linfocitarias CD4+ y CD8+; no se encontraron alteraciones en estas pruebas al analizar los datos de acuerdo con la edad de cada paciente. Sin embargo, es importante mencionar que se detectaron microorganismos concomitantes como bacterias (S. pneumoniae, S. maltophilia y E. faecalis), hongos (Paecilomyces sp. y Pseudallescheria boydii) y virus (parainfluenza 2), por lo que sería recomendable realizar una búsqueda exhaustiva de otras infecciones durante el abordaje del paciente con TB, debido a que la presencia de coinfecciones se puede asociar con un defecto inmunológico primario. Se ha descrito que existen inmunodeficiencias primarias que se asocian con susceptibilidad a la infección por micobacterias,21 como los defectos en el eje de interleucina-12/interferón gamma,22 y la enfermedad granulomatosa crónica,23 entre otros. De acuerdo con lo anterior se debería realizar un escrutinio inmunológico en los pacientes pediátricos con sospecha de TB, para orientar al diagnóstico temprano de inmunodeficiencias primarias y disminuir la incidencia de complicaciones secundarias a infecciones mal controladas en estos pacientes.
Respecto al diagnóstico de TB, es interesante observar que sólo en 59.1% de los casos se obtuvo confirmación microbiológica por cultivo. Únicamente 15.4% del total de los pacientes tuvo positivas todas las pruebas diagnósticas de TB (cultivo, baciloscopia, TST y la detección molecular de M. tuberculosis). Estas pruebas son empleadas cotidianamente para diagnóstico de TB y se consideran alternativas cuando no es posible obtener desarrollo en el cultivo, además de que el resultado de ellas se puede obtener más rápido. En cuatro de los pacientes estudiados sólo fue positivo el cultivo, aunque sí se realizaron otras pruebas, lo cual nos permite establecer la necesidad de un algoritmo que pondere la importancia de cada una de las técnicas para el diagnóstico de TB en niños.
Las técnicas más novedosas para diagnóstico de TB, como el IGRA, que utiliza antígenos específicos de M. tuberculosis, aún no se realiza de manera sistemática para el diagnóstico de los pacientes en todos los hospitales. En niños aún no se ha determinado un punto de corte adecuado que permita distinguir la infección activa de la infección latente,24-26 por lo que todavía se requiere estandarizar el uso de esta técnica para su implementación habitual en la práctica clínica. En esta investigación observamos que únicamente a dos pacientes se les realizó el IGRA, por lo que no fue posible determinar la contribución de este tipo de pruebas en nuestra población de estudio. Se sugiere utilizar esta prueba más frecuentemente como parte del diagnóstico de TB en niños.
Existen otras técnicas de inmunodiagnóstico que aún se encuentran en investigación, donde evalúan la utilidad de biomarcadores para diagnóstico y seguimiento de TB pulmonar. Una de ellas es la proteína de 10 kDa inducible por interferón gamma (IP-10 o CXCL10), cuyos resultados son más consistentes que los de otras pruebas como los IGRA. Sin embargo, el biomarcador IP-10 aún no ha sido validado en la práctica clínica pediátrica y no existe un consenso sobre el punto de corte para distinguir infección activa de infección latente en niños, sobre todo como prueba diagnóstica única. Se espera que, en un futuro próximo, estos biomarcadores puedan ser una alternativa a las pruebas actuales.27
Es importante destacar que para poder evaluar adecuadamente todas las técnicas diagnósticas en niños, deberíamos considerar cada una de las formas clínicas de TB individualmente, pues es diferente la carga micobacteriana según la muestra clínica utilizada. En este estudio observamos gran variedad de presentaciones clínicas a pesar de ser una población pequeña, lo que limita el número de casos por cada forma de TB. Se requiere el desarrollo de un algoritmo diagnóstico para TB infantil, preciso, reproducible, y que se encuentre disponible en los distintos escenarios de atención médica de esta enfermedad.
Finalmente, durante este estudio observamos que el tratamiento para TB es otorgado al paciente tomando en cuenta principalmente el criterio epidemiológico, es decir, si existe contacto con un adulto tosedor crónico, aun cuando el paciente haya tenido un resultado negativo en las pruebas diagnósticas para TB; esto es una práctica común que se refiere en la literatura,12 y también sucedió en cinco de los pacientes estudiados, en quienes se indicó tratamiento completo únicamente basado en el antecedente de COMBE; a uno de ellos, incluso se le administró tratamiento contra TB-MDR. En dos de estos pacientes, la única prueba positiva fue la TST, la cual podría resultar positiva por la aplicación cercana de la vacuna de BCG.
Desafortunadamente no existen ensayos clínicos aleatorizados en población infantil que ayuden a la importante decisión clínica de dar tratamiento completo, ofrecer profilaxis o sólo mantener vigilancia ante la sospecha de TB latente infantil.28-30 Por ello, con base en la información científica disponible en la literatura proponemos un sencillo algoritmo diagnóstico que podría ser útil en la práctica clínica diaria de quienes atienden pacientes pediátricos con sospecha de TB activa, el cual se muestra en la Figura 3.
Conclusión
El diagnóstico de TB infantil representa un gran reto en la práctica clínica, debido a que las técnicas diagnósticas utilizadas son variables en la población pediátrica. Las pruebas inmunológicas para TB (TST, IGRA) no se evalúan en todos los niños, y las pruebas microbiológicas para la búsqueda del bacilo dependen de la cantidad de microorganismos (menor en pacientes pediátricos) y el tipo de muestra disponible para el diagnóstico, así como de la forma clínica de la enfermedad. Es necesario realizar un escrutinio exhaustivo en los niños con sospecha de TB, así como en los que son contactos de pacientes con TB, para definir si son portadores de una enfermedad latente o si padecen la enfermedad activa, para ofrecer la opción terapéutica adecuada a cada caso. Asimismo, se sugiere evaluar si existe una susceptibilidad inmunológica a la infección con M. tuberculosis, particularmente ante la presencia de coinfecciones con otros microorganismos.











 text new page (beta)
text new page (beta)