Introducción
La paracoccidioidomicosis (PCM) es una patología frecuente en Colombia, según los registros individuales de la prestación de servicios de salud (RIPS) reportados en el sistema integral de información de la protección social (SISPRO), desde 2005 a 2016 se notificaron 1,652 casos de PCM de todos los tipos.1 Es considerada endémica de países sudamericanos como Brasil, Argentina, Venezuela y Colombia; sin embargo, en nuestro país, su notificación no es obligatoria. En el año 2000, se publicó un estudio de prevalencia de PCM en Colombia basado en los reportes de laboratorios clínicos y de patología, donde se estableció una mayor prevalencia de casos en la región andina (Antioquia, Santander, Cundinamarca, Boyacá, Caldas y Huila).2 Es ocasionado por el Paracoccidioides brasiliensis descrito en 1908 por el doctor Lutz en Brasil; sin embargo, mediante métodos moleculares se han reportado tres especies diferentes S1 (en Brasil, Argentina, Paraguay, Perú y Venezuela), S2 (P. lutzii de Brasil y Venezuela) y S3 (Colombia) con diferentes perfiles, manifestaciones clínicas, respuesta al tratamiento y epidemiología.3-5
El hongo habita en bosques tropicales y subtropicales, húmedos y cercanos a fuentes de agua y se contrae en zonas rurales, clásicamente, por agricultores que inhalan las conidias (propágulos), que en el tracto respiratorio inferior pasan a formas levaduriformes (infectantes), que son reconocidas y fagocitadas por las células mononucleares y, en la mayoría de los casos, la infección es controlada.4-6 En menos del 10% de los casos ocurre una progresión primaria, especialmente en niños, adolescentes y adultos jóvenes, donde hay compromiso marcado y rápido del sistema linforreticular, intestinal, hueso y médula ósea. En otros casos, la infección latente puede progresar de forma tardía, con compromiso pulmonar, de piel y mucosas, que puede ser leve, moderada o severa, y asociarse con pérdida de peso, neumonitis intersticial, neumonía e insuficiencia suprarrenal, que, en ocasiones, puede conducir a la muerte.7 El tratamiento se enfoca de conformidad con la severidad de las manifestaciones y el grado de compromiso sistémico basado en síntomas y signos, como la pérdida de peso > 10% y la fiebre,8,9 aunque la severidad del compromiso pulmonar en algunos casos no se correlaciona con la severidad clínica, por lo que, para establecer un tratamiento hospitalario basado en la severidad, debería tener en cuenta el compromiso radiológico.10
Presentación de caso
Hombre de 66 años originario de San Gil-Santander de ocupación cepillador de madera durante 32 años y cesante desde seis meses antes de su ingreso, quien consulta al Hospital Universitario de Santander en febrero de 2018 por clínica de seis meses de pérdida de peso progresiva de 37 kg (36% del peso corporal inicial), astenia, adinamia e hiporexia. Dos meses después, tuvo aparición de tos con expectoración mucoide blanquecina, disnea de esfuerzo e incluso en reposo durante las noches, así como diaforesis nocturna ocasional, sin fiebre.
Como antecedentes: esteatosis hepática no alcohólica, enfermedad diverticular del colon no complicada, hemorroides, gastritis crónica antral moderada difusa en manejo con omeprazol. Tuvo exposición a polvo de madera por 32 años. Adicionalmente, reportó su vivienda urbana, sin contacto con animales de granja o mascotas; sin embargo, en su juventud temprana se dedicó a la agricultura.
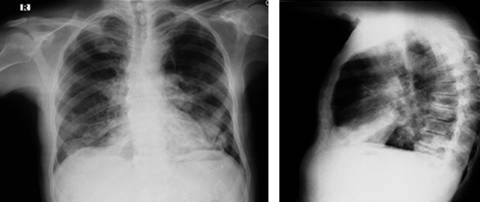
Un mes previo al ingreso hospitalario estuvo hospitalizado por neumonía multilobar y recibió manejo con piperacilina/tazobactam más vancomicina por seis días (Figura 1); pero, luego de terminar el ciclo de antibióticos y ante la no mejoría clínica, se remitió a la consulta de neumología con propuesta de fibrobroncoscopia al no haber identificado agente etiológico. Las baciloscopias fueron negativas y no se realizaron cultivos.
Fue valorado por neumología, se realizó fibrobroncoscopia con lavado broncoalveolar en el enfoque diagnóstico de neumonía crónica. No se recomendó nuevo ciclo antibiótico ante la estabilidad clínica y estudios microbiológicos hasta el momento negativos. Se envió para manejo ambulatorio en espera de resultados. Posteriormente, ante empeoramiento de la disnea y la tos, consultó a un hospital intermedio, se internó con la hipótesis diagnóstica de neumonía, donde recibió manejo con piperacilina tazobactam durante tres días, pero se suspendió debido a que se obtuvo el resultado del lavado broncoalveolar con presencia de levaduras multigemantes con cuello angosto formando la imagen de «Mickey Mouse» o «timón de barco» compatibles con Paracoccidioides spp (Figura 2). Se envió manejo con itraconazol a razón de 200 mg al día, en suspensión, luego continuó el tratamiento con la presentación en cápsulas. Dos semanas después, en control ambulatorio con neumología en el Hospital Universitario de Santander, se encontró con taquipnea y disnea de pequeños esfuerzos, por lo que se remitió a hospitalización con la indicación de anfotericina B ante impresión diagnóstica de PCM severa con pobre respuesta al itraconazol oral.

Figura 2: Extendido de lavado broncoalveolar, levaduras multigemantes compatibles con Paracoccidioides spp. A: Tinción de base en plata metenamina. B: Tinción de base en ácido peryódico de Schiff.
Al examen físico se observó un paciente con delgadez, facies hipocrática, frecuencia cardíaca de 94 lpm, oximetría de pulso de 93% al aire ambiente, frecuencia respiratoria de 26 rpm, tensión arterial de 140/77 mmHg, temperatura de 36.3 oC. El examen de cabeza y cuello sin alteraciones; en el tórax: pectus excavatum con tirajes intercostales, ruidos cardíacos rítmicos de baja intensidad, ruidos respiratorios con estertores finos bibasales, frémito vocal-táctil normal y claro pulmonar. Abdomen sin alteraciones. Extremidades dentro de parámetros normales. Piel sin hallazgos de importancia. El examen neurológico no mostró alteraciones particulares.
El examen macroscópico de la vía aérea por fibrobroncoscopia fue normal.
Paraclínicos: gases arteriales: pH: 7.39, pCO2: 37.1 mmHg, pO2: 64.7 mmHg, SO2: 91.8%, HCO3: 22.2 mmol/l; HHB: 8.1%; FiO2: 21%; BE: -2.20 mmol/L; proteína C reactiva: 98.30 mg/l; creatinina: 1.09 mg/dl; BUN: 22.60 mg/dl; Elisa VIH de cuarta generación: negativo; hemograma: Hb 12.8 g/dl, Hcto: 41.4%, leucocitos: 14,410 células/mm3, N: 57%, L: 34%, plaquetas: 432,000/mm3; cultivo de esputo: negativo a las 48 horas de incubación; baciloscopias #1, 2 y 3: no se observan bacilos ácido alcohol resistentes; Genexpert de esputo: negativo para Mycobacterium tuberculosis; Gram de esputo: no representativo con abundante microbiota mixta y escasas blastoconidias.
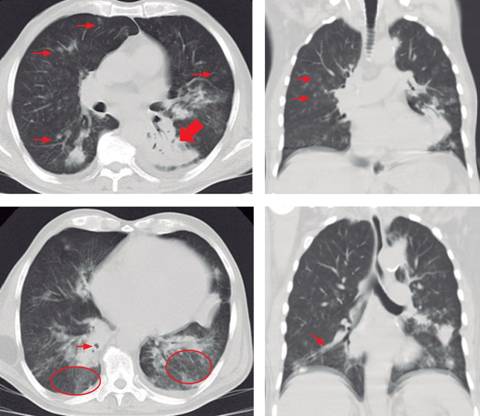
La tomografía simple de tórax mostró micronódulos centrolobulillares bilaterales, patrón de vidrio esmerilado en segmentos superiores de los lóbulos inferiores, cavitaciones basales derechas, engrosamiento peribroncovascular y consolidación basal izquierda (Figura 3).
Discusión
Aunque la PCM es una enfermedad prevalente en Colombia, su reporte no es obligatorio, por lo que el comportamiento de la enfermedad a través de los años en el país es desconocido, y sus datos se limitan a estudios de investigación y series de casos. Si bien, no por ello deja de ser una enfermedad importante, pues supone para el clínico un reto diagnóstico donde su alta sospecha es la principal herramienta clínica. En Colombia, al revisar las publicaciones sobre la enfermedad, se encontraron 43 desde 1970 hasta el 2017, de las cuales, el 41% corresponden a reportes de caso, el 32% a series de caso, 18% productos de investigación molecular y los restantes a publicaciones varias. Entre los reportes y series de casos se reportan 2,413 casos en estos 47 años, aproximadamente 51 casos por año.
En nuestro caso clínico, el diagnóstico etiológico fue difícil, pues, a pesar de que el paciente procedía de una zona endémica de PCM, no tenía historia de actividades agrícolas, tal y como se describe en la literatura,3 y su diagnóstico se logró en el abordaje de una neumonía multilobar crónica, con la toma de muestras respiratorias a través de endoscopia. Asimismo, en este caso, se descartó la coinfección con tuberculosis, que podría empeorar la respuesta al tratamiento y empeorar el pronóstico, teniendo en cuenta que se ha descrito coinfección con tuberculosis hasta en el 8% de los casos de PCM.11 Por lo tanto, se ha presentado un caso de PCM pulmonar crónica severa sin afectación extrapulmonar y sin disociación clínico-radiológica. Aproximadamente, el 30% de los pacientes con compromiso pulmonar puede ser asintomático respiratorio a pesar de un compromiso significativo en las imágenes del tórax, contrario a lo observado en nuestro caso.12 En este sentido, en la definición de la severidad de la enfermedad debe incluir los criterios clínicos y radiológicos con el fin de elegir la modalidad de tratamiento, la necesidad de hospitalización y mejorar los desenlaces clínicos.
Luego de revisar la literatura, en el momento no se ha validado una herramienta que permita predecir la severidad de la infección en conformidad con el grado de compromiso radiológico, y con ello definir la necesidad de tratamiento parenteral (por ej., anfotericina B).13 Se ha evaluado la utilidad de la gammagrafía con Galio en el seguimiento de las lesiones inflamatorias en la PCM, con mejores resultados al compararse con el seguimiento clínico-radiológico y serológico, que es la modalidad más aplicada en la práctica;14 no obstante, el costo podría ser mayor y no se ha definido su papel en el establecimiento de la gravedad del proceso infeccioso al momento del diagnóstico o durante seguimiento.











 text new page (beta)
text new page (beta)