Introducción
La gasometría arterial (GA) es una prueba que permite analizar, de manera simultánea, el estado ventilatorio, el estado de oxigenación y el estado ácido-base.1 Se realiza en una muestra de sangre arterial; no obstante, en circunstancias especiales, también se puede realizar en sangre venosa periférica o sangre venosa mezclada.2,3 En este documento se hará referencia a la GA que se realiza en pacientes estables que acuden a un laboratorio de fisiología respiratoria.4 El procedimiento que se describe a continuación forma parte de la metodología estandarizada que utilizamos en nuestro centro para la realización de la GA.
La GA proporciona mediciones directas de iones hidrógeno (pH), presión parcial de oxígeno (PaO2), presión parcial de dióxido de carbono (PaCO2) y saturación arterial de oxígeno (SaO2). Además, con el respaldo tecnológico apropiado, se puede medir la concentración de carboxihemoglobina (COHb) y metahemoglobina (MetHb). La concentración de bicarbonato y el exceso de base efectivo no son medidos de manera directa, son valores calculados.2 Algunos gasómetros miden también electrolitos séricos, lactato, glucosa, entre otros aniones y ácidos débiles.5
Indicaciones y contraindicaciones
La GA es el estándar de oro para diagnosticar anormalidades en el intercambio gaseoso y del equilibrio ácido-base.1 La GA es de utilidad en la evaluación de pacientes críticamente enfermos o pacientes estables con enfermedades respiratorias crónicas. En este último grupo es especialmente útil para analizar la necesidad de prescribir oxígeno suplementario o ventilación no invasiva en caso de insuficiencia respiratoria crónica. La GA también ayuda en el seguimiento de pacientes que han recibido intervenciones de diversas índoles, farmacológicas y no farmacológicas (v.gr. ejercicio), para conocer el efecto de las mismas.
Algunas contraindicaciones para realizar una GA incluyen: a) prueba modificada de Allen negativa; es decir, ausencia de circulación colateral; b) lesión o proceso infeccioso en el sitio de punción, c) ausencia de pulso en la zona donde se planea llevar a cabo la punción arterial, d) presencia de fístula arteriovenosa (tratamiento con hemodiálisis) en el sitio considerado para la punción y e) coagulopatía o anticoagulación con dosis medias-altas.
Equipamiento y consumibles para llevar a cabo el procedimiento de gasometría
1. Jeringas de plástico o cristal desechables diseñadas para almacenar volúmenes entre 1 y 3 mililitros.
2. Agujas.6
2.1. Se recomienda utilizar agujas hipodérmicas.
2.2. El tamaño de la aguja debe ser entre 20 y 23 Fr.
3. Anticoagulante.7
3.1. Utilizar Jeringas preheparinizadas.
3.2. En caso de no contar con dispositivos pre-heparinizados, cada jeringa deberá contener heparina no fraccionada (0.1 mL de una solución de 1000 UI/mL) previo a realizar el procedimiento.
4. Soluciones antisépticas.
5. Toda muestra de sangre obtenida fuera del laboratorio, remitida para el análisis gasométrico deberá estar adecuadamente etiquetada con al menos dos de los siguientes:
5.1. Nombre completo del paciente y fecha de nacimiento.
5.2. Cama del paciente (pacientes hospitalizados).
5.3. Registro hospitalario.
5.4. Fecha y hora de la toma de muestra.
5.5. Tipo de sangre: arterial, venosa periférica, venosa mezclada, capilar.
5.6. Fracción inspirada de oxígeno (FiO2, idealmente aire ambiente; es decir, 0.21).
5.7. Temperatura corporal del paciente durante la toma de la muestra.
6. Gasas estériles.
7. Contenedor de desechos resistente a punzocortantes.
8. Guantes estériles.
9. Equipo de protección ocular.
10. Dispositivo descansa-brazo.
11. Anestésico tópico.
Preparación del analizador de gases antes de la prueba
1. Todos los componentes (mangueras, sensores, conectores, etc.) deben ser ensamblados, de acuerdo con las instrucciones del fabricante.
2. Realizar mantenimiento preventivo acorde a los lineamientos del fabricante.
3. Se debe encender el equipo y dar tiempo suficiente para el calentamiento del mismo.
4. Calibración de gases y buffers (amortiguadores) con grado médico trazado acorde a los lineamientos internacionales.
5. El material de calibración debe reunir los requisitos reconocidos y estandarizados por organizaciones nacionales.
5.1. Los materiales de calibración deben ser etiquetados con fecha de recepción, uso y caducidad.
5.2. Todo nuevo material de calibración debe ser validado o verificado.
5.3. Debe realizarse un control de calidad para cada nuevo lote de calibración.
6. Ejemplo para calibración a dos puntos.
6.1. Verificar la temperatura del analizador, debe estar a 37 ± 0.1 oC.
6.2. Verificar la presión barométrica del analizador; debe cotejarse de acuerdo con la altitud en la que se labora.
6.3. Mostrar la lectura de la presión barométrica en el analizador.
6.4. Iniciar una calibración a dos puntos.
6.5. Purgar gases de calibración y buffers (amortiguadores).
6.6. La calibración 1 se realiza utilizando un pH 7.348 y una mezcla de gas que contenga O2 al 20% y CO2 al 5%.
6.7. La calibración 2 se realiza utilizando un pH 6.840 y una mezcla de gases que contenga O2 al 0% y CO2 al 10%.
Calibración o verificación del gasómetro
1. Control de calidad interno.1
1.1. Establecer el promedio con desviación estándar (DE) para cada componente (pH, PaCO2, PaO2) en cada nivel para el nuevo número de lote del material comercial para el control de calidad.
1.1.1. Analizar un número adecuado de muestras para el nuevo lote de muestreo.
1.1.2. Analizar estadísticamente los valores para cada componente en cada nivel con promedio y DE.
1.1.3. El rango aceptable para cada componente debe ser definido previamente y consistente con las necesidades para identificar anormalidades clínicas.
1.2. Los datos del control de calidad para cada lote comercial deben ser reportados mensualmente y en conjunto de forma anual.
1.3. El director o encargado del laboratorio definirá el rango aceptable para el control de calidad basado en los datos estadísticos o criterios médicos.
1.4. El control de calidad debe ser analizado cada ocho horas.
1.4.1. La frecuencia de cada control y los niveles de calibración dependerán de las recomendaciones del fabricante.
1.4.2. Se debe realizar como mínimo una calibración a un nivel cada ocho horas y a dos niveles cada 24 horas.
1.5. Cuando una medición sobrepasa el promedio con 2 DE se genera una alerta y la calibración debe repetirse.
1.6. Se genera un aviso «Calibración fuera de control» cuando:
1.6.1. Una medición excede el promedio con 3 DE.
1.6.2. Dos mediciones consecutivas exceden el promedio con 2 DE.
1.6.3. Cuatro mediciones consecutivas exceden el promedio con 1 DE en la misma dirección.
1.6.4. Diez mediciones consecutivas caen al mismo lado del promedio.
1.7. Con la presencia de un aviso «Calibración fuera de control», el equipo debe someterse a mantenimiento antes de procesar una nueva muestra
1.8. Mantener los registros del control de calidad al menos por dos años (o el tiempo que lo defina las agencias reguladoras)
Preparación del paciente para la prueba
El técnico que ejecuta la prueba debe recibir y presentarse ante el paciente.
Confirmar la orden emitida por el médico solicitante para la ejecución de la prueba, cerciorándose que se trate del paciente (nombre completo y fecha de nacimiento).
Explicar al paciente de forma clara y explícita el objetivo de la prueba. Puede emplearse la frase: «La gasometría arterial es una prueba que sirve para medir la cantidad de oxígeno que hay en la sangre. Para ello es necesario tomar una muestra de sangre mediante la punción de una arteria del brazo».
Una vez explicado el procedimiento a realizar se debe obtener la firma del consentimiento bajo información para llevar a cabo la prueba.
Todo personal capacitado que realice una GA deberá conocer los riesgos del procedimiento y las precauciones que deben tomarse para minimizarlos.
Por cuestiones de comodidad, la prueba se debe realizar con el paciente sentado.
Ejecución de la prueba
-
3.1 Ejecución de la maniobra de Allen modificada: solicitar al paciente que realice varias maniobras de apertura y cierre de la mano que será sometida a la toma de muestra. El personal que realice el procedimiento deberá realizar presión en las arterias radial y cubital con el objetivo de obstruir el flujo sanguíneo. Indicar al paciente que mantenga abierta la palma de la mano e inmediatamente liberar la presión de la arteria cubital. Observar el retorno de la coloración habitual que no debe exceder a 10 segundos y ser considerada como prueba positiva para la presencia de adecuada circulación colateral (Figura 1).

Figura 1: Maniobra de Allen. Panel A: inicia la compresión de las arterias radial y cubital. Panel B: cambio en coloración (palidez) derivado de la oclusión. Panel C: retiro de la compresión en arteria cubital manteniendo oclusión de arteria radial. Panel D: retorno de la coloración normal en el sitio de irrigación de la arteria cubital, prueba positiva para circulación colateral.
1. Se puede obtener la muestra sanguínea de la arteria femoral, humeral o pedia; no obstante, el sitio más común es la arteria radial. Exceptuando condiciones que dificulten la toma de la muestra, se recomienda la arteria radial de la extremidad no dominante.
2. Colocar la extremidad en dorso flexión (ángulo de 45 grados) sobre un respaldo plano.
3. Realizar la Maniobra de Allen modificada con el objetivo de conocer si las arterias radial y cubital son permeables.
3.2. Al confirmar la presencia de una adecuada circulación colateral, se lleva a cabo la desinfección del área (2 centímetros cuadrados) donde se realizará la punción arterial empleando soluciones antisépticas (iodopovidona en solución o clorhexidina al 2%) durante 2 minutos.
3.3. El empleo de anestésico local es opcional. No obstante acorde con un estudio publicado, este último no es recomendable.8
4. En caso de que el paciente utilice oxígeno suplementario, éste deberá ser suspendido por al menos 20 minutos previo a la toma de muestra. En caso de que el paciente presente síntomas al retirar el oxígeno se deberá notificar al director médico del laboratorio para la mejor toma de decisión relacionada con el procedimiento.
5. El personal encargado del procedimiento deberá cerciorarse que las jeringas preheparinizadas se encuentren debidamente empaquetadas. En caso de jeringas no preheparinizadas, deberá lubricar el contenedor de la jeringa empleando heparina 0.1 mL (dilución 1:1,000 UI/mL).7
6. Localizar el sitio de punción palpando el pulso de la arteria.
7. Mientras continúa palpando el pulso, deberá utilizar la mano con mayor habilidad para llevar a cabo la punción de la arteria colocando la aguja adaptada a la jeringa con un ángulo de 45 grados en sentido rostral (contrario al flujo sanguíneo).
8. Al finalizar el procedimiento retirar la jeringa y comprimir con una gasa limpia y seca a una distancia de 1 o 2 centímetros del sitio de punción, en sentido proximal o rostral para vigilar complicaciones inmediatas. Se sugiere no comprimir directamente en el orificio del sitio de punción.
9. Se sugiere comprimir durante un tiempo de 3 minutos para minimizar las complicaciones.
10. La muestra obtenida debe ser mezclada continuamente utilizando las palmas de las manos en sentido rotatorio.
Procesamiento de la muestra
Al extraer la muestra de sangre arterial deberá agitarse para lograr una mezcla homogénea con la heparina y evitar la formación de coágulos que pueden modificar los resultados.
El tiempo máximo de retraso para analizar la muestra obtenida en jeringas de plástico es de 30 minutos con temperaturas ambientales de 22 oC.9 En caso que ocurran demoras mayores, la sugerencia es almacenar en envases de cristal o utilizar congelantes para su traslado.10
-
En el analizador de gases arteriales (Figura 2), seleccionar la cantidad de muestra a procesar (se requiere entre 95 y 200 μL para realizar un adecuado análisis).
Previo a introducir la muestra en el receptáculo para su análisis, deberá cerciorarse que la jeringa se encuentre libre de burbujas.11
Abrir el receptor de muestra del analizador y colocar la jeringa para que la sangre sea aspirada. Retirar la jeringa en el momento que lo solicite el analizador y cerrar el receptor.
Al finalizar el aspirado de la muestra, la jeringa deberá depositarse en el contenedor resistente a punzocortantes correspondiente.
Anotar los datos demográficos del paciente en cuestión, no olvidar la fracción inspirada de oxígeno que en condiciones ambientales es de 0.21 (21%).
Registro de la temperatura corporal. Cada laboratorio debe contar con un lineamiento para ajustar los resultados de la gasometría a la temperatura corporal del paciente. Pueden existir errores en los resultados de la muestra durante el procesamiento debido a la inclusión de un registro aleatorio de la temperatura. No hay datos disponibles que cuantifiquen la diferencia entre la entrega y consumo de oxígeno a temperaturas diferentes de 37 oC. No se recomienda llevar a cabo de rutina ajustes por temperatura.12 Los escenarios donde puede tener utilidad son todos los relacionados con proyectos de investigación (v.gr. prueba de ejercicio cardiopulmonar).
Imprimir el informe verificando que los resultados sean consistentes. En caso contrario, deberá aparecer un informe en la pantalla, habitualmente en color rojo, lo cual es indicativo de un nuevo análisis.
Complicaciones del procedimiento de gasometría
Espasmo de la arteria puncionada.
Reacciones vasovagales y síncope.
Hematoma (mayor riesgo con punciones múltiples no exitosas).
Trombosis arterial.
Trauma vascular (la lesión más grave ocurre al desgarrar la pared de la arteria, es un evento muy raro; no obstante, para disminuir el riesgo se debe introducir la aguja en línea recta, evitar en todo momento oscilaciones de la aguja durante el intento de puncionar la arteria).
Infección.
Reacción alérgica al anestésico.
Hemorragia.
Dolor en sitio de punción.
Parestesias durante o posterior a la punción (síntomas de lesión temporal del nervio correspondiente a la arteria intervenida. Se sugiere retirar la aguja y reintentar la punción).
Seguridad y control de infecciones13,14
Seguir las precauciones universales para la toma de muestras sanguíneas.
Utilizar guantes.
En caso de contacto con sangre, deben lavarse inmediatamente.
Reportar inmediatamente (al Departamento de Epidemiología Hospitalaria) accidentes ocasionados por punción no intencionada.
Depositar agujas, jeringas y muestras de sangre en contenedores correspondientes.
Trabajadores encargados del proceso de las muestras de gasometría deben recibir inmunización contra hepatitis B.
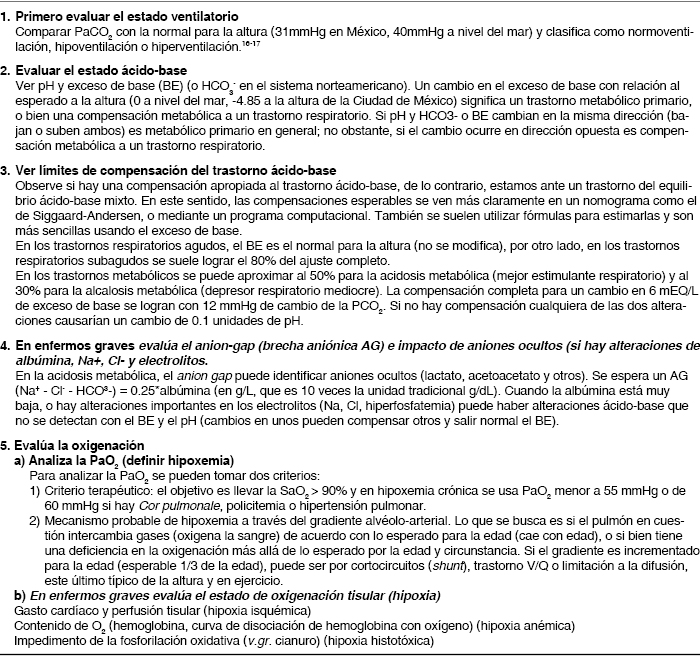
Proceso de interpretación básica
La interpretación clínica de la GA se escapa de los alcances de este manuscrito remitimos al lector a documentos complemenatrios.15-18 La interpretación debe incluir la evaluación del estado ventilatorio, ácido-base y de oxigenación de una manera ordenada y sistemática (Tabla 1). Es importante registrar la temperatura del paciente, porque si la temperatura difiere de 37 oC, el estado in vivo podrá ser muy diferente al estado in vitro (al medir la gasometría). Habitualmente, los gasómetros trabajan con las muestras a 37o, luego entonces, sino ratifican la temperatura corporal del paciente en el momento de la toma de muestra, se modifican los valores de los gases de lo que esta pasando in vivo, particularmente, si la temperatura del paciente difiere mucho. La muestra recolectada está en un sistema hermético así que antes y después del cambio de temperatura, el contenido de O2 y CO2 es idéntico ya que no se puede escapar ninguna molécula. Adicionalmente, con el cambio de temperatura se cambia la P50 de la sangre de la muestra y la afinidad de la hemoglobina por oxígeno. Al cambiar la saturación cambia la PaO2 también. Por ejemplo, si la afinidad por oxígeno de la hemoglobina se aumenta (desplazamiento a la izquierda por enfriamiento de la muestra de un paciente con fiebre), la PaO2 medida estará más baja que in vivo. Si la afinidad por oxígeno se disminuye (desplazamiento a la derecha por calentamiento de la muestra en un paciente hipotérmico), la PaO2 medida en el gasómetro será mayor que la que se tiene in vivo. También es clave considerar que el análisis de la gasometría y en particular de la oxigenación, requiere que el paciente se encuentre en estado estable (steady-state). Si hay hipoventilación o hiperventilación aguda (o cambio de la FIO2, o de posición corporal, o cambio en la actividad física), no se consideran válidos los cambios gasométricos, específicamente los relacionados con el gradiente alvéolo-arterial, dado que el cociente respiratorio (RQ) es utilizado tanto en la ecuación del gas alveolar como el gradiente alvéolo arterial; por ende, ante las citadas eventualidades el RQ puede ser muy diferente de 0.8. No olvidar que ante circunstancias similares también se modifica el estado ácido-base.











 nueva página del texto (beta)
nueva página del texto (beta)