Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Neumología y cirugía de tórax
versão impressa ISSN 0028-3746
Neumol. cir. torax vol.75 no.1 México Jan./Mar. 2016
Original
Síndrome hepatopulmonar: Situación clínica en un hospital de tercer nivel en Puebla, México
Hepatopulmonary syndrome: Clinical situation in a third level hospital in Puebla, México
Alejandra Elizabeth Salazar-Marcelino,* José Carlos Herrera-García,* Javier Toledo-Estrada,* Miguel Ángel Mendoza-Torres,‡ Teresita Romero-Ogawa§
*Hospital de Especialidades 5 de Mayo, ISSSTEP, Puebla;
‡Clínica de Hígado. UMAE Manuel Ávila Camacho. IMSS, Puebla;
§Departamento de Posgrado de Medicina BUAP.
Trabajo recibido: 13-VII-2015; aceptado: 16-X-2016
RESUMEN. Introducción: El síndrome hepatopulmonar (SHP) es una de las manifestaciones extrahepáticas menos frecuentes de la insuficiencia hepática. Tiene una incidencia de 13 a 47%, con una sobrevida de 40% a 2.5 años. Objetivo: Describir el diagnóstico y la evolución clínica del SHP en pacientes mexicanos. Material y métodos: Estudio descriptivo, observacional, longitudinal y ambilectivo. Se estudiaron 94 pacientes de la Clínica de Hígado, estableciendo como criterios diagnósticos para SHP: datos clínicos sugestivos como tos no asociada a procesos infecciosos, dolor torácico, disnea, ortodeoxia y/o platipnea, gradiente alvéolo-arterial de oxígeno mayor de 15 mmHg, dilataciones vasculares intrapulmonares evaluado mediante ecocardiografía de contraste y pruebas de función respiratoria por el Departamento de Neumología del Hospital de Especialidades 5 de Mayo, ISSSTEP, Puebla, México, en el período de marzo a agosto de 2014. Resultados: Se determinó la presencia de SHP en 4 pacientes (4.2%), la etiología asociada más prevalente fue por enfermedad hepática no alcohólica, 35.1%; asociada a alcohol, 24.4%; viral, 15.9%; y otras, 24.5%. Los síntomas más frecuentes asociados a SHP fueron: disnea, dolor torácico y tos crónica. Cien por ciento de los pacientes (4 pacientes) presentaban hipoxemia en diferentes grados. La severidad de la enfermedad catalogada por Child Pugh no determina la aparición de los síntomas. Conclusión: El SHP se produjo en 4.2% de los pacientes, presentaron hipoxemia y elevación del gradiente alvéolo-arterial. La severidad de la enfermedad hepática no determina el desarrollo de la enfermedad. Su detección oportuna disminuye la mortalidad de los pacientes.
Palabras clave: Síndrome hepatopulmonar, cirrosis, diagnóstico.
ABSTRACT. Introduction: The hepatopulmonary syndrome (HPS) is one of the less frequent extrahepatic manifestations of liver failure. It has an incidence of 13 to 47%, with a survival of 40% at 2.5 years. Objective: Describe the diagnosis and clinical course of HPS in Mexican patients. Material and methods: Descriptive, observational, longitudinal study and ambilective. We studied 94 patients with clinical liver established as diagnostic criteria for HPS: suggestive clinical data as cough not associated with infectious processes, chest pain, dyspnea, orthodeoxia and/or platypnea, alveolar/arterial gradient of oxygen higher than 15 mmHg, intrapulmonary vasodilation evaluated by contrast echocardiography and pulmonary function tests by the Department of Pneumology Specialist Hospital May 5, ISSSTEP, Puebla, in the period from March 2014 to August 2014. Results: The presence of HPS in 4 patients (4.2%) was determined, the most prevalent etiology was associated by non-alcoholic liver disease in 35.1%, associated with alcohol in 24.4%, 15.9% viral and other 24.5%. The most common symptoms associated with HPS were dyspnea, chest pain and chronic cough. 100% of patients (4 patients) had varying degrees hypoxemia. The severity of the disease not listed by Child Pugh determines the appearance of symptoms. Conclusion: HPS occurs in 4.2% of patients, they have hypoxemia and elevation of the alveolar-arterial gradient. The severity of liver disease does not determine the development of the disease. Its early detection reduces mortality of patients.
Key words: Hepatopulmonary syndrome, cirrhosis, diagnosis.
INTRODUCCIÓN
El síndrome hepatopulmonar (SHP) se define como una tríada de la enfermedad hepática; es decir, la cirrosis y/o hipertensión portal, la desoxigenación arterial y dilataciones vasculares intrapulmonares (DVIP).1-4 Con regularidad, el síndrome es infradiagnosticado dado que la mayoría de los pacientes afectados son asintomáticos o presentan síntomas insidiosos hasta presentar disnea y fatiga rápidamente progresiva. La prevalencia actual es de 11 a 32% de los pacientes con enfermedad hepática crónica, principalmente los cirróticos.5-7 Los datos clínicos relacionados a la disfunción pulmonar son: disnea, paltipnea, ortodeoxia, hipocratismo digital y cianosis. La ortodeoxia y la platipnea, aunque no son patognomónicos del síndrome se presentan hasta en 90% de los pacientes.8 La ortodeoxia se define como la desaturación arterial de más de 10% basal con el paciente de pie y decúbito. La platipnea es la disnea que se presenta cuando el paciente se incorpora y desaparece cuando adopta la posición sedente o decúbito supino; además, presenta hipoxemia secundaria asociada a hipocapnia y aumento del gradiente alvéolo-arterial, siendo este último marcador precoz de la enfermedad.9-11 El SHP también se ha relacionado con enfermedad grave con puntuación de Child-Pugh (CP) alto y por el modelo para la enfermedad en etapa terminal del hígado (MELD).12-15 Recientemente, el curso natural de SHP ha demostrado ser progresivo16-19 y está asociado a menor supervivencia en los pacientes en espera de un trasplante hepático.20,21 La mortalidad en los pacientes con SHP es debido sobre todo a la enfermedad hepática asociada, más que por la pobre función pulmonar.22
El SHP es un marcador de mal pronóstico en los pacientes con daño hepático. Una vez que el paciente deja de responder al oxígeno suplementario, se observa un rápido deterioro de la función pulmonar que puede llevar a un desenlace a corto plazo de dos meses.23
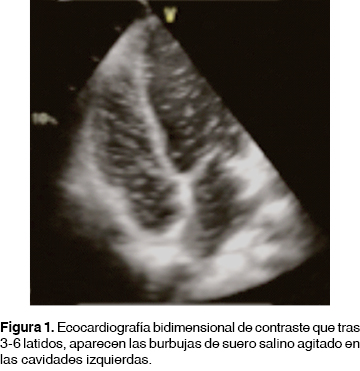
El SHP es determinante entre la enfermedad hepática y la vasodilatación pulmonar con trastorno final en la oxigenación arterial con aumento del gradiente alvéolo-arterial de oxígeno.24 Para corroborar el diagnóstico se recurrió al estudio de contraste por ecocardiografía, el cual representa el método más sensible en la detección de dilataciones vasculares intrapulmonares, se realiza mediante una inyección intravenosa de material de contraste, comúnmente solución salina agitada formando una corriente de microburbujas de 60 a 150 mm de diámetro. Bajo condiciones normales el contraste opacifica únicamente a las cavidades derechas, pues el contraste se filtra por el lecho vascular pulmonar; sin embargo, cuando esto sucede en el corazón izquierdo es debido a que se encuentra presente una derivación cardíaca de derecha a izquierda, generalmente apareciendo en el lado izquierdo a los tres latidos cardíacos tras la inyección de contraste.25,26
Objetivo: Describir el diagnóstico y la evolución clínica del SHP.
MATERIAL Y MÉTODOS
Estudio descriptivo, de procedimiento, observacional, longitudinal, ambilectivo y homodémico. Se estudiaron todos los pacientes de la Clínica del Hígado con cirrosis previamente diagnosticada clínica, por laboratorio, imagenología e histológicamente, fueron sometidos a vigilancia clínica dirigida al diagnóstico presuntivo de SHP.
Criterios de inclusión:
1. Pacientes de la Clínica de Hígado con el diagnóstico de cirrosis, independiente de la etiología y género, rango de edad de 18 a 85 años;
2. Con valoración por lo menos de una consulta en neumología y que presentaran síntomas relacionados;
3. Firma de consentimiento informado.
Criterios de exclusión:
1. Pacientes con enfermedad hepática inestable o descompensada;
2. Sin expediente clínico;
3. Con enfermedad descompensada en Unidad de Terapia Intensiva;
4. Que no hubieran firmado consentimiento informado;
5. Que no asistieran a la Consulta Externa de Neumología.
Metodología
Los pacientes de la Clínica de Hígado con cirrosis, independiente de la etiología que fueron consultados entre el período del 3 de marzo al 29 de agosto de 2014, fueron sometidos a revisión clínica en búsqueda de manifestaciones respiratorias como disnea, tos crónica no asociada a procesos infecciosos, dolor torácico, ortodeoxia y/o platipnea durante dos mediciones, al inicio del estudio y en una segunda consulta. Con base en la información obtenida en el formato de recolección de datos: edad, género, etiología de cirrosis, gravedad de la enfermedad hepática (determinada mediante el grado de CP), hipoxemia, saturación de O2, se seleccionaron sólo aquéllos que tenían mayor sospecha clínica para el diagnóstico de SHP, siendo canalizados al Departamento de Neumología para realizar el diagnóstico confirmatorio y su seguimiento. Se les realizó pruebas de función respiratoria (oximetría, gasometría arterial y espirometría forzada, cálculo de gradiente alvéolo-arterial de oxígeno) y previa autorización de consentimiento informado, ecocardiografía transtorácica con contraste, para lo cual se canalizó con 20 cc de solución fisiológica, realizando inyección manual de microburbujas con visualización del septum interauricular y cavidades cardíacas izquierdas, tanto en latidos tardíos intermedios y tardíos para determinar la existencia de cortocircuito o shunt intrapulmonar. El protocolo de estudio fue aprobado por el Comité de Ética del instituto.
Procedimientos
Análisis arterial de gases en sangre. La muestra de sangre fue obtenida por punción percutánea de la arteria radial con el paciente sentado. pH arterial, O2 y CO2 fueron medidos a través de electrodos estándar (modelo Cobas B 221 marca Roche).
El gradiente de oxígeno alveolar-arterial (AaO2) fue determinado de acuerdo con la ecuación del gas alveolar. El gradiente entre el alvéolo y la sangre en las venas pulmonares en circunstancias normales es debido a una pequeña cantidad de cortocircuito pulmonar (shunt anatómico) y a diferencias regionales en la relación ventilación/perfusión. Este gradiente (diferencia alvéolo-arterial; D (A-a O2) se calcula por la diferencia entre la presión arterial de oxígeno (PaO2) obtenida por la ecuación del gas alveolar y la PaO2 en una arteria sistémica. El gradiente puede estar aumentado casi siempre por un aumento en el cortocircuito pulmonar (shunt funcional o anatómico), alteraciones en la relación ventilación/perfusión, aumento de la resistencia al proceso de difusión y disminución de la presión venosa mixta de oxígeno (PvO2), por disminución del gasto cardíaco o aumento del metabolismo tisular. En el alvéolo aparece un gas diferente en la mezcla -el dióxido de carbono (CO2)-, el cual sale del capilar para ser eliminado en la fase espiratoria del ciclo ventilatorio. La presión de este gas genera disminución de la PO2, produciendo así un nuevo valor de presión: presión alveolar de oxígeno (PAO2), la cual se calcula mediante la ecuación de gas alveolar: PAO2 = (P atmosférica-P VH2O x FiO2) - PaCO2/R, el valor de PACO2 es igual al de PaCO2 debido a las características de difusibilidad y solubilidad de éste. R es la relación entre O2 y CO2 difundidos a través de la membrana alvéolo-capilar. Su valor normal es de 0.8 a 1.
Para fines del presente estudio se consideró como hipoxemia una PO2 de menos de 70 mmHg y un gradiente AaO2 anormal cuando era mayor de 15 mmHg.
Pruebas de función pulmonar. Las pruebas de función pulmonar estándar se realizaron en todos los pacientes por medio de espirómetro (Easy One Spirometer TM Volks frontline GK 2013), con el fin de evaluar la capacidad vital funcional (FVC), volumen espiratorio forzado en 1 segundo (FEV1), el flujo espiratorio máximo y el índice FEV1/FVC.
Ecocardiografía con contraste transtorácica. La presencia de la dilatación vascular pulmonar se determinó indirectamente mediante una evaluación cualitativa de derecha a izquierda de maniobras bajo inyección manual, utilizando 20 mL de solución salina al 0.9% agitada por intravenosa periférica e identificación de 60 a 90 micras microburbujas en las cavidades cardíacas izquierdas, se consideró como evidencia de cortocircuitos intrapulmonares. Además, a los pacientes con ecocardiograma contrastado positivo se les realizó gammagrafía pulmonar perfusoria con tecnecio con macroagregados de albúmina la medición utilizada, los cálculos para determinar DVIP fueron con base en el protocolo del Departamento de Imagenología subrogado por el Hospital de Especialidades 5 de mayo, ISSSTEP.
Criterios para el diagnóstico de SHP. El diagnóstico de SHP fue considerado en presencia de características clínicas como tos no asociada a procesos infecciosos, disnea, dolor torácico, orteodoxia y/o platipnea, hipoxemia, AaO2 anormal, ecocardiograma con contraste y gammagrama pulmonar perfusorio con tecnecio positivo para cortocircuitos intrapulmonares.
La gravedad del SHP se determinó basándose en la oxigenación, leve (mayor de 60 mmHg), moderado (menor a 60 y mayor o igual a 50 mmHg), y grave (menor a 50 mmHg).
Análisis estadístico
Se compararon las diferencias entre grupos de pacientes utilizando la prueba de Kruskal-Wallis, prueba de Chi-cuadrada o Fisher prueba de probabilidad exacta, cuando fue apropiado. Un valor de p < 0.05 fue considerado significativo. Se realizaron todos los análisis estadísticos con el programa NOPANDEV.
RESULTADOS
Se estudiaron 94 pacientes en un período de 6 meses (42 varones y 52 mujeres) con el diagnóstico de cirrosis de la Clínica de Hígado del Hospital de Especialidades 5 de mayo del ISSSTEP, Puebla, México. La etiología en los pacientes fue: alcohólica, 23 (24.2%); viral, 15 (15.9%); esteatohepatitis no alcohólica, 33 (35.1%); cirrosis biliar primaria, 9 (9.5%); etiología mixta, 4 (4.3%); criptogénica, 8 (8.5%); y asociada a medicamentos, 2 (2.1%). Con base en la clasificación de CP se documentó que 37 pacientes (39.3%) pertenecían a CP A; 25 (26.5%) a CP B; y 32 (34%) a CP C (p = 0.298) no estadísticamente significativa (tabla 1).

En relación con las comorbilidades, 21 pacientes (22.3%) presentaron diabetes mellitus tipo 2; 6 (6.3%) hipertensión arterial sistémica; 18 (19.1%) presentaron ambas; y 49 (52.1) no presentaron comorbilidades (tabla 2).

Del total de los pacientes, tras dos revisiones por la Clínica de Neumología se determinó que 17 pacientes (18%) presentaban síntomas sugestivos de SHP, como tos no asociada a procesos infecciosos, dolor torácico y disnea; y 81.9% de los pacientes no presentaban los síntomas sugestivos del síndrome. De acuerdo con ello se determinaron las siguientes variables: 5 pacientes (29.4%) fueron del género masculino con promedio de 64 años de edad, y 12 pacientes (70.5%) del género femenino con promedio de 62.5 años de edad, p = 0.371.
De los 17 pacientes con síntomas sugestivos de SHP, en 4 de ellos (23.5%) se documentó SHP por la conjunción de datos clínicos como tos no asociada a procesos infecciosos, dolor torácico, disnea, ortodeoxia y/o platipnea, más la determinación de cortocircuitos intrapulmonares por ecocardiografía transtorácica con contraste (sin presentar datos de hipertensión arterial pulmonar, figura 1) y gammagrama perfusorio pulmonar; mientras que 13 pacientes (76.4%) no cumplieron criterios para el SHP antes mencionado. Presentaron disnea 7 pacientes (41.2%); 2 (11.8%) platipnea; y 1 (5.8%) ortodeoxia. Los hallazgos radiológicos fueron: 7 pacientes (41.1%) normal; patrón reticular 5 (29.4%); y aumento de la vasculatura pulmonar en 1 (29.4%). Dentro de las pruebas pulmonares: espirometría normal, 10 pacientes (58.8%); patrón restrictivo, 3 (17.6%); patrón obstructivo, 3 (17.6%); y 1 (5.8%) patrón mixto. La hipoxemia se observó en 4 pacientes (23.4% [2 pacientes con grado leve, 1 paciente con grado moderado y 1 paciente con grado grave]), 100% de los pacientes con hipoxemia presentó elevación de gradiente alvéolo-arterial. Ningún paciente fue sometido a trasplante de hígado durante la hospitalización debido a las políticas de asignación del instituto.
DISCUSIÓN
La cirrosis hepática es considerada en varios países como una de las 10 principales causas de muerte, con variaciones en su mortalidad durante el paso de los años. En Francia, en 2009 se reportó una frecuencia de 2,000-3,300 casos por cada millón de habitantes. En México, en 1987 se reportó una tasa de 24.4 casos por cada 100,000 habitantes y en 2002 ocupó el quinto lugar. De acuerdo con el Instituto Nacional de Estadística y Geografía, en el año 2003 fue la tercera causa de mortalidad en hombres adultos (20,478 casos) y la octava causa en mujeres (6,332 casos), con un total de 26,810 muertes a nivel nacional. Es una enfermedad que afecta a la población económicamente activa, causa un alto número de consultas médicas y requiere un consumo importante de recursos a nivel de áreas hospitalarias, de urgencias médicas o de terapia intensiva. Se asocia a discapacidad, constituyendo un problema de salud pública. Se estima que para el año 2020 habrá alrededor de dos millones de pacientes con enfermedad hepática crónica.17
La American Association for the Study of Liver Diseases recomienda la detección precoz del SHP, dado que la gravedad de la enfermedad pulmonar puede hacer a estos pacientes elegibles para trasplante, independiente del compromiso hepático.17 A pesar de que los pacientes con hipoxemia grave tienen mayor mortalidad en el postrasplante inmediato, el grado de hipoxemia no contraindica el trasplante y el SHP es completamente reversible con el trasplante.6,7
La edad promedio de presentación del SHP fue de 52 ± 9 años,19 la edad promedio en el estudio realizado por Shafiq et al. reportaron 47.92 ± 11.38 años.20 En nuestro estudio de 18% (17 pacientes), 12 (71%) correspondían al rango de edad de entre los 61 y 75 años, coincidiendo con lo reportado con la literatura internacional.
De los pacientes con sospecha inicial para SHP se obtuvo el predominio de mujeres en un 71%, con un 50% en los pacientes con diagnóstico de SHP; de acuerdo con el estudio de Fallon et al., no hubo diferencia significativa entre los pacientes con o sin SHP.18
Se ha reportado que no hay diferencia significativa en la presencia o no de SHP de acuerdo con la etiología;19 no obstante, en nuestro estudio 50% de los pacientes con SHP presentaban el etilismo como etiología de la cirrosis, seguido de causa medicamentosa y viral. En países en vías de desarrollo, la etiología más frecuente es la hepatitis crónica por consumo de alcohol (OH), por esteatohepatitis no alcohólica (EHNO), seguida por las infecciones virales crónicas, como la del virus de la hepatitis C (VHC). La cirrosis por alcohol y enfermedad viral crónica es la primera causa de hipertensión portal en México.17 Lo que produce mayor relevancia porque a pesar de tener más prevalencia de cirrosis por EHNO (41%), en nuestra población de estudio ninguno de estos pacientes fue positivo para SHP, contra 18% de etiología alcohólica. El SHP se encuentra en pacientes con o sin hipertensión portal en la enfermedad hepática aguda o crónica; de hecho, puede encontrarse en pacientes con falla hepática aguda. Sólo existe una asociación débil entre la severidad de la enfermedad hepática y el grado de hipoxemia y la causa de la enfermedad hepática no parece estar en relación con el desarrollo de SHP.21
La mayoría de los estudios analizados reportan casuística de pacientes en Clasificación de la Gravedad de la Enfermedad Hepática en Child Turcotte Pugh C o postrasplantados de hígado, no hay estudios realizados en pacientes con diagnóstico de cirrosis que incluya población independiente de la estadificación de gravedad de ésta. Schenk et al. encontraron 7 de 111 pacientes con SHP en CP B,22 el enfoque de estudio es con base en pacientes child C o según el MELD. En el estudio realizado por Shafiq et al. reportaron que todos los pacientes de su muestra fueron diagnosticados con SHP de etiología viral para VHC y en Child C.20 Nuestro estudio fue realizado en pacientes con cirrosis en diversos estadíos y la selección se basó en la presencia de datos clínicos sugestivos de SHP; cabe mencionar que los 4 pacientes diagnosticados (100%) con SHP fueron correspondientes a CP B, razón por la cual sugerimos la extensión del screening a etapas más tempranas de la cirrosis. La clasificación del Child en el estudio de El Makarem et al.23 fue de 35.2% para child B, sin encontrar diferencia significativa para la sintomatología respiratoria como la platipnea.
El pronóstico es ominoso pues la sobrevida es de 16 a 38% a un año del diagnóstico y todavía más limitada si la PaO2 es < 50 mmHg.3
En el presente estudio se diagnosticó SHP a 4 de los 17 pacientes (23.5%) con el cuadro clínico sugestivo, hipoxemia, AaO2 anormal, ecocardiograma contrastado y gammagrama pulmonar perfusorio con presencia de fístulas arteriovenosas pulmonares. Otras fuentes refieren incidencia de 10-30% de los pacientes con cirrosis con un incremento significativo en la mortalidad24 y otras refieren que es una de las manifestaciones extrahepáticas de la insuficiencia hepática con incidencia de 13 a 47%.1,9 Schenk et al.22 reportaron en una serie de 111 pacientes con cirrosis una incidencia de 24% usando el ecocardiograma transtorácico contrastado y una mortalidad significativamente alta comparada con pacientes sin SHP, una sobrevida media de 10.6 meses vs. 40.8 meses, respectivamente.8,14 Los pacientes con SHP admitidos en la Unidad de Cuidados Intensivos tienen un rango de mortalidad de 50-100% que aumenta con la disfunción orgánica múltiple, siendo la mayor problemática.25 En México se documenta que la prevalencia de SHP en pacientes con cirrosis y enfermedad hepática en fase terminal varía de 4 a 30%, esta diferencia en la prevalencia se debe en principio a la heterogeneidad de los criterios diagnósticos utilizados.24
La presencia del SHP determina una menor sobrevida. Al efectuar el análisis de sobrevida basado en la severidad del daño hepático subyacente, la mortalidad se mantuvo más elevada en los pacientes con SHP, quienes fallecen por complicaciones de la hipertensión portal, en estrecha correlación con la severidad de la hipoxemia. Otra serie mostró una sobrevida a 5 años de 23% (24 meses en promedio) en los pacientes con SHP no trasplantados respecto a 63% (87 meses) en los pacientes con cirrosis hepática sin SHP.6
El costo/beneficio del screening depende de la prevalencia y severidad del SHP.26 Aunque hay estudios que recomiendan el uso de pulso oximetría como screening para diagnosticar el SHP, observamos que en nuestra muestra sólo uno de los pacientes presentó ortodeoxia, a pesar de que la literatura comenta que se llega a presentar en 90% de los pacientes positivos a SHP.11,12
CONCLUSIÓN
Los pacientes con cirrosis e hipoxemia son altamente sospechosos de presentar SHP asociado a síntomas cardinales de la enfermedad, posteriormente presentan deterioro progresivo y desenlace a corto plazo. El diagnóstico de SHP es complejo y requiere revisiones sistemáticas de los pacientes que presentan deterioro de su calidad de vida o descompensaciones. La gravedad en la clasificación CP no es determinante en la aparición del síndrome.
REFERENCIAS
1. Hemprich U, Papadakos PJ, Lachmann B. Respiratory failure and hypoxemia in the cirrhotic patient including hepatopulmonary syndrome. Curr Opin Anaesthesiol 2010;23(2):133-138. http://dx.doi.org/10.1097/ACO.0b013e328335f024 [ Links ]
2. Martínez LE, Jiménez ZVH, Gallardo ALA, Álvarez MI. Síndrome hepatopulmonar. An Med (Mex) 2006;51(3):124-133. [ Links ]
3. Zagolín BM, Medel FJN, Valera MJ. Síndrome hepatopulmonar e hipertensión portopulmonar: Dos entidades a diferenciar. Rev Chil Enf Respir 2008;24(4): 291-303. [ Links ]
4. Shijo H, Sasaki H, Sakata H, Kusuhara H, Ueki T, Okumura M. Reversibility of hepatopulmonary syndrome evidenced by serial pulmonary perfusion scan. Gastroenterol Jpn 1993;28(1):126-131. [ Links ]
5. Douglas LaBrecque World Gastroenterology Organization Global Guidelines World, Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis; 2012. Access date: January 22, 2016. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/nafld nash/nafld-nash-english [ Links ]
6. García BL, González MF, Moreno-Otero R. Cirrosis hepática. Medicine 2012;11(11):625-633. [ Links ]
7. Swanson KL, Wiesner RH, Krowka MJ. Natural history of hepatopulmonary syndrome: Impact of liver transplantation. Hepatology 2005;41(5):1122-1129. [ Links ]
8. Zhang ZJ, Yang CQ. Progress in investigating the pathogenesis of hepatopulmonary syndrome. Hepatobiliary Pancreat Dis Int 2010;9(4):355-360. [ Links ]
9. Carrillo ER, González SJA, Serralde ZA. Síndrome hepatopulmonar. Rev Fac Med UNAM 2001;44(5). Fecha de acceso: 22 de enero, 2016. Accesible en: http://www.ejournal.unam.mx/rfm/no44-5/RFM44505.pdf [ Links ]
10. Rodríguez-Roisin R, Krowka MJ. Hepatopulmonary syndrome-a liver-induced lung vascular disorder. N Engl J Med 2008;358(22):2378-2387. http://dx.doi.org/10.1056/NEJMra0707185 [ Links ]
11. Monsel A, Mal H, Brisson H, et. al. Extracorporeal membrane oxygenation as a bridge to liver transplantation for acute respiratory distress syndrome induced life threatening hypoxaemia aggravated by hepatopulmonary syndrome. Crit Care 2011;15(5):R234. http://dx.doi.org/10.1186/cc10476 [ Links ]
12. Shijo H, Nakayama K, Sasaki H, et al. Reversibility of pulmonary telangiectasia in liver cirrhosis evidenced by serial dynamic pulmonary perfusion imaging. Clin Nucl Med 1989;14(12):909-911. [ Links ]
13. Herve P, Le Pavec J, Sztrymf B, Decante B, Savale L, Sitbon O. Pulmonary vascular abnormalities in cirrhosis. Best Pract Res Clin Gastroenterol 2007;21(1):141-159. [ Links ]
14. Schenk P, Fuhrmann V, Madl C, et al. Hepatopulmonary syndrome: prevalence and predictive value of various cut offs for arterial oxygenation and their clinical consequences. Gut 2002; 51(6):853-859. Access date: January 22, 2016. Available from: http://gut.bmj.com/content/51/6/853.full.pdf+html [ Links ]
15. Rodríguez-Roisin R, Krowka MJ, Hervé P, Fallon MB; ERS Task Force Pulmonary-Hepatic Vascular Disorders (PHD) Scientific Committee. Pulmonary-Hepatic vascular Disorders (PHD). Eur Respir J 2004;24(5):861-880. [ Links ]
16. Varghese J, Ilias-basha H, Dhanasekaran R, Singh S, Venkataraman J. Hepatopulmonary syndrome-past to present. Ann Hepatol 2007;6(3):135-142. [ Links ]
17. Uribe M, Morales-Blanhir J, Rosas-Romero R, Campos CR, Poo JL. Epidemiología, fisiopatología y diagnóstico de la hipertensión arterial pulmonar (HAP) en el cirrótico. Gaceta Médica de México 2012;148(2):153-161. [ Links ]
18. Fallon MB, Zhang J. The lung in liver disease: old problem, new concepts. Trans Am Clin Climatol Assoc 2013;124:250-262. [ Links ]
19. Fallon MB, Krowka MJ, Brown RS, et al; Pulmonary Vascular Complications of Liver Disease Study Group. Impact of hepatopulmonary syndrome on quality of life and survival in liver transplant candidates. Gastroenterology 2008;135(4):1168-1175. http://dx.doi.org/10.1053/j.gastro.2008.06.038 [ Links ]
20. Shafiq M, Khan AA, Alam A, et al. Frequency of hepatopulmonary syndrome in cirrhotic patients. J Coll Physicians Surg Pak 2008;18(5):278-281. http://dx.doi.org/05.2008/JCPSP.278281 [ Links ]
21. Porres-Aguilar M, Gallegos-Orozco JF, García H, Aguirre J, Macías-Rodríguez RU, Torre-Delgadillo A. Complicaciones pulmonares vasculares en hipertensión portal y enfermedad hepática: una revisión concisa. Rev Gastroenterol Méx 2013;78(1):35-44. [ Links ]
22. Schenk P, Schöniger-Hekele M, Fuhrmann V, Madl C, Silberhumer G, Müller C. Prognostic significance of the hepatopulmonary syndrome in patients with cirrhosis. Gastroenterology 2003;125(4):1042-1052. [ Links ]
23. El Makarem MA, Elakad A, Ali A, et al. Hepatopulmonary syndrome: prevalence and predictors in Egyptian cirrhotic patients. Trop Gastroenterol 2011;32(1):25-30. [ Links ]
24. Zhang J, Luo B, Tang L, et al. Pulmonary angiogenesis in a rat model of hepatopulmonary syndrome. Gastroenterology 2009;136(3):1070-1080. http://dx.doi.org/10.1053/j.gastro.2008 [ Links ]
25. Muñoz CS, Bardi SA, Sapunar PJ, Antolini TM. Síndrome hepatopulmonar. Revista HCUCh 2006;17:229-237. Fecha de acceso: Enero 22, 2016. Accesible en: https://www.redclinica.cl/Portals/0/Users/014/14/14/Publicaciones/Revista/sidrome_hepatopulmar.pdf [ Links ]
26. Roberts DN, Arguedas MR, Fallon MB. Cost-effectiveness of screening for hepatopulmonary syndrome in liver transplant candidates. Liver Transpl 2007; 13(2):206-214. [ Links ]
Correspondencia:
Dra. Alejandra Elizabeth Salazar Marcelino Departamento de Medicina Interna, ISSSTEP, Puebla, México. Av. Venustiano Carranza Núm. 810, colonia San Baltazar Campeche, C.P. 72550,
Puebla, Puebla, México.
Correo electrónico: samsara20_12@hotmail.com
Notas
Los autores declaran no tener conflicto de intereses.
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/neumologia














