Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Neumología y cirugía de tórax
versión impresa ISSN 0028-3746
Neumol. cir. torax vol.74 no.2 México abr./jun. 2015
Caso clínico
Hemoptisis masiva en fibrosis quística tratada con Amplatzer Plug IV
Hemoptysis mass in cystic fibrosis treatd with Plug IV Occluder
José Carlos Herrera-García, Rubén Sánchez-Pérez, Carlos Arroyo-Cabrera, Patricia Nuche-Salazar
Departamento de Cardioneumología de Puebla, Fundación Madonna di Guadalupe, Puebla, Puebla, México.
Trabajo recibido: 21-X-2014; aceptado: 30-III-2015
RESUMEN. La hemoptisis es una complicación que se reporta comúnmente en los pacientes con diagnóstico de fibrosis quística y afecta aproximadamente al 9% de la población. Puede darse en escasa cantidad hasta episodios masivos que ponen en riesgo la vida del paciente. Su patogénesis es compleja, pero la causa más común aceptada es la inflamación persistente de la vía aérea asociada a una neovascularización con daño en la vasculatura de las arterias bronquiales. Se describe el caso de un joven de 22 años de edad con diagnóstico confirmado de fibrosis quística en quien se logró el control de la hemoptisis por medio de embolización de las arterias bronquiales y colocación de dispositivo Amplatzer Plug IV por vía percutánea con éxito.
Palabras clave: Fibrosis quística, hemoptisis, embolización, Amplatzer.
ABSTRACT. The haemoptysis is a complication commonly reported in patients diagnosed with cystic fibrosis and affects approximately 9% of the population. It may be in limited quantity to massive events that threaten the patient's life. Its pathogenesis is complex, but the most commonly accepted cause is persistent airway inflammation associated with neovascularization with damage to the vasculature of the bronchial arteries. The case of a 22 year old with confirmed diagnosis of cystic fibrosis in whom control of hemoptysis was achieved through embolization of bronchial arteries and placement PLUG IV Occluder device percutaneously successfully described.
Key words: Cystic fibrosis, hemoptysis, embolization, Occluder device.
INTRODUCCIÓN
La hemoptisis es común en adolescentes y rara en niños pequeños; está comprobado que se asocia con una mortalidad del 50 al 85%.1,2 Se estima que aproximadamente el 1% de los enfermos con fibrosis quística presentará un episodio de hemoptisis masiva cada año, cuya frecuencia mayor es entre aquellos que sobrepasan los 16 años de vida.3 El 22% de los pacientes cuenta con una función pulmonar normal;4 sin embargo, dentro de sus complicaciones más frecuentes están la asfixia secundaria a la variante exanguinante en un 80% y la anemia aguda por sangrado masivo en el restante 20%.5,6
El pulmón tiene doble sistema vascular, pulmonar y bronquial, y entre éstos pueden surgir múltiples anastomosis de predominio en los lechos capilares, que se encargan del intercambio gaseoso alveolar; la circulación bronquial es la responsable del 5% del gasto cardíaco y está encargada de la irrigación de la estructura. La circulación bronquial maneja presiones sistémicas y es la responsable del 90% de los episodios de hemoptisis; puede, así mismo, generar sangrados masivos cuando cuenta con anastomosis con otras arterias como la mamaria interna, la subclavia, las intercostales y otras de orden sistémico, hecho que a su vez explicaría la importancia del tratamiento adecuado de los episodios de hemoptisis y las posibles complicaciones de la embolización. Adicionalmente, se han demostrado procesos de neovascularización y remodelación vascular posteriores a procesos inflamatorios como bronquiectasias, bronquitis crónica o infecciones crónicas necrosantes del parénquima pulmonar adyacente a los bronquios, que contribuyen a la etiopatogenia de la hemoptisis.7 Esta condición tiene su origen en la erosión y posterior ruptura de una arteria bronquial con drenaje a la vía aérea, siendo la inflamación crónica de esta última la que estimula la hipertrofia y la neovascularización.7,8 En los episodios agudos de exacerbación en los pacientes con fibrosis quística se han detectado niveles elevados del factor de crecimiento endotelial vascular (promotor de la angiogénesis); también se han identificado productos bacterianos que alteran el epitelio y el endotelio vascular y que estimulan la proliferación arterial bronquial, lo cual lleva a elongación, dilatación y tortuosidad de los vasos bronquiales, así como de sus anastomosis y sus colaterales.8
Su etiología puede verse enmarcada en otros orígenes como el tratamiento con fármacos antiinflamatorios no esteroideos que interfieren con la hemostasia, el uso de fármacos irritantes en aereosol, el déficit de vitamina K y las variaciones en la presión arterial por cambios posturales.9
Aunque el diagnóstico de hemoptisis es clínico, la mayoría de los pacientes cuentan con un estudio de imagen torácica que permite determinar la severidad y extensión del compromiso parenquimatoso y de la pequeña vía aérea que puede acompañar su evolución (como en el caso de las bronquiectasias que pueden facilitar la presentación clínica inicial con expectoración hemoptoica o hemoptisis recurrente). En algunos casos conviene realizar fibrobroncoscopia para identificar con mayor precisión el sitio del sangrado. La evaluación se complementa con el estudio de anormalidades en la coagulación como causa del sangrado (deficiencia de vitamina K, trastornos de la función hepática, trombocitopenia), antes de cualquier manejo específico.9,10
Dentro de los diagnósticos diferenciales de hemoptisis se encuentran: los sangrados de la vía aérea superior o del tracto gastrointestinal, la aspiración de cuerpo extraño y la ingestión de medicamentos. De otra parte, para el estudio de los casos de hemoptisis se investigan de manera integral sus probables causas y la condición del paciente, como mínimo con la ayuda de una radiografía de tórax, biometría hemática, pruebas de coagulación, pruebas de función hepática y muestras de secreciones bronquiales para estudio microbiológico.10
Algunos episodios de hemoptisis pueden mejorar de forma espontánea sin necesidad de intervenciones o cambios en el tratamiento, mientras que otros sólo ocurren en los episodios de exacerbación y desaparecen luego del control de la misma, pero recidivan ante una nueva agudización.10,11
Son estrategias del tratamiento habitual la administración de antibióticos de amplio espectro con óptima cobertura contra S. aureus y P. aeruginosa teniendo en cuenta que son más efectivos los manejos con medicación endovenosa que inhalada, si bien su uso conjunto aumenta la efectividad.12-14 Asimismo, figuran el aumento de las medidas de limpieza de la vía aérea como la utilización de alfa dornasa y la DNasa recombinante humana, que favorecen el aclaramiento mucociliar al disminuir la viscosidad de las secreciones, y por ende los episodios de exacerbación con el fin de evitar infecciones severas.14
El tratamiento de los episodios de hemoptisis comprende, de igual forma, un enfoque integral que incluye tranquilizar el paciente, brindar sedación eventual, garantizar el apoyo psicológico, suspender medicamentos potencialmente hemorragíparos o irritantes, oxígeno suplementario, corregir el déficit de vitamina k, transfundir ante pérdidas importantes de sangre e iniciar terapia con antibióticos, vasopresina, ácido tranexámico o desmopresina endovenosa.15,16 La evaluación inicial deberá de realizarla personal capacitado para llevar a cabo el tratamiento a la brevedad posible como la revisión broncoscópica, la realización de estudios de imagen y tratamiento por embolización, así como tomar la decisión de realizar la intervención quirúrgica.17 Se recomienda evitar la percusión torácica durante 24 horas, aunque no existe evidencia de que se deba suspender la terapia respiratoria; ésta debe reintroducirse lo antes posible para mejorar la higiene bronquial.17,18 En los episodios de hemoptisis masiva o si se repite el sangrado (más de 100 mL diarios durante 7 días), se considera efectuar broncoscopia más embolización con el fin de localizar y controlar el sangrado, aunque hay que tener en cuenta que en ocasiones la hemorragia masiva impide una correcta visualización.
Las indicaciones de embolización son:
1. Hemoptisis persistente a pesar de otras opciones terapéuticas menos agresivas, o que ponen en riesgo vital al paciente como para requerir una intervención inmediata.2. Hemoptisis no masivas, pero recurrentes y/o que interfieren con la calidad de vida del paciente. Otras medidas terapéuticas son el taponamiento con balón del segmento o lóbulo sangrantes, la instilación de noradrenalina o el suero frío intrabronquial, aunque con una casuística menor de pacientes.
Una de las posibles y eventuales complicaciones de la embolización es el infarto de órganos distales a la zona embolizada y la muerte. En casos graves que no respondan al tratamiento en mención, puede acudirse a la angiografía bronquial selectiva si persiste el sangrado. Podrá considerarse la lobectomía, luego de la embolización de las arterias sangrantes, en aquellos pacientes que no mejoran con la embolización y que cursan con sangrado desde un lóbulo plenamente identificado. Eventualmente, si el daño es severo se presenta insuficiencia respiratoria aguda, que pone en riesgo al vida del paciente como resultado de neumotórax o hemoptisis exanguinante.19,20
Los pacientes con insuficiencia respiratoria hipercápnica pueden beneficiarse del apoyo ventilatorio. La experiencia con la intubación y la ventilación mecánica en pacientes con enfermedad pulmonar avanzada ha sido un tratamiento de mayor avance. Esta estrategia está destinada a descansar los músculos respiratorios, aumentando el volumen respiratorio así como la fuerza muscular con la finalidad de mejorar la calidad de vida mediante la reducción de la disnea de esfuerzo, disminuir el dolor torácico y mejorar la tolerancia al ejercicio. El trasplante pulmonar como tratamiento definitivo tiene criterios de exclusión como: tasa baja de supervivencia a cinco años, insuficiencia respiratoria hipercápnica, hipertensión pulmonar severa, VEF1 < 30% del predicho, hemoptisis masiva y desnutrición. Por lo anterior, es necesario comentar que existen otros factores importantes para el éxito del trasplante que incluyen el sistema del paciente, el apoyo social, el cumplimiento y la estabilidad psicológica. No todos los pacientes son candidatos a trasplante de pulmón, incluso si un paciente está en la lista para ello, debe haber una discusión sobre la forma de manejar la insuficiencia respiratoria y el centro de trasplante debe participar en la decisión relativa a la intubación.21
La embolización de arterias bronquiales es uno de los tratamientos más usados en hemoptisis de diferentes etiologías, incluyendo tuberculosis, bronquiectasias, aspergilosis, fístula aortobronquial y fibrosis quística. Con ésta se logran disminuir las comorbilidades que se presentan al exponer a estos pacientes a tratamientos quirúrgicos;22 las principales contraindicaciones para embolización arterial incluyen: coagulopatía incorregible, falla renal y reacción alérgica severa a los medios de contraste. Luego de la embolización arterial, la tasa de recurrencia es de aproximadamente 50% en los cuatro primeros meses y muchos casos requerirán nueva embolización, la cual puede llevarse a cabo hasta tres veces en el mismo episodio; después, se recurrirá a otras opciones terapéuticas si el sangrado perdura. La eficacia general para el control inicial de la hemoptisis después de una embolización es cercana al 75%, aumenta al 89% después de dos embolizaciones y es del 93% después de tres.23
La indicaciones para intervención quirúrgica en los pacientes con fibrosis quística se derivan principalmente de patologías pleurales como el neumotórax, el derrame pleural y el empiema; en cuanto a las alteraciones parenquimatosas están las bronquiectasias, la hemoptisis (con o sin bronquiectasias relacionadas) y los abscesos pulmonares, pero sólo deben ser consideradas cuando los tratamientos médicos y las embolizaciones se hayan agotado en su totalidad. Otras opciones sugeridas son la ligadura arterial selectiva y la lobectomía, aunque en cada una de éstas es preciso tener en cuenta la capacidad pulmonar reducida del paciente y el riesgo de recurrencia de hemoptisis en otra localización.24
En cuanto al trasplante pulmonar, las indicaciones actuales son el deterioro respiratorio progresivo demostrado por deterioro del VEF1 mayor del 30%, la hipoxemia y la hipercapnia severas, el incremento en la frecuencia y duración de las exacerbaciones pulmonares que requieran hospitalización, y la ausencia de respuesta a los manejos médicos como en el caso de hemoptisis masiva recurrente y resistencia bacteriana intratable.25
El Amplatzer Vascular Plug (AVP) es un dispositivo embólico establecido que puede ser una excelente alternativa a las bobinas o globos desmontables para embolizar medianos y grandes vasos con alto flujo. El dispositivo es fácil de usar y puede ser desplegado con precisión en el vaso diana con alta resistencia a la migración y una tasa de recanalización baja. El éxito técnico de este dispositivo es alto, las indicaciones de uso se están expandiendo y no hay contraindicaciones absolutas que se hayan reportado. Desde su introducción, la AVP ha crecido desde un único dispositivo a un grupo de cuatro modelos (AVP, AVP II, III AVP y AVP IV). Cada modelo cuenta con un diseño y características que se ajustan a diferentes anatomías vasculares, situaciones hemodinámicas y escenarios clínicos únicos. Por lo tanto, los nuevos modelos no pueden simplemente ser tratados como sustitutos de los antiguos. El tiempo de oclusión impredecible sigue siendo una de las principales deficiencias de los nuevos modelos de la AVP. De gran tamaño del buque, el estado de flujo alto y coagulopatía pueden prolongar el tiempo de oclusión, que puede compensar el costo-beneficio; la reducción de la duración del procedimiento y la reducción de la dosis de radiación se observa típicamente con el uso de sólo la AVP. Bobinas o múltiples AVPs se pueden utilizar para acelerar el proceso de oclusión, y grandes partículas de Gelfoam también se pueden utilizar como un complemento para alcanzar la oclusión rápida y fiable con un costo mínimo.
CASO CLÍNICO
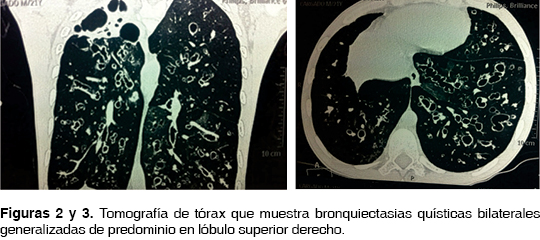
Joven de 22 años de edad, con diagnóstico de fibrosis quística desde los cuatro años con electrolitos en sudor positivo. Ha estado en tratamiento en el último año con broncodilatadores, esteroides inhalados y sistémicos de manera continua así como alfa dornasa y tobramicina inhalada por colonización crónica por Pseudomonas aeroginosa, secundariamente con uso de oxígeno suplementario de dosis de 3 a 4 litros por minuto y ventilación mecánica invasiva tipo Bilevel, aunado a tratamiento con rehabilitación pulmonar en los últimos seis meses. Ingresó al Servicio de Urgencias por presentar episodio de hemoptisis activa de aproximadamente 500 mL con el antecedente de cuadro de hemoptoicos y expectoración herrumbrosa de manera intermitente que requirió uso de carbapenémicos intravenosos en domicilio. Desde el punto de vista radiológico, se observó en la tomografía de tórax de alta resolución la presencia de múltiples bronquiectasias difusas bilaterales tipo quísticas generalizadas, con ausencia de parénquima pulmonar en lóbulo superior derecho (figuras 1, 2 y 3). Presentaba función pulmonar muy limitada con relación FEV1/FVC de 0.5 y FEV1 19%. Durante el evento se inició tratamiento con administración cuidadosa de vitamina k y dosis alternadas de etamsilato. Por el cuadro anterior y por persistir con el cuadro de hemoptisis fue llevado al área de hemodinamia pulmonar donde se le realiza cateterismo izquierdo con aortografía torácica y canulación selectiva de arteria bronquial derecha, la cual se observa con hipertrofia, tortuosa y con corto circuito arteria bronquial/arteria pulmonar (figura 4). Una vez localizada la arteria responsable de la hemoptisis, se procedió a embolizar con dispositivo tipo Amplatzer Plug IV (figura 5). Después del procedimiento evolucionó de manera satisfactoria con notable mejoría clínica. Se decidió egreso a domicilio para continuar con la terapéutica crónica.



DISCUSIÓN
El tratamiento de la hemoptisis actualmente está determinado por el tipo de paciente y la gravedad del sangrado; existen múltiples técnicas para su tratamiento de acuerdo a la gravedad del padecimiento y el riesgo de muerte. Hay tratamientos locales y sistémicos que contribuyen al detenimiento del mismo; pero hoy, el cateterismo de arterias bronquiales con uso de dispositivos tipo Amplatzer ha permitido disminuir la recurrencia de episodios de disnea en los pacientes con limitada función pulmonar que no pueden ser llevados a un tratamiento quirúrgico extenso. El trasplante pulmonar parece ser una alternativa muy factible en países desarrollados con la debida infraestructura, pero en nuestro medio es difícil llevarlo a cabo. La intención del presente trabajo es demostrar que otras técnicas invasivas, son una herramienta muy útil para el tratamiento resolutivo con buenas tasas de éxito.
CONCLUSIÓN
La hemoptisis constituye una de las complicaciones más frecuentes en los pacientes que padecen fibrosis quística; comúnmente es causada por hipertrofia de las arterias bronquiales en respuesta a anormalidades y lesiones repetidas o crónicas sobre el parénquima pulmonar con la respectiva erosión y ruptura de las mismas. El tratamiento antibiótico es el paso inicial de una serie de medidas generales que el paciente requiere, pero contamos con casos graves que requieren tratamiento resolutivo. Debido a ello se tiene como herramienta el cateterismo y embolización de las arterias bronquiales con dispositivos tipo Amplatzer con la finalidad de estabilizar al paciente y disminuir las complicaciones asociadas al tratamiento quirúrgico. Es importante mencionar que es necesario optimizar la condición clínica del paciente antes de la intervención y procurar tener un seguimiento multidisciplinario que conduzca a obtener mejores resultados. El uso de dispositivo para oclusión vascular tipo Amplatzer Plug IV es eficaz como tratamiento con excelentes tasas de éxito.
REFERENCIAS
1. Consenso de Fibrosis Quística. Arch Argent Pediatr 1999;97(3):188-224. [ Links ]
2. Prados C, Máiz L, Antelo C, et al. Cystic fibrosis: consensus on the treatment of pneumothorax and massive hemoptysis and the indications for lung transplantation. Arch Bronconeumol 2000;36(7):411-416. [ Links ]
3. Flume PA. Pulmonary complications of cystic fibrosis. Respir Care 2009;54(5):618-627. [ Links ]
4. Flume PA, Yankaskas JR, Ebeling M, Hulsey T, Clark LL. Massive hemoptysis in cystic fibrosis. Chest 2005;128(2):729-738. [ Links ]
5. Charan NB, Baile EM, Paré PD. Bronchial vascular congestion and angiogenesis. Eur Respir J 1997;10(5):1173-1180. [ Links ]
6. McDonald DM. Angiogenesis and remodeling of airway vasculature in chronic inflammation. Am J Respir Crit Care Med 2001;164(10 Pt 2):S39-S45. [ Links ]
7. Jewkes J, Kay PH, Paneth M, Citron KM. Pulmonary aspergilloma: analysis of prognosis in relation to haemoptysis and survey of treatment. Thorax 1983;38(8):572-578. [ Links ]
8. Parker CM, Nolan R, Lougheed MD. Catamenial hemoptysis and pneumothorax in a patient with cystic fibrosis. Can Respir J 2007;14(5):295-297. [ Links ]
9. Emerson J, Rosenfeld M, McNamara S, Ramsey B, Gibson RL Pseudomonas aeruginosa and other predictors of mortality and morbidity in young children with cystic fibrosis. Pediatr Pulmonol 2002;34(2):91-100. [ Links ]
10. Barben JU, Ditchfield M, Carlin JB, Robertson CF, Robinson PJ, Olinsky A. Major haemoptysis in children with cystic fibrosis: a 20-year retrospective study. J Cyst Fibros 2003;2(3):105-111. [ Links ]
11. Popper J. The use of premarin IV in hemoptysis. Dis Chest 1960;37:659-660. [ Links ]
12. Schidlow DV, Taussig LM, Knowles MR. Cystic Fibrosis Foundation consensus conference report on pulmonary complications of cystic fibrosis. Pediatr Pulmonol 1993;15(3):187-198. [ Links ]
13. Flume PA, Mogayzel PJ Jr, Robinson KA, Rosenblatt RL, Quittell L, Marshall BC; Clinical Practice Guidelines for Pulmonary Therapies Committee; Cystic Fibrosis Foundation Pulmonary Therapies Committee. Cystic fibrosis pulmonary guidelines: pulmonary complications: hemoptysis and pneumothorax. Am J Respir Crit Care Med 2010;182(3):298-306. http://dx.doi.org/10.1164/rccm.201002-0157CI [ Links ]
14. Coss-Bu JA, Sachdeva RC, Bricker JT, Harrison GM, Jefferson LS. Hemoptysis: a 10-year retrospective study. Pediatrics 1997;100(3):E7. [ Links ]
15. Sidhu M, Wieseler K, Burdick TR, Shaw DW. Bronchial artery embolization for hemoptysis. Semin Intervent Radiol 2008;25(3):310-318. http://dx.doi.org/10.1055/s-0028-1085931 [ Links ]
16. Barben J, Robertson D, Olinsky A, Ditchfield M. Bronchial artery embolization for hemoptysis in young patients with cystic fibrosis. Radiology 2002;224(1):124-130. [ Links ]
17. Antonelli M, Midulla F, Tancredi G, et al. Bronchial artery embolization for the management of nonmassive hemoptysis in cystic fibrosis. Chest 2002;121(3):796-801. [ Links ]
18. Colson DJ, Mortelliti AJ. Management of pediatric hemoptysis: review and a case of isolated unilateral pulmonary artery agenesis. Int J Pediatr Otorhinolaryngol 2005;69(9):1161-1167. [ Links ]
19. Hurt K, Simmonds NJ. Cystic fibrosis: management of haemoptysis. Paediatr Respir Rev 2012;13(4);200-205. http://dx.doi.org/10.1016/j.prrv.2012.01.003 [ Links ]
20. Rolla M, D'Andrilli A, Rendina EA, Diso D, Venuta F. Cystic fibrosis and the thoracic surgeon. Eur J Cardiothorac Surg 2011;39:716-725. http://dx.doi.org/10.1016/j.ejcts.2010.07.024 [ Links ]
21. Ryan G, Jahnke N, Remmington T. Inhaled antibiotics for pulmonary exacerbations in cystic fibrosis. Cochrane Database Syst Rev 2012;12:CD008319. http://dx.doi.org/10.1002/14651858.CD008319.pub2 [ Links ]
22. Wang W, Li H, Tam MD, Zhou D, Wang DX, Spain J. The amplatzer vascular plug: a review of the device and its clinical applications. Cardiovasc Intervent Radiol 2012;35(4):725-740. http://dx.doi.org/10.1007/s00270-012-0387-z [ Links ]
23. Graff GR. Treatment of recurrent severe hemoptysis in cystic fibrosis with tranexamic acid. Respiration 2001;68(1):91-94. [ Links ]
24. Sopko DR, Smith TP. Bronchial artery embolization for hemoptysis. Semin Intervent Radiol 2011;28(1):48-62. http://dx.doi.org/10.1055/s-0031-1273940 [ Links ]
25. Angle JF, Siddiqi NH, Wallace MJ, et al; Society of Interventional Radiology Standards of Practice Committee. Quality improvement guidelines for percutaneous transcatheter embolization: Society of Interventional Radiology Standards of Practice Committee. J Vasc Interv Radiol 2010;21(10):1479-1486. http://dx.doi.org/10.1016/j.jvir.2010.06.014 [ Links ]
Correspondencia:
Dr. José Carlos Herrera García
Departamento de Cardioneumología de Puebla, Fundación Madonna Di Guadalupe. Av. Kepler 2143, Reserva Territorial Atlixcayotl, 72190, Puebla, Puebla, México.
Correo electrónico: jchg10@yahoo.com.mx
Notas
Los autores declaran no tener conflicto de intereses.
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/neumologia














