Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Neumología y cirugía de tórax
versión impresa ISSN 0028-3746
Neumol. cir. torax vol.73 no.3 México jul./sep. 2014
Caso clínico
Empiema necessitatis por Staphylococcus aureus
Necessitatis Staphylococcus aureus empyema
César Pedraza-Hervert, Mario Alamilla-Sánchez, Carlos Enrique Hermida-Escobedo, Ana Lilia Nolasco-de la Rosa
Centro Médico, Instituto de Seguridad Social del Estado de México y Municipios, Ecatepec (ISSEMYM).
Trabajo recibido: 22-VII-2014; aceptado: 21-VIII-2014
RESUMEN. El empiema necessitatis es un exudado localizado en el espacio pleural que se extiende a través de la pleura parietal hacia el tejido circundante formando un trayecto fistuloso. Sus agentes etiológicos más frecuentes son: Mycobacterium tuberculosis, Actinomyces israelii, S. pneumoniae, E. coli, Pseudomonas, aspergillus, anaerobios y con menor frecuencia Staphylococcus aureus. Actualmente los casos reportados de empiema necessitatis se presentan con más frecuencia en pacientes inmunosuprimidos y los factores de riesgo asociados son diabetes mellitus tipo 2, alcoholismo crónico, salud dental deficiente, enfermedad pulmonar obstructiva crónica, tabaquismo, caquexia y bronquiectasias. Reportamos el caso de un hombre de 54 años con antecedente de etilismo crónico y diabetes tipo 2 mal controlada, con padecimiento de dos semanas de evolución caracterizado por fiebre, disnea progresiva, dolor torácico y eritema, hipertermia y aumento de volumen en región subclavicular derecha. Clínicamente se documentó síndrome de derrame pleural. Con evidencia tomográfica de trayecto fistuloso y aislamiento bacteriológico se integró el diagnóstico de empiema necessitatis. El paciente cursó con un cuadro infeccioso severo que requirió manejo antibiótico y resolución quirúrgica con evolución favorable.
Palabras clave: Empiema necessitatis, diabetes mellitus tipo 2, Staphylococcus aureus.
ABSTRACT. Empyema necessitatis is a collection of exudative fluid in the pleural space extending across the parietal pleura into the surrounding tissue forming a fistulous tract. The most common etiologic agents are: Mycobacterium tuberculosis, Actinomyces israelii, Streptococcus pneumoniae, Escherichia coli, Pseudomonas aeruginosa, Aspergillus sp, anaerobes and less frequently by Staphylococcus aureus. The cases of empyema necessitatis are reported more frequently in immunosuppressed patients with risk factors such as type 2 diabetes, chronic alcoholism, poor dental health, chronic obstructive pulmonary disease, smoking, cachexia and bronchiectasis. We report the case of 54 years old male with a history of chronic alcohol abuse and poorly controlled type 2 diabetes, with history of 2 weeks of fever, progressive dyspnea, chest pain and erythema, hyperthermia and swelling in the right subclavian region. Clinically with pleural effusion syndrome. With tomographic evidence of fistulous tract and bacterial isolation the diagnosis was made. The patient had a severe infectious condition requiring antibiotic treatment and surgical resolution with excellent evolution.
Key words: Empyema necessitatis, type 2 diabetes, Staphylococcus aureus.
INTRODUCCIÓN
El derrame paraneumónico es una complicación frecuente de la neumonía bacteriana con una prevalencia del 40% y de gravedad variable. La evolución de un derrame paraneumónico puede complicarse hasta la generación de pus dentro de la cavidad pleural (empiema).1
Así, el empiema necessitatis es una colección exudativa en el espacio pleural que se extiende a través de la pleura parietal hacia tejido circundante formando un trayecto fistuloso y una masa en el tejido extra pleural. Descrito inicialmente por Guillan de Baillon en el año 1640, fue estudiado posteriormente por Laennec en 1819; y en 1940, Sindel describió la primer serie de casos incluyendo 115 pacientes.2,3
La mayoría de los casos de empiema necessitatis reportados son secundarios a infección por Mycobacterium tuberculosis, Actinomyces israelii, S. pneumoniae, E. coli, Pseudomonas, Aspergillus, anaerobios y menos frecuente por Staphylococcus aureus.2,3 En la actualidad la incidencia de empiema necessitatis es menor a lo que se reportó en los siglos XIX y XX, lo anterior es secundario al descubrimiento y uso de antimicrobianos, mejores métodos de diagnóstico y a los programas de detección y tratamiento de la tuberculosis en fases tempranas.4
Se han descrito factores de riesgo asociados a inmunocompromiso como diabetes mellitus tipo 2, alcoholismo crónico, enfermedad pulmonar obstructiva crónica (EPOC), caquexia y otros, como salud dental deficiente, tabaquismo y bronquiectasias.5
Reportamos el caso de un paciente alcohólico y diabético mal controlado que se presentó al servicio de Urgencias con disnea progresiva, disnea y dolor torácico en quien se confirmó el diagnóstico de empiema necessitatis por trayecto fistuloso que drenó a piel, creciendo en cultivo Staphylococcus aureus sensible a meticilina.
REPORTE DE CASO
Paciente masculino de 54 años que acudió al servicio de Urgencias por padecimiento de dos semanas de evolución caracterizado por fiebre, náusea, vómito de contenido gastroalimentario, disnea progresiva y dolor torácico en región subclavicular derecha con intensidad 6/10 (según la escala visual análoga), acompañada de aumento de volumen, eritema e hipertermia localizada. Como antecedentes de relevancia, el paciente refirió etilismo crónico desde los 20 años y diabetes mellitus tipo 2 mal controlada de 10 años de diagnóstico en manejo con insulinoterapia.
A su ingreso al servicio de Urgencias se documentó temperatura de 38.6 oC, frecuencia cardíaca de 100 latidos por minuto, frecuencia respiratoria de 22 por minuto, tensión arterial de 110/80 mmHg. En la exploración física se encontró deshidratado y con palidez de tegumentos ++; se detectó masa torácica de 6 x 8 cm en región subclavicular derecha, dolorosa, fluctuante con hiperemia e hipertermia local y se integró síndrome de derrame pleural derecho.
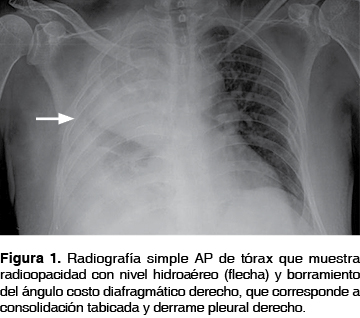
En los exámenes de laboratorio se encontró: leucocitos de 40,280 cel/mm3, neutrófilos 37,460 cel/mm3, glucosa 1,049 mg/dL, BUN 57 mg/dL, creatinina 3.3 mg/dL. En la radiografía simple anteroposterior de tórax (figura 1) mostró datos de consolidación y derrame pleural septado en hemitórax derecho. Por toracocentesis se obtuvo líquido purulento con 31,000 leucocitos, neutrófilos del 75%, glucosa de 3 mg/dL y DHL de 3,144, la gasometría del líquido pleural con pH de 6.9.
Se realizó tomografía computada simple de tórax que mostró datos imagenológicos de empiema y derrame pleural derecho con probable comunicación hacia región superior del hemitórax (figura 2). No pudo realizarse estudio contrastado por alto riesgo de nefropatía por contraste.

Se inició tratamiento antibiótico empírico con ceftriaxona más clindamicina, parte del tratamiento quirúrgico incluyó la punción y drenaje subcutáneo de masa subclavicular derecha (que obtuvo material purulento); inicialmente, se colocó sonda endopleural en el 5to. espacio intercostal derecho línea medio axilar que drenó 1,900 cc de material purulento. En el servicio de Medicina Interna el paciente cursó con evolución tórpida por mal control metabólico y falla renal aguda, por lo que requirió apoyo vasopresor durante 48 horas. Cuando hubo un adecuado control metabólico y disminución del proceso inflamatorio sistémico, se realizó por parte del servicio de Cirugía desbridación de tejido necrótico y de natas purulentas, fistulotomía y aseo del trayecto fistuloso, pleurectomía y decorticación pleural con colocación de doble sonda endopleural axilar anterior y axilar posterior en el 5to. espacio intercostal, además de sonda en orificio fistuloso para curaciones, durante la cirugía se reportó empiema loculado de aproximadamente 300 cc, cavidad pleural cubierta de natas fibrinopurulentas de predominio en base y pleura parietal engrosada de aproximadamente 1 cm con zonas de necrosis en arcos costales más comunicación hacia pared anterior de tórax en región subclavicular a nivel del 2do. espacio intercostal.
El estudio microbiológico del líquido pleural resultó negativo para Mycobacterium tuberculosis por técnica de PCR y cultivo positivo para Staphylococcus aureus meticilino sensible, por lo que no requirió ajuste de tratamiento manteniéndose por 21 días. Durante este período el paciente estuvo afebril en adecuado control metabólico con esquema de insulina basal. Dos días posteriores a la cirugía se retiró la sonda endopleural anterior, y siete días después se retiró la sonda posterior y del orificio fistuloso. El paciente egresó a los ocho días del evento quirúrgico con control radiográfico al mes que mostró reexpansión pulmonar (figura 3). Clínicamente con orificio fistuloso aún dehiscente de aproximadamente 4 mm con drenaje de escaso material purulento sin fuga aérea. Se continuó vigilancia por la consulta externa y se logró el cierre del orificio fistuloso en un mes sin complicaciones.

DISCUSIÓN
La evolución de un derrame paraneumónico es continua, en la primera etapa (exudativa) el estado inflamatorio incrementa la permeabilidad capilar y aumenta la cantidad de líquido intersticial, el cual atraviesa la pleura visceral y se acumula. En esta etapa el pH del líquido pleural y la glucosa son normales, la lactato deshidrogenasa (LDH) comúnmente es menor de 500 U/L. En la segunda etapa (fibrinopurulenta) las bacterias invaden la pleura y el líquido se vuelve turbio debido a los leucocitos, restos celulares y fibrina. En esta etapa el pH es < 7.2, la glucosa < 40 mg/dL, y la LDH > 1,000 U/L, requiriendo drenaje y tratamiento antibiótico inmediato. De no tratarse, esta colección (empiema) puede formar un trayecto fistuloso a través de la pleural parietal y diseccionar tejido circundante.1
Por lo tanto, el empiema necessitatis es una colección de fluido exudativa en el espacio pleural que se extiende a través de la pleura parietal hacia tejido circundante formando un trayecto fistuloso y una masa en el tejido extra pleural.3 Puede extenderse en varias direcciones, dando lugar a abscesos mediastínicos, pericarditis, fístulas bronquiales y esofágicas.6
El principal sitio de drenaje descrito es la pared anterior del tórax entre la línea medio clavicular y la línea axilar anterior siendo ésta la zona de menor resistencia; seguido por la pared abdominal, el espacio paravertebral y otras localizaciones menos frecuentes (esófago, bronquios, mediastino, diafragma, pericardio, retroperitoneo y en niños incluso a nivel cervical).2,4,7
El agente patógeno más frecuentemente aislado es Mycobacterium tuberculosis.4,8 Seguido de otros gérmenes como Streptococcus pneumoniae, Staphylococcus aureus, Actynomices israelii, Escherichia coli, Pseudomonas sp, Aspergillus, anaerobios; y en ocasiones, Staphylococcus aureus meticilino resistente.2-4 El Staphylococcus aureus rara vez ha sido reportado como el agente causal, sin embargo, la mayoría son sensibles a meticilina.2
El empiema necessitatis secundario a infección por Pseudomona se ha descrito principalmente en pacientes imnunodeprimidos con colonización previa de la vía aérea sobre todo en niños postrasplantados de pulmón.9
Como factores de riesgo asociados al empiema necessitatis se han descrito: alcoholismo crónico, salud dental deficiente, EPOC, tabaquismo, caquexia y bronquiectasias.5 Clínicamente los pacientes pueden estar asintomáticos, o presentar dolor torácico tipo pleurítico que aumenta con la inspiración profunda, tos no productiva y sobre todo una masa creciente y dolorosa en la pared torácica.10 En algunos casos más crónicos pueden presentarse síntomas constitucionales y fístulas cutáneas.4,5
Es importante hacer el diagnóstico diferencial con enfermedades neoplásicas como el carcinoma broncogénico y el mesotelioma.3 En la serie de casos publicada por Reyes et al., se describió la asociación de empiema necessitatis con mesotelioma y carcinoma pulmonar de células pequeñas. El empiema necessitatis asociado a neoplasia presagia un mal pronóstico con una supervivencia limitada. Los pacientes de la serie estudiada sobrevivieron un promedio de 3 a 7 meses.10
El diagnóstico diferencial puede ser particularmente difícil en los pacientes con abuso de sustancias, los cuales presentan alto riesgo de adquirir una infección pulmonar por anaerobios y Gram negativos que pueden extenderse al espacio pleural.11
Para el diagnóstico debe demostrarse la continuidad de la colección entre la cavidad torácica y el tejido circundante, requiriendo apoyo de estudios imagenológicos como la TAC de tórax y cultivo del material obtenido por punción o drenaje quirúrgico.5
Bhatt et al., demostraron la utilidad de TAC en el diagnóstico de empiema necessitatis en un reporte de caso al mostrar la continuidad entre la pared torácica y espacio pleural.12 Radiológicamente, la TAC constituye un pilar fundamental en el diagnóstico, donde se aprecia una masa pleural de paredes gruesas, bien encapsulada asociada con una masa extrapleural en la pared torácica y que en la actualidad, se considera patognomónico de empiema necessitatis.10
La resonancia magnética (RM) puede ser de gran ayuda en los casos donde los hallazgos tomográficos parecen dudosos. Stein et al., demostraron los hallazgos imagenológicos específicos por RM de un caso de empiema necessitatis, en el cual se hizo diagnóstico diferencial con neoplasia por los hallazgos no concluyentes en la TAC de tórax.13
El tratamiento del empiema necessitatis incluye drenaje quirúrgico y tratamiento antimicrobiano. Hoy, debido a la rareza del empiema necessitatis no hay reportes de defunciones en la literatura mundial, lo que indica una adecuada respuesta al tratamiento quirúrgico y antibiótico.4 En la era preantibiótica la tasa global de mortalidad fue del 66% variando de acuerdo al microorganismo implicado, de tal manera que para los casos secundarios a M. tuberculosis se reportó una tasa de mortalidad del 87% vs. 28% para los casos secundarios a S. pneumoniae.4,5,14
En resumen, se presentó el caso de una complicación rara de infección pleural en un paciente con claros factores de riesgo con curso clínico tórpido por comorbilidades de base que respondió de forma satisfactoria al tratamiento quirúrgico. Deberá establecerse el diagnóstico diferencial de esta entidad en todo paciente con factores de inmunosupresión o neumopatía crónica con infección de vía aérea inferior y datos radiológicos sugerentes de trayecto fistuloso.
REFERENCIAS
1. Villena GV, Ferrer SJ, Hernández BL, et al. Diagnosis and treatment of pleural effusion. Arch Bronconeumol 2006;42(7):349-372. [ Links ]
2. Mizell KN, Patterson KV, Carter EC. Empyema necessitatis due to methicillin-resistant Staphylococcus aureus: case report and review of the literature. J Clin Microbiol 2008;46(10):3534-3536. http://dx.doi.org/10.1128/JCM.00989-08 [ Links ]
3. Tonna I, Conlon CP, Davies RJ. A case of empyema necessitatis. Eur J Intern Med 2007;18(5):441-442. [ Links ]
4. Kono SA, Nauser TD. Contemporary empyema necessitatis. Am J Med 2007 120(4):303-305. [ Links ]
5. Llamas-Velasco M, Domínguez I, Ovejero E, Pérez-Gala S, García-Diez A. Empyema necessitatis revisited. Eur J Dermatol 2010;20(1):115-119. http://dx.doi.org/10.1684/ejd.2010.0809 [ Links ]
6. Maier HC, Gibbon JH, Sabiston DC. Surgery of the chest. 2nd ed. Philadelphia: Saunders; 1969.p.212-242. [ Links ]
7. Mirza B, Ijaz L, Sheikh A. A rare presentation of empyema necessitates. Lung India 2011;28(1):73-74. http://dx.doi.org/10.4103/0970-2113.76311 [ Links ]
8. Peverada PT. Approach to empyema necessitatis. World J Surg 2011;35(5):985. http://dx.doi.org/10.1007/s00268-011-1052-4 [ Links ]
9. Noyes BE, Michaels MG, Kurland G, Armitage JM, Orenstein DM. Pseudomonas cepacia empyema necessitatis after lung transplantation in two patients with cystic fibrosis. Chest 1994;105(6):1888-1891. [ Links ]
10. Reyes CV. Cutaneous tumefaction in empyema necessitates. Int J Dermatol 2007;46(12):1294-1297. http://dx.doi.org/10.1111/j.1365-4632.2007.03168.x [ Links ]
11. Hoover EL, Hsu HK, Minnard E. Contained thoracic empyem presenting as an anterior chest wall abscess: empyema necessitatis revisited. J Natl Med Assoc 1989;81(8):912, 914, 917. [ Links ]
12. Bhatt GM, Austin HM. CT demonstration of empyema necessitatis. J Comput Assist Tomogr 1985;9(6):1108-1109. [ Links ]
13. Stein R, Manson D. Magnetic resonance imaging findings of empyema necessitatis in a child with a group A Streptococcus infection. J Thorac Imaging 2012;27(1):W13-W14. http://dx.doi.org/10.1097/RTI.0b013e31820a94a0 [ Links ]
14. Freeman AF, Ben-Ami T, Shulman ST. Streptococcus pneumoniae empyema necessitatis. Pediatr Infect Dis J 2004;23(2):177-179. [ Links ]
Correspondencia:
Dr. César Pedraza Hervert,
Centro Médico ISSEMYM Ecatepec.
Av. Del Trabajo s/n, Colonia El Carmen,
San Cristóbal, Ecatepec de Morelos, Estado de México.
Correo electrónico: Cesarphervert@gmail.com
Notas
Los autores declaran no tener conflicto de intereses
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/neumologia














