INTRODUCCIÓN
La metahemoglobina (MHb) se reduce a desoxihemoglobina predominantemente por la enzima citocromo b5 reductasa y su concentración en condiciones normales es del 2%1. La metahemoglobinemia limita severamente la oxigenación tisular, no solo por la disminución de capacidad de transporte, sino también por la deficiencia en la cesión del oxígeno a los tejidos; por lo que se produce cianosis, fallo de la oxigenación y acidosis metabólica. La metahemoglobinemia congénita es una rara enfermedad debida a una deficiencia enzimática o a la presencia de una de las hemoglobinas M1,2.
La forma enzimática se produce por déficit de NADH-citocromo b5 reductasa y se hereda de forma autosómica recesiva con la presencia de cianosis crónica muy bien tolerada. La metahemoglobinemia adquirida es la producida por contacto o ingesta de agentes oxidantes exógenos tóxicos, como tintes de anilina, nitrobenceno, fármacos o compuestos nitrogenados de diferentes procedencias3, presentando cianosis progresiva, acidosis respiratoria, arritmias y deterioro neurológico.
Se expone un caso con los aspectos clínicos que llevaron a la sospecha de metahemoglobinemia en un paciente pediátrico, durante la valoración preanestésica y transanestésico.
REPORTE DE UN CASO
Paciente del sexo masculino, de 10 años de edad, con diagnóstico de probable hipertensión pulmonar primaria, programado para realizar cateterismo cardiaco diagnóstico.
Producto de la gesta 1, nació por vía abdominal, secundario a polihidramnios severo a las 37 SDG por Capurro, peso de 3,160 g, talla 48 cm, Apgar 7/9. Inició su padecimiento a los 2 años, con presencia de cianosis peribucal y acrocianosis, seguimiento intermitente, a los 4 años se inicia manejo con espironolactona 20 mg y enalapril 10 mg c/24 h por probable cardiopatía congénita. Ecocardiograma transesofágico, octubre 2016: normal. Paciente sin evidencia de cambios crónicos por hipertensión pulmonar, únicamente cianosis generalizada. Se interrogó al padre, quien mencionó ser jardinero con uso de múltiples fertilizantes y plaguicidas. Así como el consumo de agua corriente llevado a punto de ebullición en una zona industrial.
Transanestésico: Monitoreo tipo 1 con SpO2 inicial de 92%; FC 142 lpm; FR 34 rpm; se realizó sedoanalgesia con fentanil 80 mcg IV; propofol en perfusión 60-90 mcg IV. Ventilación espontánea con mascarilla a 4-5 l/min O2 100%; manteniendo ETCO2 de 32-36 mmHg y SpO2 90-93%; gasometrías arteriales con tendencia a la acidosis respiratoria PaO2 60, saturación arterial de O2 99%, encontrando diferencia mayor a 6 entre la SpO2 y la SaO2 importante en la saturación de oxígeno a pesar del FiO2 al 100%. Los cambios esperados de una crisis de hipertensión pulmonar al paso del contraste no se presentaron (desaturación, hipotensión y bradicardia).
Se realizó cateterismo que reportó un corazón estructuralmente normal y venas pulmonares sin alteraciones, descartando hipertensión arterial pulmonar (HAP) (figuras 1a-e). Se realizó cooximetría sugerida al salir del estudio reportando metahemoglobinemia del 40%, pH 7.32, PaCO2, PaO2 69, HCO3 22, lactato 1.3 mmol/L, solicitando manejo conjunto con toxicología, hematología y genética.
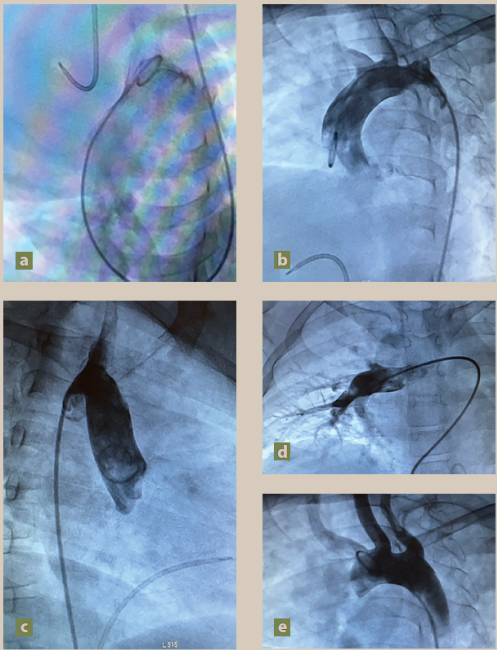
Figura 1a-e Se realizó cateterismo que reportó un corazón estructuralmente normal y venas pulmonares sin alteraciones, descartando hipertensión arterial pulmonar (HAP).
Se concluyó por sus antecedentes y la exposición a plaguicidas como factor desencadenante de la expresión de una deficiencia enzimática, ya que es un sobreviviente a una hipoxia sostenida sin déficit neurológico, requiriendo por el momento únicamente el consumo de ácido ascórbico como medida antioxidante y consumo de agua embotellada.
Discusión
La ausencia de secuelas neurológicas en nuestro paciente confirma el origen de la metahemoglobina por la deficiencia de la enzima 5b reductasa. El portador o estado heterocigoto son más susceptibles a los efectos de los agentes oxidantes como se presentó en este caso y como lo reportó Chiao-Yi Lin en un paciente femenino de 35 años previo a la inducción anestésica1. Los agentes que aceleran la oxidación en el perioperatorio son: lidocaína, prilocaína y nitritos, tomando en cuenta el antecedente de uso de plaguicidas por el padre se agrega un desencadenante3. En las gasometrías de control, nuestro paciente presentó tendencia a la acidosis respiratoria sin criterios para el uso de azul de metileno, ya que la frecuencia cardiaca y la tensión arterial se mantuvieron dentro del percentil 50. El transporte de oxígeno a nivel tisular no se encontró alterado y se mantuvo monitoreado por el control gasométrico arterial en todo momento. Como lo documentó Chiao-Yi Lin, un hecho muy importante es que la mayoría de los casos reportados en la literatura son en adultos y este caso, al ser de un paciente pediátrico que vivió durante años como un paciente cardiópata, que no lo era, permite a otros especialistas tomar en cuenta el diagnóstico diferencial de una hipertensión arterial pulmonar a través de un adecuado interrogatorio en este grupo etario. Otras entidades a considerar como diagnostico diferencial, por la presencia de cianosis severa, son las concentraciones crecientes de:
Sulfhemoglobina. Menos común, la cianosis está presente cuando la sulfhemoglobina supera los niveles de 0,5 g/dL4.
Hemoglobina desoxigenada. La disminución de la saturación de oxígeno de la hemoglobina es la causa más común de cianosis, que se observa cuando el nivel de hemoglobina desoxigenada excede de 4 a 5 g/dL. La cianosis puede ser central, como en la insuficiencia respiratoria grave o shunts de derecha a izquierda o periférica, en la que el incremento en la extracción de oxígeno por los tejidos provoca un incremento de la sangre desoxigenada en el lado venoso del lecho capilar.
Otros diagnósticos diferenciales:
El diagnóstico diferencial de la cianosis también incluye:
Anemia.
Asma.
Insuficiencia cardíaca congestiva4.
El diagnóstico diferencial de la coloración azulada de la piel también incluye:
Acrodermatitis enteropática.
Pigmentación de la piel inducida por amiodarona.
Argiria4.
Conclusiones
En este reporte de caso, nosotros hacemos una recomendación: que al sospechar de esta entidad debe de haber una necesidad de realizar una cooximetría y una FIO2 al 100%, evitar el uso de lidocaína por ser un agente acelerador de la oxidación de hemoglobina y considerar el uso de azul de metileno en pacientes con deterioro severo, principalmente en caso de sospechar una causa toxicológica. Así como el apoyo multidisciplinario de hematología, genética y toxicología para continuar el manejo de esta entidad y así disminuir la morbimortalidad. De la misma manera, no olvidar el uso de anestésicos locales tópicos cuya toxicidad resulta por dos mecanismos diferentes: disfunción del sistema nervioso central debido al efecto de la lidocaína y metahemoglobinemia por la prilocaina5.











 nueva página del texto (beta)
nueva página del texto (beta)




