INTRODUCCIÓN
El síndrome respiratorio agudo severo y su enfermedad, la COVID-19, provocado por el SARS-CoV-2, se puede acompañar de un amplio espectro de manifestaciones neurológicas1. Un estudio prospectivo de más de 4 mil individuos con COVID-19 en la ciudad de Nueva York encontró complicaciones neurológicas en el 13.5% de los infectados; los problemas más frecuentemente encontrados en este estudio fueron encefalopatía, convulsiones y eventos cerebrovasculares2. Algunos de los trastornos neurológicos menos frecuentes asociados a la COVID-19 son: meningitis, encefalomielitis diseminada aguda, encefalopatía necrotizante hemorrágica aguda, enfermedad cerebrovascular, síndrome de Guillain-Barré, neuropatía craneal múltiple, disautonomía, miopatías3 y mielitis transversa aguda (MTA)4. Sin embargo, otros investigadores han encontrado que síntomas como cefalea, mialgias y problemas de atención, se presentan hasta en un 73% de los pacientes hospitalizados por COVID-19; en contraste, las encefalitis no específicas representan el 13-40% de todas las manifestaciones neurológicas. Los síndromes postinfecciosos a la COVID-19 incluyen encefalomielitis desmielinizante aguda (ADEM), encefalopatía necrotizante aguda (ANE), encefalitis de Bickerstaff, mioclonías generalizadas, mielitis transversa aguda (MTA), encefalitis límbica y encefalitis misceláneas; además, enfermedades cerebrovasculares agudas como eventos cerebrovasculares tanto isquémicos como hemorrágicos, trombosis venosa cerebral y encefalopatía posterior reversible. La manifestación principal en el sistema nervioso periférico de la COVID-19 es el síndrome de Guillian-Barré y, en menor grado, el síndrome de Miller Fischer, la polineuritis cranialis y la diplejía facial5.
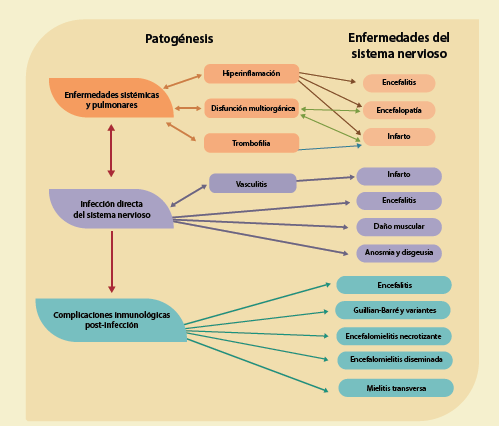
Los mecanismos que se han propuesto para explicar los efectos de la COVID-19 en los padecimientos neurológicos asociados son 3: 1) síndrome de respuesta inflamatoria sistémica y falla multiorgánica; 2) infección directa del sistema nervioso central por el coronavirus SARS-CoV-2 (neurotropismo) y 3) síndromes que se originan por la respuesta inmunológica posterior a la infección6-8 (figura 1). En este último mecanismo, la inmunopatogénesis puede deberse a la infiltración perivascular por monocitos y linfocitos, con una respuesta inflamatoria de células diversas como las neuronas y los oligodendrocitos, debido a que prácticamente no se ha podido detectar al virus SARS-CoV-2 en el líquido cefalorraquídeo de los pacientes con complicaciones neurológicas.
MIELITIS TRANSVERSA AGUDA (MTA)
En los más de 50 millones de individuos que se han enfermado de COVID-19 en el mundo, hay pocos casos que desarrollan complicaciones neurológicas raras. Debido al impacto discapacitante en los pacientes, se vuelve urgente comprender la etiología de su enfermedad para el manejo terapéutico efectivo de corto y largo plazo. A raíz del seguimiento de un caso único de una paciente mexicana con mielitis transversa aguda (MTA; artículo en preparación), llevamos a cabo una revisión de los casos de MTA asociados a la COVID-19. La MTA se define como un cuadro inflamatorio focal de la médula espinal y representa un subgrupo de mielopatías agudas en las que la inflamación dentro de la médula espinal es una condición para su diagnóstico9. La MTA es un déficit neurológico discapacitante que incluye debilidad, pérdida sensitiva y una disfunción del sistema nervioso autónomo; tiene una incidencia de 1-4 casos por año por millón de habitantes, afecta a individuos de todas las edades y es una causa de discapacidad en el mundo10. La MTA se asocia con una gran variedad de etiologías y para su abordaje se dividen en compresivas y no-compresivas. Las causas no-compresivas incluyen enfermedades infecciosas, autoinmunes, isquémicas, paraneoplásicas, efectos de radiación, postvacunales, postinfecciosas e idiopáticas.
El diagnóstico etiológico de una MTA representa un desafío para el equipo médico porque está asociada con una morbimortalidad significativa, y porque hasta un 60% de los pacientes afectados evolucionan hacia una discapacidad de moderada a permanente y severa11,12. En la figura 2 se resumen los criterios diagnósticos de la MTA y en la figura 3 uno de los algoritmos de abordaje clínico que se siguen para establecer su diagnóstico13.

Figura 3 Mecanismos propuestos para las manifestaciones neurológicas producidas por la COVID-19: el síndrome de la respuesta inflamatoria sistémica; la infección directa del sistema nervioso central por el coronavirus SARS-CoV-2 (neurotropismo) y los síndromes se originan por la respuesta inmunológica posterior a la infección6-8
MTA asociada a la COVID-19
A partir de una revisión bibliográfica en la base de datos PubMed, utilizando las palabras clave “COVID-19, SARS-CoV-2, transverse myelitis, demyelination”, se encontraron 221 artículos, de éstos se descartaron: cartas al editor, revisiones, casos de pacientes sin prueba positiva para el SARS-CoV-2 y vacunados; se identificaron 39 casos de MTA asociada a COVID-19 de los cuales 3 fueron niños14-16 (tabla 1); 29 son casos únicos, mientras 5 estudios documentaron un par de pacientes17-21 en el contexto de la COVID-19. Los pacientes tuvieron origen europeo, árabe, americano, africano y asiático; 67% fueron del sexo masculino. La edad promedio fue de 49 ± 19 años, con una mediana de 51 años. La mayoría de los pacientes no tenía comorbilidades y en los pocos casos fueron: hipertensión22-24, diabetes tipo 219,25, hiperlipidemia22,26 e hipotiroidismo27.
Tabla. Demografía y presentación clínica
| Referencia | Sexo | Edad | País | Hallazgos neurológicos (N) | Latencia (N, días) |
|---|---|---|---|---|---|
| Abdelhady | H | 52 | Qatar | Paraparesia flácida de miembros inferiores; continencia urinaria | 1 |
| Advani | H | 47 | Irán | Parálisis de miembros inferiores; continencia urinaria | 10 |
| Advani | M | 67 | Irán | Paraparesia de miembros inferiores | - |
| Ahmad | M | 34 | Iraq | Paraparesia bilteral de miembros inferiores | 14 |
| Ali | H | 56 | Qatar | Parálisis de miembros inferiores; continencia urinaria | 4 |
| Ali | H | 43 | Qatar | Parálisis de miembros inferiores; continencia urinaria | 5 |
| Alketbi | H | 32 | EAU (Asia) | Parálisis de miembros superiores e inferiores, debilidad en el tronco, continencia urinaria | 2 |
| Arslan | H | 44 | Turquía | Parálisis de miembros inferiores; continencia urinaria | 60 |
| Arslan | H | 73 | Turquía | Parálisis de miembros inferiores; continencia urinaria y fecal | 60 |
| Börü | H | 42 | Turquía | Parálisis de miembros inferiores; continencia urinaria | 13 |
| Chakraborty | M | 59 | India | Paraplejia flácida y arreflexia de miembros inferiores, continencia urinaria | 4 |
| Chow | H | 60 | Australia | Hiperreflexia, propiocepción reducida en miembros inferiores, parestesia hasta el ombligo | 16 |
| Dias da Costa | H | 31 | Portugal | Hiperestesia miembros inferiores; continencia urinaria | 21 |
| Doukas | H | 40 | EUA | Hiperestesia en los pezones (T4) y debilidad miembros inferiores | 12 |
| Durrani | H | 24 | EUA | Paraplegia flácida y arreflexia de miembros inferiores, contingencia urinaria | 12 |
| Fonseca | H | 84 | Portugal | Parálisis de miembros inferiores; continencia urinaria, hipoestesia | 14 |
| Kara | M | 39 | EUA | Parálisis de miembros inferiores; continencia urinaria | 90 |
| Kilbertus | H | 46 | Canadá | Hiperreflexia en las extremidades superiores e inferiores, clonus sostenido en tobillos; continencia urinaria | 1 |
| Koc | H | 59 | Turquía | Tetraparesia de las extremidades inferiores; continencia urinaria | 14 |
| Koc | M | 49 | Turquía | Parálisis de miembros inferiores; continencia urinaria y fecal | 12 |
| Lee | M | 35 | Reino Unido | Paraparesia bilteral de miembros inferiores, contingencia urinaria | 5 |
| Lu | M | 66 | Australia | Paraparesia bilteral de miembros inferiores, contingencia urinaria | 3 |
| Masuccio | M | 70 | Italia | Hiperreflexia, cuadriparesia superior y de miembros inferiores, continencia urinaria | 15 |
| Moreno Escobar | H | 41 | EUA, India | Paraparesia bilteral de miembros inferiores, contingencia urinaria y fecal | 8 |
| Munz | H | 60 | Alemania | Paraparesia bilteral espástica de miembros inferiores, hiperrreflexia, contingencia urinaria | 13 |
| Nejad | M | 11 | Irán | Parálisis de miembros inferiores; continencia urinaria y fecal | 3 |
| Palahuta | H | 23 | Ukrania | Parálisis de miembros inferiores; continencia urinaria y fecal | 20 |
| Pandya | H | 60 | Reino Unido | Parálisis de miembros inferiores; continencia urinaria | 1 |
| Pourmoghaddas | M | 9 | Irán | Parálisis de miembros inferiores; continencia urinaria | 1 |
| Poyrazoğlu | H | 10 | Turquía | Debilidad de miembros superiores e inferiores | 16 |
| Prete | M | 43 | EUA | Cuadriplejia; continencia urinaria | 10 |
| Rifino | H | 66 | Italia | Paraparesia espástica miembros inferiores, acroparestesia, hiperreflexia con clonus distal bilateral, | 24 |
| Rifino | H | 62 | Italia | Paraparesia bilteral de miembros inferiores, nivel sensorial T11 | - |
| Sarma | M | 28 | Dinamarca | Paraparesia bilteral de miembros inferiores, contingencia urinaria | 8 |
| Shahali | H | 63 | Irán | Paraparesia bilteral de miembros inferiores, nivel sensorial T2 | 4 |
| Sotoca | M | 69 | España | Hipoestesia facial derecha y mano izquierda, debilidad interósea mano izquierda, hiperreflexia general | 8 |
| Valiuddin | M | 61 | EUA | Cuadriparesia espástica, hiperrreflexia, nivel sensorial C3, | 10 |
| Yang | H | 57 | EUA | Entumecimiento, parestesia, paraparesia bilateral de las extremedades inferiores; contingencia urinaria | 21 |
| Zachariadis | H | 63 | Suiza | Paraparesia bilteral de miembros inferiores, nivel sensorial T10, continencia urinaria | 12 |
| Zhao | H | 66 | China | Tetraparesia, hiporreflexia de miembros inferiores, nivel sensorial T10 | 8 |
PRESENTACIÓN CLÍNICA
Las pruebas diagnósticas de la MTA se basan en la presunción clínica, ante la cual se debe solicitar una resonancia magnética de la médula espinal contrastada con gadolinio y punción lumbar diagnóstica (deseable) para estudio del líquido cefalorraquídeo (pleocitosis leve a expensas de linfocitos, hiperproteinorraquia, índice de IgG y albúmina); y análisis de biomarcadores de inflamación. Los síntomas neurológicos de los pacientes que padecieron simultánea o previamente la COVID-19 correspondientes al cuadro de MTA, comprenden la triada clásica: debilidad de las extremidades, déficit sensitivo y disautonomía manifestada como disfunción sexual, incontinencia/retención urinaria y/o fecal (tabla 1). La progresión de la MTA a partir de la aparición de los síntomas neurológicos se ha estimado en un rango de 6 horas a 7 días4. Se observó que los síntomas neurológicos aparecen de forma simultánea15,28,29,30 y hasta 3 meses después de haberse confirmado la infección por el SARS-CoV-2 con una prueba de PCR y/o de antígeno. Los síntomas de COVID-19 más frecuentes fueron fiebre, tos, disnea, rinorrea y mialgia y fueron tratados en casa sin necesidad de hospitalización (casos leves). Ninguno de los individuos había tenido previamente un episodio de MTA u otras complicaciones autoinmunes del sistema nervioso central.
Los resultados de los análisis de laboratorio fueron heterogéneos, desde individuos con síndrome inflamatorio sistémico de moderado a incompleto con leucocitosis20,31,32; niveles de proteína C reactiva normales, incrementos discretos22,33,34 o muy elevados15,23,25; linfocitopenia33,36 y niveles elevados de dímero-D22. Los análisis serológicos de enfermedades sistémicas inflamatorias o autoinmunes fueron negativos para anticuerpos contra acuaporina-4, anticuerpos comúnmente asociados con lupus eritematoso sistémico, proteínas “S” y “C”, anticuerpos antineutrófilo citoplasmáticos, factor reumatoide, anticuerpos antifosfolípidos como anticardiolipina y antiglicoproteína beta 217; un caso con anticuerpos contra la glicoproteína del oligodendrocito asociado a la mielina (MOG-IgG)37 y otro anti-MOG IgG y contra la descarboxilasa del ácido glutámico (GAD65), indicativos de una enfermedad autoinmune del sistema nervioso central24.
Los hallazgos en el líquido cefalorraquídeo fueron heterogéneos y reflejaron cierto grado de inflamación22,23,37,38. Por ejemplo, en el líquido cefalorraquídeo de un paciente se encontró pleocitosis de 230 células (56% de linfocitos, 32% de neutrófilos), hiperproteinorraquia de 62 mg/dL y glucosa de 44 mg/dL. El cultivo y la PCR fueron negativos para Borrelia burgdorferi, el virus de la varicela-zoster, enterovirus, el virus del herpes simple tipo 1 y 2, el antígeno criptococal, citomegalovirus y VDRL37. Otros mostraron pleocitosis moderada con hiperproteinorraquia muy elevada (790 mg/L)22,23 o con hiperproteinorraquia aislada (2.83 g/L), normoglucorraquia y cultivos negativos para bacterias y virus38.
Hubo 3 casos de asociación entre SARS-CoV-2 y mielitis por detección del SARS-CoV-2 en el líquido cefalorraquídeo por inmunoensayo26,40 o PCR16; en el resto de los casos la asociación fue solo probable porque hubo clara evidencia de la infección previa por SARS-CoV-2 y ninguna otra evidencia de causas probables de la MTA.
ESTUDIOS DE IMAGEN POR RESONANCIA MAGNÉTICA (IRM)
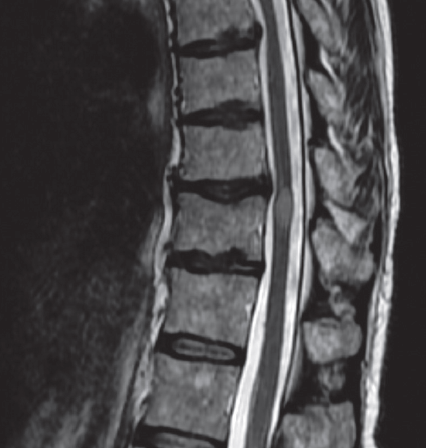
A todos los individuos se les realizó estudio de IRM de la médula espinal; se observó hiperintensidad T2 clásica en la médula espinal y la localización fue central con extensión a lo largo de la mayor parte del diámetro transverso. En la mayor proporción de los 39 pacientes analizados se afectó exclusivamente el subsegmento torácico (44%)14,18-20,22-24,26,30,32-34,37,40-43; en 23% la lesión involucró el subsegmento cérvico-torácico15,17,18,20,26,31,36,38,44; en menor grado fueron el subsegmento cervical (13%)16,17,33,44,45, los subsegmentos cérvico-toraco-lumbar28,46, y toraco-lumbar19,27 en 2 individuos (15%) y solo 1 caso (2.5%) en el subsegmento lumbar21; 1 caso fue difuso21 y en otro caso no se pudo hacer el estudio47. En la mayoría de los individuos (76%) la lesión se extendió sobre 2 o más segmentos espinales, característico de la mielitis transversa longitudinalmente extensa (tabla 1). En algunos individuos las hiperintensidades T2 fueron en parches20,26,31,38),(42, mientras que en la mayoría fueron continuas. Se encontró un caso único de post-COVID-19 con cerebelitis, MTA y polineuropatía desmielinizante inflamatoria aguda, lo que demuestra que la COVID-19 puede provocar daño simultáneo del sistema nervioso central y periférico31. En la figura 4 se muestran las IRM de una paciente mexicana con MTA asociada a la infección de SARS-CoV-2 (comunicación personal; consentimiento informado).

La RM se realizó 8 días posterior al inicio de los síntomas, sin uso de contraste (comunicación personal). a) Secuencia T2 que muestra hiperintensidad correspondiente a la lesión longitudinalmente extensa en segmentos T8-T11. b) Se presenta como isointensa en secuencia T1. c) Hiperintensa en STIR (short tau inversion recovery). d) El corte transversal muestra la lesión y predominio en cordones posteriores, concordante con el predominio en sintomatología propioceptiva de la paciente. Las secuencias fueron obtenidas del centro en el cual se realizó el abordaje inicial y son reproducidas con consentimiento de la paciente (se anexa carta de consentimiento).
Figura 4 Hallazgos en resonancia magnética (RM) de la médula espinal toracolumbar
TRATAMIENTO Y RECUPERACIÓN
Los pacientes recibieron terapia inmunomoduladora con metilprednisolona intravenosa, 1 g al día por un lapso de 3-5 días y, posteriormente, cursos variables de esteroide oral en esquemas de reducción convencionales hasta por 3 semanas. Cuando no se observó mejoría, se utilizó plasmaféresis terapéutica14,16,21,27,38,43,45. Se administraron antivirales o antibióticos en pocos casos. El aciclovir fue el antiviral más utilizado.
De forma general, el pronóstico funcional de los pacientes que cursan con MTA autoinmune (inflamatoria) depende de varios factores: la severidad del episodio, la localización y extensión de la lesión, el reconocimiento e instauración de tratamiento temprano para limitar secuelas y la etiología13. A mayor severidad de los síntomas iniciales, tanto en su presentación como velocidad de evolución, mayor grado de secuelas y discapacidad funcional, ya que se infieren cuadros más agresivos que rápidamente involucran múltiples funciones de los pacientes. Las lesiones localizadas de forma más rostral dentro de la medula espinal (cervicales o torácicos altos) generalmente afectan tanto a las extremidades superiores como a las inferiores, generando mayor grado de discapacidad y limitación funcional secuelar, así como las lesiones longitudinalmente extensas involucran más segmentos y por lo tanto más sistemas afectados.
Mientras más oportuno sea el reconocimiento y la instauración de terapia inmunomoduladora, se limita con mayor velocidad el daño y la producción de autoanticuerpos, que es el mecanismo de daño común en todas las etiologías.
Finalmente, la etiología, cuando se puede demostrar, nos informará si se trata de un evento aislado (curso monofásico) o si el paciente corre el riesgo de recurrencia y, por lo tanto, de acúmulo de daño y secuelas en un futuro. Aunque el pronóstico de cada uno de los casos es variable y multifactorial, se sabe que en cada episodio de mielitis se genera algún grado de desmielinización que no podrá ser reparada ni recuperada y que, únicamente con rehabilitación física se podrá recuperar un porcentaje de la función que antes se tenía.
DISCUSIÓN
Los 39 casos de MTA asociados al SARS-CoV-2 son reportes de casos individuales, por lo que no se puede demostrar causalidad en ninguno de ellos, ni pueden clasificarse como mielitis infecciosa por SARS-CoV-2 porque en muy pocos casos se pudo detectar el RNA del virus por PCR en el líquido cefalorraquídeo16,25, y los estudios no incluyeron el análisis anatomopatológico directo de biopsias de la médula espinal afectada. Es de resaltar, que en un estudio de cohorte prospectivo extenso de manifestaciones neurológicas en la COVID-19, no identificaron ningún caso de mielitis entre los 4,491 individuos infectados2. A pesar de que el periodo de estudio y seguimiento de los 39 pacientes (9-84 años de edad) no fue suficiente para excluir esta posibilidad, ninguno de los casos de la cohorte mostró signos de laboratorio o imagen sugerentes de una enfermedad autoinmune que podría manifestarse con MTA, como el espectro de desórdenes de la neuromielitis óptica (NMOSD) o manifestaciones de la médula espinal de enfermedades autoinmunes sistémicas48. La interpretación de los casos descritos tiene enormes limitaciones por el número reducido de casos disponibles, el rango de edades, ascendencias y, en pocos casos, datos incompletos.
Otra potencial estrategia para determinar si el SARS-CoV-2 es responsable de los casos de MTA es comparar la incidencia de mielitis antes y después de la pandemia de SARS-CoV-2. La incidencia de la MTA es de 1-4 casos por millón de individuos al año en cualquier población49,50. Este número aumenta a 32 casos en 1 millón por año si se consideran los pacientes con un desorden autoinmune51. Las características demográficas refuerzan la noción de que los casos descritos representan mielitis causadas (causalidad vs asociación) por la infección de SARS-CoV-2. Los individuos afectados fueron de ascendencias y edades heterogéneas con una predominancia del 67% del sexo masculino y una edad promedio de 49 ± 19 años (tabla 1), lo cual no está en concordancia con la epidemiología de la MTA por otros trastornos autoinmunes del sistema nervioso central, en los que predominan las mujeres jóvenes. Las cohortes observacionales de la MTA de cualquier causa muestran una distribución bimodal de edad con máximos a los 10 y 20 años y luego a los 30 y 40 años con una edad promedio de inicio entre los 35 y 40 años51. Las distribuciones por sexo y edad de los casos (tabla 1), ocurren más frecuentemente en hombres e individuos de mayor edad52. Por último, en contraste con otras manifestaciones del sistema nervioso por infección de SARS-CoV-2, los individuos con mielitis no desarrollaron una COVID-19 severa.
HIPÓTESIS DEL ORIGEN DE LA MTA ASOCIADA A INFECCIÓN POR SARS-COV-2
Existen varios mecanismos por los cuales el SARS-CoV-2 puede desencadenar manifestaciones en la médula espinal.
Primero, se sabe que los coronavirus pueden ser neuroinvasivos y provocar tanto una desmielinización como una respuesta inflamatoria sistémica y local53. La expresión de receptores de la enzima convertidora de angiotensina 2, receptor del SARS-CoV-2, en las membranas de las neuronas de la médula espinal, apoyan la idea de que el virus destruye directamente la mielina55. Sin embargo, este mecanismo es poco probable debido a que no se ha detectado RNA viral en el líquido cefalorraquídeo o tejidos del SNC de enfermos de COVID-192,21,55-58.
La segunda posibilidad es que la MTA es un daño indirecto por la COVID-19 o por la tormenta de citocinas38,59. Sin embargo, en los casos de MTA asociados al SARS-CoV-2 la enfermedad fue de leve a moderada.
La tercera posibilidad del origen de la MTA por COVID-19 es por una enfermedad para o postinfecciosa. En este análisis, la latencia del inicio de los primeros síntomas de COVID-19 a los primeros signos de mielitis (mediana de 11 días) sugiere este mecanismo. En la literatura no existe una definición clara de cuando una enfermedad deja de ser para-infecciosa para convertirse en postinfecciosa. La latencia de los casos descritos de MTA asociada a COVID-19 es menor que lo observado en, por ejemplo, el síndrome de Guillain-Barré (mediana de 23 días)60. Por otra parte, todos los casos fueron positivos para SARS-CoV-2, por PCR de hisopado nasofaríngeo y/o por una prueba de antígeno, cuando se presentaron los signos de mielitis. En consecuencia, de ser el disparador de la mielitis la infección de SARS-CoV-2, el mecanismo más probable sería autoinmune sin una clara diferencia entre procesos para y postinfecciosos en ese momento. Si se tratara de un mecanismo parainfeccioso de mielitis asociado a SARS-CoV-2, surge la pregunta, ¿cuál es la estrategia terapéutica más apropiada? En los casos descritos da la impresión de que falló el tratamiento con esteroides en la mayoría de los pacientes. De confirmarse que la MTA es una enfermedad postinfecciosa, otra opción sería el tratamiento intravenoso con inmunoglobulinas (IVIg) como fue en uno de los casos25.
CONCLUSIONES
La mayoría de los casos descritos en esta revisión tienen una mielopatía que cumple con los criterios de mielitis transversa longitudinalmente extensa (MTLE). Aunque las causas más frecuentes de MTLE son desordenes del espectro de neuromielitis óptica, hay varias otras causas potenciales que incluyen infecciones virales. Hay virus que tienen una mayor tendencia a causar MTLE que otros, como son los flavivirus y enterovirus. Los virus de la familia Herpesviridae; herpes simple tipo 2; virus varicela zoster; virus de Epstein-Barr; los citomegalovirus tienden a causar MTA de segmento corto61,62. Por consiguiente, con base en los casos reseñados en este trabajo, el periodo infeccioso o postinfeccioso por SARS-CoV-2 se suma a la lista de causas probables de MTLE y se vuelve relevante porque las secuelas que produce son de largo plazo en comparación con la MTA de segmento corto51. Lamentablemente a los casos reseñados muy probablemente no se les dará seguimiento y la mayoría se mantiene en recuperación con fisioterapia y rehabilitación22.
Aun cuando el porcentaje total de individuos con secuelas por la COVID-19 no se conoce y los casos reportados de mielitis asociada son escasos, es importante un escrutinio y seguimiento detallado de los pacientes, debido a que seguramente están subreportados los casos documentados de MTA asociados a COVID-19.











 nueva página del texto (beta)
nueva página del texto (beta)