INTRODUCCIÓN
Cuando la administración de un fármaco a dosis habituales genera en el paciente una reacción nociva de manera no intencionada, estamos ante la presencia de una reacción adversa a medicamentos (RAM)1. La piel es uno de los órganos más afectados al momento de manifestar una RAM, en un fenómeno denominado farmacodermias2. Este tipo de eventos pueden ser desde una leve urticaria hasta la aparición de patologías que llegan a poner en riesgo la vida del paciente, como lo es el síndrome de Stevens Johnson (SSJ) y la necrólisis epidérmica tóxica (NET)2-4. Ambas son reacciones intensas y extensas que se caracterizan por la necrosis de los tejidos dérmicos y mucosas, partiendo de un mismo principio fisiopatológico basado en una hipersensibilidad tipo IV frente a los queratinocitos cuya diferencia radica en la superficie corporal afectada. Cuando esta es menor al 10% de la superficie corporal se le conoce como SSJ; mientras que una afectación del 30% o más, recibe el nombre de NET; si dicha afectación se encuentra entre el 10 y el 30%, le denominamos superposición SSJ/NET3-5.
Debido a su baja incidencia, este binomio es considerado una enfermedad rara. Presenta una alta mortalidad, con variaciones significativas de presencia entre razas5-6. Se ha descrito que hasta un 80% de los casos se relaciona con la ingesta de algún agente farmacológico, como antibióticos, antiepilépticos o antineoplásicos, mientras que el resto se relaciona a patologías infecciosas, neoplásicas y apariciones de carácter idiopático. El diagnóstico es meramente clínico, y en los principales hallazgos logramos encontrar la evolución rápida de las lesiones maculares que avanzan a pápulas y posteriormente a bulas, eritema, fiebre, odinofagia, signo de Nikolsky y la mejora posterior tras la suspensión del agente desencadenante, esto último junto con un correcto manejo terapéutico se refleja con la disminución de la mortalidad del paciente3-7.
Se presenta el caso de una paciente de 74 años, que acudió a esta unidad de salud tras la ingesta de cotrimoxazol, conocido en nuestro medio como trimetoprima/sulfametoxazol.
CASO CLÍNICO
Paciente del sexo femenino de 74 años, originaria y residente de Minatitlán, Veracruz, México. Sin antecedentes heredofamiliares de importancia para el evento actual. Antecedentes patológicos personales: diagnóstico de diabetes mellitus tipo 2 de larga evolución, tratada con insulina de acción intermedia (30 UI cada 24 horas) con mal apego al tratamiento, así como hipertensión arterial sistémica con reciente diagnóstico, manejada con losartán (50 mg cada 12 horas). Antecedentes quirúrgicos y anestésicos positivos, esquema de vacunación acorde al grupo de edad sin inmunizaciones recientes, alérgicos interrogados y negados.
El padecimiento actual inició el 10-09-2019, con disuria, febrícula, dolor abdominal en hipogastrio, y tenesmo vesical; acudió el 13-09-2019 a su unidad médica de adscripción en donde se estableció el diagnóstico de infección de vías urinarias, por lo que se inició manejo con comprimidos de trimetoprima/sulfametoxazol, a dosis de 80/400 mg, cada 12 horas por 7 días de manera ambulatoria.
Seis horas después de la primera ingesta del medicamento, inició con fiebre de 38.5° C, odinofagia, eritema, prurito y dolor urente en cuello, tórax, abdomen y miembros pélvicos. Debido a la presencia de fiebre, dolor articular en el servicio de urgencias se estableció el diagnóstico de caso probable de dengue. La biometría hemática mostró resultados en parámetros normales. El examen general de orina mostró un pH de 5.0, orina de aspecto turbio, con flora bacteriana mixta, células epiteliales, leucocitos y filamentos de mucina, lo que se relaciona con el diagnóstico otorgado por el primer nivel de atención.
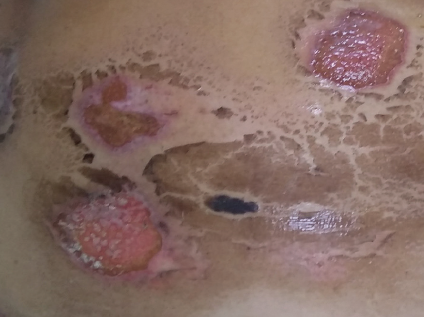
El 15-09-2019, presentó vesículas incontables en abdomen, glándulas mamarias y miembros superiores, presentando signo de Nikolsky positivo, por lo que se estableció el diagnóstico de SSJ, se inició tratamiento con metilpredinisolona 1 g intravenosa en 250 cc de solución salina, hidroxicina 250 mg cada 8 horas, ranitidina 50 mg cada 12 horas, metoclopramida 100 mg cada 8 horas, cefotaxima 1g cada 8 horas y manejo de la hipertensión arterial sistémica y de la diabetes mellitus, con el esquema habitual previo a su ingreso. El día 20-09-2019 se añadió ácido micofenólico 500 mg vía oral cada 12 horas. El 24-09-2019 (figura 1), se remplazó la metilprednisolona por succinato de metilprednisolona 125 mg intravenosa cada 8 horas y prednisona 50 mg vía oral cada 24 horas; un día después se inició manejo tópico de las heridas con ketanserina y antisépticos tópicos, y se suspendió el succinato de metilprednisolona.

Imagen: Vargas et al.
Figura 1 Fotografía tomada el 24 de septiembre de 2019, cuando la paciente presentaba 11 días de su ingreso, pese a no tener la documentación de su llegada observamos la extensión que abarco la farmacodermia, así como las principales zonas afectadas, se destacan aún la presencia activa de diversas lesiones en forma de úlceras, con bordes irregulares, no dolorosas al momento de la fotografía, afectando principalmente la región mamaria, el abdomen y en la región del bajo vientre.
El 07-10-2019 se dio de alta por mejoría de las lesiones (figura 2) y control de las comorbilidades, se suspendió el manejo antibiótico, y continuó el manejo hospitalario con ácido micofelónico 500 mg cada 12 horas, prednisona 25 mg cada 24 horas, luego 5 mg cada 12 horas por 15 días y suspensión metrotexate 2.5 mg 3 veces a la semana, así como manejo de las comorbilidades con la terapéutica anteriormente mencionada.
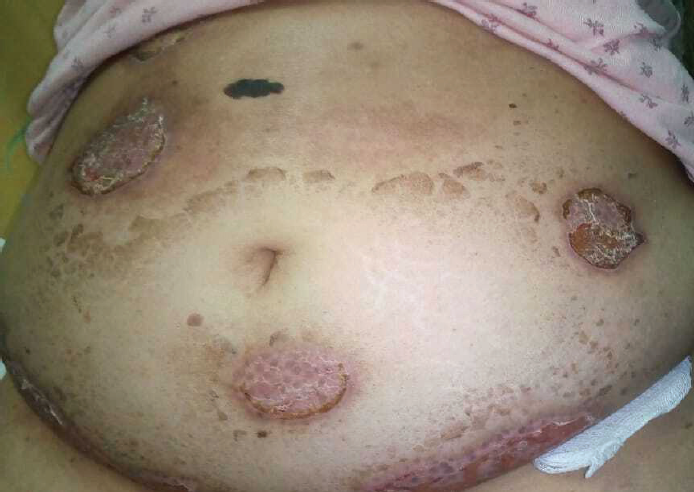
Figura 2 Fotografía del 07-10-2019, al alta de la paciente, las lesiones han evolucionado en forma de costras con una adecuada cicatrización al momento.
Tres semanas después de su ingreso, la paciente continuó con la terapéutica anteriormente mencionada, y presentó una clara mejoría en sus lesiones y su estado general (figura 3).
DISCUSIÓN
El cotrimoxazol es un fármaco antibiótico que consta de la sinergia en proporción 1:5 entre la trimetoprima, una diamopiridinina antagonista de la enzima dihidrofolatorreductasa, y el sulfametoxazol, una sulfaziadina análogo competitivo del ácido paraaminobenzoico, y cuyos componentes intervienen en puntos distintos para la síntesis de folatos a nivel bacteriano, lo que genera en el microorganismo el cese de diversos procesos metabólicos8. Pese a su uso generalizado en la práctica médica, en diversos estudios realizados en nuestro país se ha determinado uno de los principales causantes de farmacodermias con una frecuencia alrededor del 10%9-10.
Entre las farmacodermias, se encuentra el SSJ/NET, que se define por una reacción mucocutánea resultado de la hipersensibilidad hacia algún agente terapéutico, aunque en diversas ocasiones puede deberse a agentes infecciosos. Es una urgencia que requiere la inmediata atención debido al compromiso sistémico que representa. Si bien, están originadas en el mismo principio fisiopatológico, la extensión de la superficie corporal afectada es el principal punto que debemos considerar para la clasificación de estos eventos1-4.
Hsu y cols. reportan un intervalo en la prevalencia estimada de SSJ/NET que varía entre 1 hasta 9 casos por millón de habitantes en los Estados Unidos, con un 58.7% de los casos en mujeres y una mayor incidencia en la raza asiática11. Micheleti y cols., mediante un estudio retrospectivo y multicéntrico, reportaron 337 casos durante un periodo de 15 años, de los cuales el 89.7% de estos se atribuyó a la ingesta de medicamentos, siendo el cotrimoxazol el fármaco desencadenante más identificado, con un 26.3% de los casos relacionados al consumo de medicamentos6. A menor escala, de un total de 30 casos estudiados en el Departamento de Dermatología de la Universidad de Puerto Rico, entre 2006 y 2017, se relacionaron 17 a la ingesta de antibióticos, de los cuales 7 fueron por cotrimoxazol12.
No existe aún una causa clara que determine el por qué algunos pacientes presenten esta enfermedad, aunque se han sugerido factores genéticos, ambientales e inmunológicos; sin embargo, se ha considerado que las lesiones son generadas por un proceso de hipersensibilidad retardada o tipo IV, depositándose la IgG en los queratinocitos, activando a posterior una variable del antígeno leucocitario humano, lo que se manifiesta con un desorden en los queratinocitos con una subsecuente inflamación a nivel dérmico. Posteriormente, los linfocitos TCD8, reconocen al complejo mayor de histocompatibilidad tipo I, lo que genera las lesiones a nivel dérmico5,7,13.
El SSJ/NET tiene un inicio inespecífico, aparece en las lesiones dérmicas en cuestión de días, nueve en promedio según un estudio realizado en Puerto Rico, cuando el fármaco desencadenante era el TMP/SMX2-3,7,12. En este caso, la aparición temprana de la clínica y los signos típicos de esta enfermedad, obligan a pensar que las manifestaciones pueden iniciarse más rápidamente de lo que se cree. Nuestro escenario es bastante coincidente con el caso reportado por Rijal, donde un paciente femenino de 62 años, quien también consumió cotrimoxazol, presentó una acelerada progresión de la enfermedad en cuestión de horas14.
Entre los factores de mal pronóstico se describen a la edad avanzada, infección activa, comorbilidades, septicemia, trastornos hematológicos malignos y falla renal. Nuestra paciente, pese a presentar varios de estos factores, evolucionó de una manera favorable tanto para la vida como para la función. Dicho esto, debe destacarse que pese a no sospechar de manera inicial el SSJ/NET, se realizó una suspensión temprana del fármaco desencadenante, además de un adecuado manejo de las comorbilidades2,6-7.
El abordaje primario del SSJ/NET debe incluir soporte vital básico, apoyo nutricional y manejo de las infecciones y comorbilidades, lo cual, justifica el manejo antibiótico durante esta experiencia, así como el manejo tópico de las lesiones15.
El uso de corticoesteroides ha sido controversial, aunque uno de los esquemas recomendados a nivel internacional consiste en bolos de dexametasona, corticoesteroide de alta potencia, a razón de 100 mg durante 3 días. Hasta la década de 1990, esta clase de fármacos eran la primera opción para el abordaje terapéutico de estos pacientes; sin embargo, actualmente existen estudios que demuestran que su empleo no reduce la mortalidad, y por el contrario aumenta el riesgo de otras comorbilidades2. En nuestro caso, utilizamos esteroides de baja potencia, como la metilprednosilona, el succinato de metilprednisolona y la prednisona, con la intención de disminuir la respuesta inmune, sin arriesgar a nuestro paciente a los efectos adversos de esta clase de fármacos. El empleo de inmunoglobulinas sigue bajo estudio, y si estas deben utilizarse de manera sola o en combinación con esteroides. Otros fármacos que han reportado cierto beneficio en el tratamiento de esta patología es la ciclofosfamida, la ciclosporina y los antagonistas del factor de necrosis tumoral alfa (anti-TNF-a)2,7.
CONCLUSIONES
El SSJ/NET es una farmacodermia, rara por su frecuencia y con una alta mortalidad, el cotrimoxazol es uno de los principales medicamentos implicados en su aparición. Es una emergencia médica que requiere una pronta atención debido al compromiso sistémico que genera. Una correcta anamnesis acompañada de una adecuada exploración física nos permitirá identificar esta patología y cuál sería su detonante. El tratamiento debe estar orientado a la suspensión del fármaco causal y el manejo de las comorbilidades, como infecciones y enfermedades crónico-degenerativas. Hasta no existir evidencia contundente, recomendamos el uso de corticoesteroides, adaptando el manejo a la realidad clínica de la unidad en que se presente.











 nueva página del texto (beta)
nueva página del texto (beta)