INTRODUCCIÓN
El síndrome del ligamento arcuato medio (SLAM) o síndrome de Dunbar se considera una variable de la isquemia intestinal crónica de tipo oclusivo que comprende un conjunto de signos y síntomas asociados a la compresión extrínseca del tronco celiaco por el ligamento arcuato medio (LAM)13.
El ligamento arcuato medio es un arco fibroso que conecta los pilares diafragmáticos a nivel del hiato aórtico (T12-L1), usualmente atraviesa ventral a la aorta y craneal al tronco celiaco35, sin embargo, la relación precisa entre el tronco celíaco y el ligamento arcuato medio varía en cada paciente3.
La primera descripción anatómica se realizó en 1917 por Lipshultz, quien reportó la compresión de la arteria celiaca por la crura46. En 1963 Harjola presentó la resolución clínica posterior a la descompresión quirúrgica y en 1965 Dunbar publicó la primera serie de casos sometidos a manejo quirúrgico26. Actualmente la Sociedad Europea de Cirugía reconoce al SLAM como la causa más común de estenosis arterial de vaso único1.
CASO CLÍNICO
Mujer de 63 años de edad con trastorno de ansiedad como único antecedente patológico, que ingresó al servicio de urgencias por cuadro respiratorio compatible con neumonía de focos multisegmentaria. Continuó con manejo antibiótico y vigilancia en hospitalización.
Destacó en el interrogatorio, aunado a la tos y ataque al estado general, saciedad temprana, tolerancia del 80% de la dieta habitual, náusea y dolor abdominal inespecífico generalizado de manera intermitente durante los últimos 2 años.
Durante su estancia presentó un nuevo cuadro de dolor abdominal transfictivo, localizado en el epigastrio y el cuadrante superior derecho, de intensidad creciente hasta ser 10/10 en la escala visual análoga del dolor, acompañado de náusea sin llegar al vómito, sin identificar algún evento desencadenante o agravante. A la exploración física destacó la hipersensibilidad en el epigastrio a la palpación y signo de Murphy positivo, sin alteraciones en la perístasis ni a la percusión.
Se le realizó tomografía simple de abdomen con cortes a 2 mm en la que se observó un hematoma en el espacio prevascular que medía 4.7 x 12 x 15 mm (figura 1b), con un volumen aproximado de 442 ml, por lo que se procedió a realizar una angiotomografía dinámica con la administración de 80 ml de medio de contraste yodado, no-iónico, intravenoso, con un caudal de 5 ml/s y se realizaron reconstrucciones a 1 mm. En este estudio se logró observar fuga del medio de contraste adyacente a la arcada pancreatoduodenal, además de engrosamiento de la mucosa de las 2º y 3º porciones del duodeno (figura 1b). El tronco celíaco tenía una estenosis del 100% en su origen con la aorta, secundario al descenso del ligamento arcuato medio (figuras 2 y 3); el llenado del tronco celíaco se obtuvo por vía retrógrada de la arcada pancreatoduodenal que depende de la arteria mesentérica superior. Además, se identificó una dilatación aneurismática en la arteria pancreatoduodenal posteroinferior (figuras 1a y 4).

Imagen: De la Concha et al.
AMS: arteria mesenterica superior; APDA: arcada pancreatoduodenal anterior.
Figura 1 a) Angiotomografia computada en maxima intensidad de proyeccion con presencia de aneurisma fusiforme de la arteria pancreatoduodenal posteroinferior (flecha). b) Tomografia computada en fase venosa con coleccion (+) en el espacio prevascular del retroperitoneo, ademas se observa la 3. porcion del duodeno (D) con engrosamiento de la mucosa.

Imagen: De la Concha et al.
Flecha gruesa: arteria esplénica; flecha delgada: arteria hepática común.
Figura 2 Angiotomografía computada axial en máxima intensidad de proyección en fase arterial con obstrucción (*) en el origen del tronco celíaco (cabeza de flecha) secundario al ligamento arcuato medio (+).
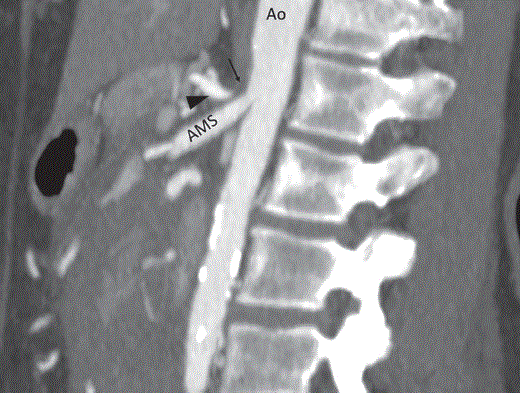
Imagen: De la Concha et al.
AMS: arteria mesenterica superior; Ao: aorta.
Figura 3 Angiotomografía en plano sagital con ausencia de llenado del origen del tronco celíaco (flecha) y morfología en gancho del mismo (cabeza de flecha).AMS: arteria mesentérica superior; Ao: aorta.
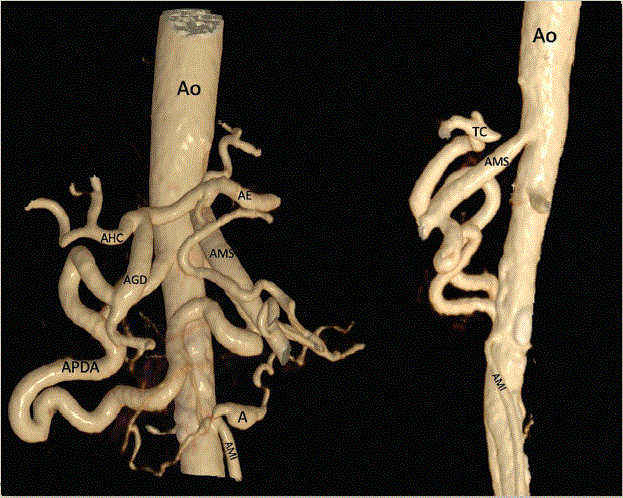
Imagen: De la Concha et al.
A: aneurisma; AE: arteria esplénica; AGD: arteria gastroduodenal; AHC: arteria hepática común; AMI: arteria mesentérica inferior; AMS: arteria mesentérica superior; Ao: aorta; APDA: arcada pancreatoduodenal anterior.
Figura 4 Rendering cinemático en vista anteroposterior (A) y lateral (B), donde se aprecia la vasculatura principal del tronco celiaco y arteria mesentérica superior.
Ninguno de los hallazgos por imagen ni por evolución clínica ameritaron exploración quirúrgica durante la estancia intrahospitalaria, por lo que continuó bajo manejo específico del proceso neumónico, así como vigilancia estrecha del dolor abdominal. Presentó mejoría progresiva hasta su egreso a los 18 días.
DISCUSIÓN
Epidemiología y factores de riesgo
La prevalencia del SLAM se desconoce; aproximadamente en 10 a 24% de la población el ligamento arcuato medio cruza atípicamente la aorta en un nivel más inferior4, se estima que 13.5% de la población general presenta evidencia radiológica de compresión del tronco celíaco5 y 10% presenta compresión intermitente del plexo celíaco durante la respiración6.
Con base en diferentes estudios se estima que la compresión del tronco celíaco cursa de manera asintomática entre el 2 a 8.2% de la población y que pacientes con compresión mayor al 50% del tronco pueden cursar asintomáticos hasta en el 7% de los casos7.
Se conoce que es más común en mujeres de constitución delgada (4:1) siendo la edad media de presentación entre los 30 a 50 años2.
Etiología y fisiopatología
Las variantes anatómicas entre la inserción del tronco celíaco y el origen del LAM a lo largo de la aorta abdominal tienen como consecuencia la compresión de estructuras neurovasculares. Se han postulado varias hipótesis para explicar los síntomas asociados a la compresión extrínseca, las propuestas son las isquémicas y neuronales1.
La compresión es dinámica y varía la respiración, durante la inspiración el LAM se desplaza hacia ventral y el tronco celíaco hacia caudal, comprimiendo y descomprimiendo de esta manera el tronco celíaco1,2. Entre más agudo sea el origen del tronco mayor será la oclusión3.
El componente vascular resulta de la compresión externa y el incremento en la demanda de oxígeno. La disminución en el volumen y el aumento en la velocidad del flujo del tronco celíaco resulta en hiperplasia de la capa muscular que perpetúa la estenosis2,4,5.
Otros cambios asociados es la formación de circulación colateral que evita el desarrollo isquemia intestinal68. La formación de aneurismas en hasta el 2% de los casos conlleva el riesgo de ruptura espontánea hacia el retroperitoneo2. La ruptura se ha reportado en 45% de los aneurismas de la arteria pancreaticoduodenal8.
El componente neuropático se explica por la compresión y sobreestimulación crónica de los ganglios celíacos proximales2,4,5,9 resultando en alteraciones sensoriales de los nervios del plexo celíaco6.
Clínica
De manera característica se presentan síntomas como dolor abdominal postprandial de predominio en epigastrio, náusea, vómito, pérdida de peso no intencional (mayor a 5%) y diarrea1,6,9,10. En la exploración física pueden encontrarse soplos abdominales que se exacerban con la espiración, sensibilidad en epigastrio y perístasis aumentada1,9,11.
Los síntomas son más comunes en pacientes jóvenes con antecedente de cirugía y en fumadores9. No existe correlación entre el grado de estenosis y los síntomas2,3,9.
Diagnóstico
No existen criterios diagnósticos aceptados universalmente para el SLAM, por lo que se considera un diagnóstico de exclusión, los datos clínicos característicos deberán verse justificados por el hallazgo cardinal de compresión celíaca en los estudios de imagen1,11.
La angiografía con maniobras respiratorias se considera el estándar de oro11 ya que permite el estudio de las dimensiones, colateralización de los sitios más frecuentes (arcada pancreaticoduodenal y arteria pancreática posterior)2,4 y detección de aneurismas sincrónicos7.
El ultrasonido doppler se recomienda como el estudio de primera elección, este permite identificar el calibre y las velocidades de flujo del tronco celíaco. Se clasifica con base al calibre en: leve menor del 50%, moderada entre 50-80% y severa mayor al 80%2,11.
La tomografía computarizada detalla el tronco celíaco y su apariencia en “gancho” (figuras 3 y 4b) permite descartar diagnósticos diferenciales2. Dentro de los diagnósticos diferenciales más comunes de enfermedad isquémica intestinal se mencionan la aterosclerosis (la más frecuente), vasculitis y trombosis venosa sistémica9.
La delimitación anatómica por imagen permite la caracterización y gradación de la compresión, lo que orienta el tipo de abordaje y manejo quirúrgico12. A pesar de esto, carecen de utilidad para predecir la respuesta posterior a la liberación quirúrgica del ligamento11.
Tratamiento
El manejo quirúrgico tradicional consiste en la descompresión del tronco celíaco acompañado de ganglionectomia extensa2. Es necesario seccionar el ligamento, realizar neurolisis y excisión de plexo celíaco12. Se define como éxito técnico a la visualización libre del origen y de los 180° de la cara anterior de la arteria celíaca, así como mejoría en la velocidad de flujo6,11.
La selección de pacientes que se verán beneficiados del tratamiento sigue siendo un reto en la actualidad2, el éxito es variable y la recurrencia es común. Posterior a la liberación 50-80% resuelven los síntomas, 36-50% presentan recurrencia y 12.2- 30% dolor persistente3,9,10,11.
Puede realizarse de forma abierta, laparoscópica o asistida por robot, no se han encontrado diferencias entre la técnica y los resultados2,4,9,13. Se prefiere la cirugía abierta cuando se planea reconstrucción vascular2,13. La decisión de reconstrucción vascular depende del estado intraoperatorio del tronco celíaco posterior a la liberación del ligamento4.
La intervención endovascular mediante angioplastia translaminar percutánea ha demostrado ser útil como terapia adyuvante en pacientes con síntomas residuales o estenosis postquirúrgicas. Como monoterapia demuestra pobres resultados4,12. La embolización arterial transcatéter se considera como el manejo de primera línea en la ruptura de aneurismas8.
Nuevas terapéuticas
Entender la contribución que ejerce el plexo celiaco a los síntomas del SLAM ha contribuido al desarrollo de nuevas terapias. El bloqueo percutáneo del plexo celíaco con anestésico local reduce los síntomas transitoriamente por lo que una respuesta positiva tal vez pueda predecir el éxito de la descompresión quirúrgica y ganglionectomia celíaca, sin embargo, la calidad de la evidencia es deficiente5,6.
CONCLUSIONES
El SLAM es una entidad poco frecuente, la prevalencia en la población asintomática ha llevado a debatir sobre si es un fenómeno fisiológico o un proceso patológico.
Aunque se conocen los cambios anatómicos responsables de la lesión, aún no se comprende cuáles son los factores que determinan la presentación clínica.
Debido a la respuesta variable al tratamiento, actualmente se debaten cuales hallazgos se correlacionan con la mejoría de los síntomas.











 nueva página del texto (beta)
nueva página del texto (beta)


