INTRODUCCIÓN
El olfato y el gusto son sistemas complejos y fascinantes. Pocas personas reconocen la utilidad de poder percibir el amplio espectro de aromas y sabores que nos rodean día a día. Más allá de su papel en la alimentación, estos sentidos son formas de interacción con nuestro ambiente y con otros individuos, son fuentes de placer y hasta mecanismos de protección. Es difícil ser consciente de cuántas veces en la vida hemos librado un peligro inminente tan sólo por haber reconocido el aroma del humo y el gas, o el sabor amargo de un alimento en mal estado. Por sus conexiones con el sistema límbico, permiten evocar emociones intensas y recuerdos precisos que parecían ya olvidados por los otros sentidos.
Los trastornos del olfato y el gusto son mucho más prevalentes de lo que se piensa. Por la estrecha relación que guardan estos sistemas entre sí, no es infrecuente encontrar la alteración de ambos en el mismo individuo. La correcta evaluación de la función olfatoria y gustativa, no solo permite intervenir de forma dirigida en la rehabilitación de estos sentidos, sino que puede orientar al clínico sobre banderas rojas en otras patologías, como la diabetes mellitus (DM), enfermedad de Parkinson (EP), enfermedad de Alzheimer (EA), lesión renal crónica, entre muchas otras.
El propósito de este artículo es demostrar la complejidad del sistema del olfato y el gusto, los distintos trastornos, su evaluación y tratamiento. Para fines prácticos, se abordarán por separado; sin embargo, no se debe olvidar que la evaluación de ambos sentidos va siempre de la mano. Un abordaje sistemático de estas patologías será la clave del diagnóstico.
TRASTORNOS DEL OLFATO
Anatomía y fisiología
En la cavidad nasal podemos encontrar 4 tipos de epitelio:
Epitelio respiratorio, el cual es un epitelio cilíndrico pseudoestratificado y que recubre la mayor parte de la cavidad nasal.
Epitelio estratificado queratinizado. Cubre el área vestibular donde se encuentran las vibrisas.
Epitelio de transición. Se encuentra entre el epitelio escamoso y respiratorio.
Epitelio olfatorio, también denominado neuroepitelio. Es un epitelio especializado para detectar los distintos aromas. Se encuentra localizado en el techo nasal, adyacente a la lámina cribosa, la cual atraviesa. En menor extensión puede encontrarse en el cornete superior y medio, así como una pequeña porción del septum cercana al cornete superior.
El sistema olfatorio se divide en periférico y central:
El sistema periférico se compone del epitelio olfatorio y los fascículos nerviosos. El neuroepitelio está formado por más de 6 millones de células receptoras olfatorias bipolares. Las dendritas de estas células se encuentran en la capa mucosa donde captan a las moléculas para ser estimuladas. Existen también las células glandulares de Bowman, productoras de moco, y las células basales. Estas últimas son precursoras de nuevas células olfatorias, recambiando al epitelio cada 30-60 días.
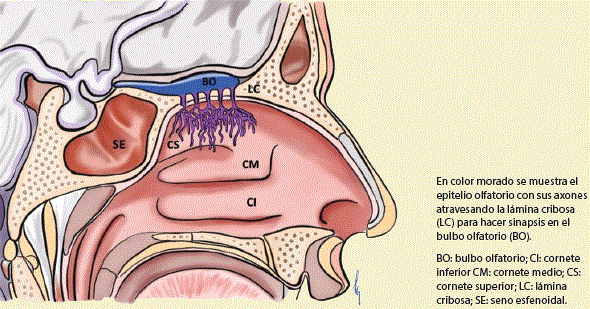
El sistema central comprende al bulbo olfatorio (BO) y sus conexiones con el sistema nervioso central. El BO representa la primera parte del sistema olfatorio dentro del sistema nervioso. Se encuentra dentro de unas pequeñas depresiones de la fosa craneal anterior, las fosas olfatorias. El piso de cada fosa olfatoria es la lámina cribiforme del etmoides, la cual presenta numerosos forámenes a través de los cuales pasan los filetes olfatorios (figura 1). El tejido del BO consta de 6 capas: I) Fascículos nerviosos olfatorios. II) Glomerular. III) Plexiforme externa. IV) De células mitrales. V) Plexiforme interna. VI) Granular1,2.
En los humanos existen más de 350 proteínas receptoras que se expresan en los cilios de las células receptoras. Cada célula expresa un solo tipo de receptor. Estos receptores pertenecen a la familia de las proteínas G. Cada aroma activa un conjunto de receptores con base en su composición química, lo cual crea un patrón único de excitación en el bulbo olfatorio por cada aroma2.
La unión de una partícula de aroma a su receptor olfatorio ocasiona la despolarización de la neurona. Sus axones se proyectan a través de la lámina cribiforme hacia el bulbo olfatorio ipsilateral para después pasar a la corteza olfatoria, la cual se divide en primaria y secundaria. La corteza primaria se compone de la corteza piriforme, el núcleo olfatorio anterior, el tubérculo olfatorio, la amígdala y la corteza entorrinal. La secundaria está formada por el hipocampo, el tálamo, la corteza orbitofrontal y el cerebelo2,3.
Epidemiología
Se estima que alrededor del 15-20% de los adultos de más de 40 años, presentan algún trastorno del olfato. Esta prevalencia incrementa de forma consistente con cada década adicional de edad hasta alcanzar un 39-62% para sujetos de 80 años o más4-6. Estas cifras pueden estar infraestimadas ya que muchos estudios se basan en la autopercepción de un problema olfatorio por el paciente, sin pruebas objetivas que lo midan y corroboren. Una gran cantidad de pacientes no perciben su disfunción olfatoria hasta que esta se encuentra ya muy avanzada y ha deteriorado significativamente su calidad de vida. En una muestra representativa de adultos mayores en Estados Unidos (NSHAP), 74.2% de los pacientes con pruebas olfatorias alteradas, no era consciente de su disfunción7. Es debatido si afectan más al género masculino8,9. Podría existir una influencia étnica por la mayor incidencia en afroamericanos10. El tabaquismo y alcoholismo también parecen incrementar la prevalencia de estos trastornos11,12.
Clasificación
Los trastornos del olfato se clasifican en problemas cuantitativos y cualitativos (figura 2). Los problemas cuantitativos, donde se afecta la intensidad, mas no la calidad de los aromas, van desde una función normal (normosmia), disminuida (hiposmia) y hasta nula (anosmia) para detectar y nombrar correctamente los olores. Los trastornos cualitativos, denominados disosmia, se refieren a una percepción olfatoria alterada. Pueden presentarse como una distorsión en la calidad del aroma (parosmia, eje., oler papel quemado en lugar de talco para bebé) o la percepción de un aroma sin una fuente verdadera (alucinaciones olfatorias o fantosmia)13.
Impacto en la calidad de vida y en la mortalidad
Los trastornos del olfato tienen un impacto importante en la calidad de vida de los pacientes. Los pacientes con anosmia presentan mayores problemas de autoestima y síntomas depresivos. Son comunes las dificultades en áreas como la ingesta y preparación de alimentos, seguridad, higiene personal y vida sexual. Por el impacto que los trastornos del olfato tienen en el gusto, los pacientes intentan aumentar el sabor de los alimentos agregando más sal, endulzantes o especias. Suelen dar mayor relevancia a las texturas de los alimentos.
Hasta un 60% de estos pacientes refieren dificultad para percatarse de una fuga de gas o el humo14. Además del riesgo que representa, contribuye al sentido de vulnerabilidad. Los pacientes se ven obligados a buscar mecanismos para compensar su trastorno, como al comprar detectores de gas y humo o vivir con otras personas.
Casi la mitad de los pacientes con un trastorno del olfato refiere una sensación de aislamiento, insatisfacción con la vida, ansiedad y vulnerabilidad15. Los pacientes pueden experimentar depresión, tanto por la limitación de sus actividades cotidianas, como por una disminución en las aferencias al sistema límbico16, lo cual puede derivar en una desregulación en el estado emocional de los pacientes. Se ha encontrado que grupos de pacientes con normosmia, hiposmia y anosmia, difieren significativamente en puntaje del Inventario de Depresión de Beck (5.21 ± 4.73 vs 10.93 ± 9.25 vs. 14.15 ± 5.39,p ≤ 0.0274 para las 3 comparaciones)17.
Debido a que el neuroepitelio se encuentra en constante recambio, se propone a la disminución de la función olfatoria, hallazgo frecuente en adultos mayores, como un signo directo de envejecimiento neuronal. La afección del olfato es un predictor importante de mortalidad en el adulto mayor. El National Social Life, Health and Aging Project (NHSAP), encontró que los adultos mayores con anosmia, presentaban una probabilidad de fallecer a 5 años 3 veces mayor que los individuos con olfacción normal (OR, 3.37 [95% IC 2.04, 5.57]). Este riesgo fue mayor que para otras variables como la insuficiencia cardiaca, diabetes, EPOC y cáncer18.
Causas
Algunas causas comunes de trastornos del olfato son las siguientes:
Causas nasosinusales. Entre ellas se encuentran las deflexiones septales, hipertrofia de cornetes, concha bulosa, pólipos nasales y con menor frecuencia otras neoplasias benignas y malignas de nariz y senos paranasales, dentro de los cuales destaca el estesioneuroblastoma, cuyo origen es el neuroepitelio olfatorio. La rinosinusitis es la principal causa de hiposmia secundaria a enfermedad nasosinusal. Suele acompañarse de otros síntomas como la plenitud facial, obstrucción nasal, rinorrea, descarga posterior purulenta, dolor dental y malestar genera19,20. La rinitis alérgica es otra causa frecuente de hiposmia, por el edema de la mucosa nasal. Se caracteriza por presentar obstrucción nasal intermitente, prurito nasal y/o ocular, rinorrea hialina y estornudos en salva.
Disfunción olfatoria postinfecciosa. Las infecciones virales del tracto respiratorio superior, son una causa frecuente de afección olfatoria. Se han relacionado con la infección por virus como parainfluenza, influenza, coronavirus, rinovirus, entre otros. Suelen iniciar inmediatamente después de un episodio infeccioso inusualmente severo, aunque pueden desarrollarse hasta 6 meses después21. No es infrecuente que este evento pase desapercibido. Por lo general, tienen un mejor pronóstico para recuperación espontánea que en otras etiologías22.
Hiposmia relacionada con la edad. Alrededor de la mitad de los adultos mayores de 80 años, presentan algún grado de hiposmia. En un análisis de 320 autopsias consecutivas de un hospital geriátrico general (media de edad, 81.5 + -8.5 años), se encontraron depósitos de alfasinucleína, componente de los cuerpos de Lewy en el bulbo olfatorio del 31.9% de los pacientes23.
Postraumática. Se reportan en aproximadamente el 7% de todos los traumatismos cráneo encefálicos24. Son 5 veces más frecuentes en impactos occipitales y laterales, posiblemente por la protección que ofrecen los senos frontales. Por lo general, se considera que tienen un mal pronóstico para la recuperación espontánea, con tan solo un aproximado del 36% de los pacientes que refieren alguna mejoría posterior al traumatismo, la cual suele darse entre los 6 a 9 meses posterior a la lesión25,26. Las pérdidas inmediatas se asocian a peor pronóstico de respuesta al tratamiento que aquellas que se producen de manera paulatina27.
-
Secundaria a medicamentos. Diversos medicamentos se han relacionado a la disminución del olfato, algunos de ellos se enlistan en la tabla 1 28. También se atribuye a la exposición a ciertas toxinas como pesticidas, disulfuro de carbono, formaldehido y ácido sulfúrico29.
Tabla 1. Medicamentos asociados con alteraciones del gusto
Clase Agentes Antibióticos Doxiciclina, penicilina, estreptomicina, tetraciclina Antihistamínicos Clorfeniramina Bloqueadores de canales de calcio Amlodipino, diltiazem, nifedipino Anticolesterolémicos Colestiramina, Clofibrato, Estatinas (p. ej., atorvastatina, pravastatina) Opioides Codeina, morfina Quimioterapéuticos Metotrexate Antidepresivos Amitriptilina Tabaquismo y alcoholismo crónico. Los trastornos del olfato están bien documentados en el síndrome amnésico inducido por alcohol (Korsakoff); sin embargo, se ha observado que más del 50% de los pacientes alcohólicos sin amnesia/demencia, tienen peores resultados en las pruebas de olfato que pacientes no alcohólicos, y que estos son proporcionales a la duración de la ingesta30. El tabaquismo activo incrementa de forma general el riesgo de presentar un trastorno olfatorio (OR 1.71, 95 % IC 1.19-2.47), especialmente en aquellos individuos que fuman más de 20 cigarrillos diarios31.
Enfermedades neurodegenerativas. Se ha reportado que pacientes con diversas sinucleinopatías y taupatías como la EP, EA, enfermedad por cuerpos de Lewy, entre otras, presentan una afección temprana de la función olfatoria. En la EA, la severidad de la hiposmia se relaciona con la progresión de la demencia32. Se ha reportado una prevalencia de trastornos olfatorios de hasta el 90% en las formas tempranas de la EP33. Se debe al depósito de alfa-sinucleína en las estructuras olfatorias, lo cual ocurre antes que en la sustancia nigra34,35. La disfunción olfatoria en EP precede a los síntomas motores por al menos 4 años y puede ser utilizada para el tamizaje de pacientes asintomáticos36.
Padecimientos médicos crónicos. Algunos padecimientos sistémicos que pueden afectar el olfato son: diabetes mellitus, hipotiroidismo, enfermedad renal crónica y deficiencia de vitamina B12 y folatos. En la diabetes mellitus, se considera que la hiposmia es una forma de neuropatía. Tanto en la enfermedad renal crónica como en la falla hepática, la hiposmia puede ser producto de los medicamentos y cambios metabólicos que ocurren en ambas enfermedades37.
Genéticas. Existen anosmias específicas, secundarias a unas variantes genéticas, como en la incapacidad para detectar el aroma de la androstenona, la cual se estima que afecta del 2 al 45% de la población mundial y que puede ser explicada en algunos individuos por el genotipo OR7D438-40.
Interrogatorio
Se debe realizar una historia clínica detallada. Es importante interrogar sobre el antecedente de alguna infección de la vía aérea superior en los últimos 6 meses que pudiera explicar la disfunción olfatoria. Si existe un antecedente traumático, se deberá indagar sobre el mecanismo, la velocidad y dirección del impacto, así como el tiempo de instauración.
La obstrucción de ambas fosas nasales de forma intermitente, especialmente si se acompaña de estornudos en salva o prurito nasal u ocular, nos orienta a una etiología alérgica. Obstrucciones unilaterales, constantes, sugieren una obstrucción anatómica. La presencia de descarga nasal purulenta, anterior y posterior, plenitud facial, halitosis y disosmias son indicativas de rinosinusitis41,42.
La disfunción olfatoria en pacientes con diabetes mellitus u otras enfermedades crónicas como la lesión renal, puede ser indicativa de un mal control de la enfermedad y obliga al clínico a interrogar sobre otros datos de neuropatía, periférica y central43. En el contexto de enfermedades neurodegenerativas, se deben interrogar otros síntomas premotores y motores44.
Exploración física
Todo paciente con un trastorno del olfato requiere la realización de una endoscopía nasal. En manos experimentadas, la rinoscopía anterior permite identificar varias de las etiologías. Si se descarta una etiología nasal, se recomienda realizar un cuestionario de función cognitiva como el minimental test o “MoCA” (Montreal Cognitive Assessment). El Questionnaire of Olfactory Disorders-Negative Statements (QOD NS), mediante distintas declaraciones y escalas visuales análogas permite medir el impacto que tienen estos trastornos en la calidad de vida del paciente según la afección en las relaciones interpersonales, el trabajo, su seguridad y el tiempo libre45,46.
Pruebas diagnósticas
Se cuenta con diferentes pruebas para detectar las alteraciones olfatorias. Existen las pruebas de identificación, donde el paciente debe nombrar el aroma que se le presenta de entre 4 opciones que se le muestran, donde 3 de ellas son distractores. Las pruebas de discriminación se basan en la capacidad del sujeto para identificar 2 aromas como diferentes. Por último, las pruebas de umbrales de percepción permiten además detectar la concentración mínima en la cual el sujeto puede percibir el aroma. Algunas pueden realizarse con aceites esenciales comerciales, con el inconveniente de no contar con estandarización.
Algunas de las pruebas más utilizadas alrededor del mundo son el University of Pennsylvania Smell Identification Test (UPSIT) y los Sniffin´ Sticks. El UPSIT es una prueba olfatoria del tipo “rasca y huele” validado para detectar hiposmia y diferentes grados de afección según edad y sexo. Ha sido modificada para varios países tomando en cuenta los aromas más comunes para las diferentes poblaciones. Los Sniffin´ Sticks son plumas europeas con aromas encapsulados que despiden aromas a concentraciones estándar. Su uso permite medir el umbral, identificación y discriminación de los aromas47,48.
Estudios de imagen
No están indicados de primera instancia en todos los pacientes con alteraciones del olfato. Pueden servir de complemento en el abordaje de ciertos padecimientos o en aquellos casos en los que no hay una causa identificada. La tomografía de nariz y senos paranasales es útil para etiologías obstructivas, como deflexiones septales y neoplasias. Es útil en los casos de rinosinusitis y cuando se requiere valorar la integridad de la fosa craneal anterior, como en el caso de un traumatismo craneoencefálico, neoplasias o en sospecha de lesiones iatrogénicas durante cirugía endoscópica.
La resonancia magnética es de mayor utilidad en los casos de enfermedades neurodegenerativas como en la EA, donde se observan datos de atrofia cerebral y acentuación de los surcos y cisuras. También es útil para descartar otras causas de parkinsonismo. En la infección por SARS-CoV-2, se ha descrito la atrofia del bulbo olfatorio, cuya altura puede ser medida por medio de resonancia magnética. Este hallazgo puede ser un dato de mal pronóstico para la recuperación espontánea49.
Tratamiento
El tratamiento dependerá de la etiología. Las causas obstructivas suelen requerir tratamiento quirúrgico. Los padecimientos alérgicos suelen responder bien a esteroides tópicos nasales y antihistamínicos. La terapia con mayor evidencia para la mejoría de los trastornos del olfato es la rehabilitación olfatoria, seguida por el tratamiento mediante corticoesteroides.
Rehabilitación olfatoria. Consiste en la reeducación del olfato para crear nuevas redes neuronales. Se basa en el empleo de 4 grupos de aromas principales: frutal, floral, aromático y resinoso, para los cuales se pueden utilizar distintas fragancias (rosa, clavo, limón y eucalipto, pimienta, menta, café, lavanda, vainilla, lila y jengibre entre otras.)
Se debe realizar de forma diaria, por lo menos 2 o 3 veces al día, por un periodo mínimo de 3 meses. Se inhala cada aroma de manera lenta y profunda a través de ambas fosas nasales. Repetir para cada uno de los aromas, descansando entre 10 y 15 segundos entre cada uno. Se recomienda tratar de enfocar la memoria del sujeto en cada aroma y relacionarlo con algún recuerdo para mejorar la creación de redes neuronales50.
Esteroides. Los corticoesteroides sistémicos, junto a la suplementación con gluconato de zinc, se han utilizado en etiologías postraumáticas, con resultados controversiales51,52. Los esteroides tópicos empleados de manera conjunta con el entrenamiento olfatorio han mejorado las puntuaciones de umbral de manera más eficaz que el empleo único de la rehabilitación. Estos resultados se observan sobre todo a los 8 meses de realizar la terapia53.
Otras terapias. Se han utilizado otras modalidades de tratamiento, sin evidencia contundente que las avale. Entre ellas se encuentran: ácido alfa lipoico, teofilina, vitamina A, insulina, omega 354-58.
TRASTORNOS DEL GUSTO
Anatomía y fisiología del gusto
El órgano del gusto consiste de aproximadamente 10 mil papilas gustativas, donde cada una de ellas contará con 100-150 receptores del gusto con una vida media de 10-11 días. La mayor parte de las papilas se encuentran sobre el dorso lingual, encontrándose en menor cantidad sobre la epiglotis, paladar y faringe. Aunque hay diferencias sutiles en la sensibilidad a diferentes saborizantes en las diferentes regiones linguales, el concepto de “mapa lingual” ha sido desacreditado en los últimos años59. Existen 5 tipos celulares morfológicamente diferentes dentro de cada papila (figura 3):

Imagen: Valdelamar Dehesa
Células tipo I (oscuras); células tipo II (claras); células tipo III (intermedias); células tipo IV (precursoras), células tipo V (soporte)
Figura 3 Tipos de células receptoras en las papilas gustativas
Células tipo I (también llamadas oscuras; censan el sabor salado y se activan mediante canales de sodio).
Células tipo II (células claras; detectan los sabores dulce, amargo y umami; actúan mediante proteínas G).
Células tipo III (células intermedias; detectan el sabor salado mediante el paso de iones de hidrógeno a través de canales proteicos especializados).
Células tipo IV (son células basales o precursoras).
Células tipo V (células marginales de soporte)59.
Las modalidades gustativas generalmente se dividen en 5 gustos básicos establecidos de acuerdo con el tipo de receptor más activado: dulce, ácido, salado, amargo y umami. Esta última cualidad se relaciona con un sabor deseable asociado con el interés o el placer. Últimamente se ha sugerido un sabor compuesto de ácidos grasos libres como el 6º sabor60.
La señalización gustativa se transmite en su mayoría por uno de los 3 nervios craneales encargados del gusto: 1) Nervio facial, mediante su rama cuerda del tímpano. Inerva los 2 tercios anteriores de la lengua. 2) Nervio glosofaríngeo. Inerva el tercio posterior de la lengua. 3) Vago, mediante su rama laríngeo superior. Inerva la mucosa de faringe, laringe y tracto digestivo superior (figura 4). Los axones de estos nervios se trasladan hacia el núcleo del tracto solitario, viajando a la porción ventral posterior del tálamo a través del lemnisco medial. Posteriormente, viajan hacia la amígdala, corteza insular anterior y corteza orbitofrontal, teniendo como resultado la sensación del sabor61.

Imagen: Valdelamar Dehesa
En azul se muestra la contribución por el nervio facial mediante su rama cuerda del tímpano. Inerva los dos tercios anteriores de la lengua. En verde se muestra el glosofaríngeo. Inerva el tercio posterior de la lengua. En morado se muestra el nervio laríngeo superior, rama del nervio vago. Inerva la mucosa de la faringe, laringe y tracto digestivo superior.
Figura 4 Inervación lingual
La saliva tiene un papel fundamental en la percepción de los sabores. Se compone de un 99% de agua y un 1% de sólidos disueltos que pueden ser componentes orgánicos, inorgánicos y proteínas salivales62. Entre muchas otras, tiene funciones inmunológicas, mantiene la integridad dental y lubrica la mucosa bucal (actuando como solvente para los saborizantes).
Epidemiología
Se desconoce la prevalencia real de los desórdenes del gusto ya que con frecuencia no son reportados por otras áreas de la salud. En la Encuesta Nacional de Examen de Salud y Nutrición (NHANES) 2011-2012 realizada a 142 millones de habitantes en USA, se reportó un 5% de alteraciones en el gusto.
No suele haber predominancia por género, aunque las mujeres suelen buscar tratamiento de manera más temprana63.
Clasificación
Las disfunciones gustativas se clasifican en cuantitativas y cualitativas (figura 5). Las primeras incluyen la ageusia (ausencia de percepción), la hipogeusia (percepción disminuida) y la hipergeusia (percepción aumentada). Los problemas cualitativos se dividen en disgeusia/parageusia (percepción des- agradable) y pantogeusia (percepción en ausencia de saborizante).
Etiología
Menos del 10% de los pacientes con disfunción gustativa tendrán un desorden primario. Hasta el 95% de los pacientes tendrán una alteración en el olfato de forma concomitante64. Las principales causas de trastornos del gusto son:
-
Fármacos: existen más de 200 fármacos relacionados a alteraciones gustativas (tabla 2). Diversos antidepresivos, por su efecto anticolinérgico, inhiben la producción y secreción de la saliva. Los antihipertensivos son un grupo de fármacos frecuentemente asociados a esta condición, ya que inhiben la acción del zinc en las glándulas salivales. Este mineral es necesario para la acción salival, digestión de la comida y para la función normal de los receptores gustativos65,66.
Tabla 2 Medicamentos asociados con alteraciones del gusto
Clase Agente Clase Agente Antidepresivos Amitriptilina, paroxetina Diuréticos Furosemida, hidroclorotiazida IECAs Captopril, lisinopril Hipoglucemiantes Fenformina, glipizida Antiepilépticos Topiramato, fenitoína, carbamazepina Bloqueadores de calcio Nifedipino, diltiazem Antiparkinsonianos Levodopa, selegilina AINEa Ibuprofeno Antibióticos Tetraciclina, penicilina Antiarrítmicos Propranolol, amiodarona Tabaquismo: el consumo de tabaco contribuye de forma importante al desarrollo de trastornos del gusto mediante el daño a órganos periféricos. En un estudio realizado por Pavlidis et al., se observó que los pacientes que suspendían el hábito tabáquico por un promedio de 3.2 meses, disminuían sus umbrales de gustometría eléctrica, incrementaban su densidad y vascularidad de las papilas fungiforme, así como su arquitectura bajo endoscopía67.
Radioterapia y quimioterapia: los trastornos del gusto son una complicación temprana de la radioterapia y quimioterapia. A menudo precede a la mucositis, resultando en anorexia, pérdida de peso, desnutrición y una pobre calidad de vida. La radioterapia causa pérdida de las papilas gustativas a través de efectos citotóxicos directos y efectos anti proliferativos del volumen irradiado. Se menciona que hasta el 70% de los pacientes con tratamiento sistémico desarrollan alteración en el gusto. Esta comienza posterior a las 2 semanas del inicio de la radioterapia con dosis mínimas de 30 Gy y con un pico máximo a los 2 meses. Los tratamientos citotóxicos sistémicos dañan las papilas gustativas y sus células receptoras. Algunos ejemplos son: cisplatino, carboplatino, ciclofosfamida, doxorrubicina y 5-fluorouracilo. Varios quimioterapéuticos se eliminan por la saliva, ejerciendo un efecto destructivo directo sobre los receptores del gusto68.
Metabólica. La DM es una patología común en la cual el paciente puede experimentar disgeusia. Estos pacientes tienen umbrales más elevados para los sabores dulce, salado y ácido, razón por la cual necesitan una cantidad incrementada de dichos sabores para poder ser percibidos. Esta puede ser una de las razones por las cuales los pacientes con DM no acatan adecuadamente la dieta que se les indica en consulta69.
Iatrogénica. Durante el tratamiento quirúrgico de neoplasias de cabeza y cuello, se pueden lesionar las vías de transducción del gusto. También se han reportado alteraciones del gusto relacionadas al procedimiento anestésico, principalmente cuando se utilizan mascarillas laríngeas infladas a más de 30 cc. Se considera que la compresión del nervio lingual es la probable etiología de esta alteración70.
Deficiencia de zinc. El zinc (Zn) es un mineral esencial para el correcto funcionamiento de los receptores gustativos. Aunque la terapia con zinc puede ser efectiva en algunos pacientes con disgeusia, la deficiencia de este mineral puede ser difícil de medir. Yanagisawa et al. encontraron que el cociente Zn/Cu es un buen marcador diagnóstico para detectar problemas del gusto, con un punto de corte igual o mayor a 1.171.
Viral. Durante la reciente pandemia causada por el virus SARS-CoV-2, se ha observado una relación entre la enfermedad de COVID-19 y la afección del gusto, con una prevalencia de alrededor de 49.8% (95% IC 8.2, 91%). Se sugiere que el mecanismo por el cual se produce la alteración del gusto es por la habilidad del virus para unirse al receptor de la enzima convertidora de angiotensina II, el cual se expresa en la superficie de la lengua y cavidad oral72. Otros mecanismos en estudio son el daño en la trayectoria neuronal periférica, hipoxia tisular y disminución del zinc73.
Evaluación
Se debe obtener una historia clínica completa. Esta debe incluir la historia dental, ingesta de medicamentos, hábito tabáquico y etílico. Es necesario realizar una exploración física completa de cabeza, cuello y cavidad oral.
En casos de disfunción gustatoria postraumática, la tomografía computada de cráneo permite identificar fracturas del hueso temporal, las cuales pueden comprometer el trayecto del nervio facial previo a la salida de la cuerda del tímpano, con la consecuente disgeusia. Los trazos que involucren el foramen yugular pueden lesionar el nervio glosofaríngeo y vago. La resonancia magnética de cráneo permite visualizar el trayecto del nervio facial, valorar la presencia de edema cerebral, hemorragias, infartos o contusiones puedan condicionar la disgeusia.
La función gustativa puede ser evaluada de forma objetiva (química y electrogustometría) o subjetiva.
Dentro de la evaluación subjetiva, se encuentran diversos cuestionarios. Uno de ellos es la Escala de Agudeza del Gusto Total Subjetiva, la cual califica la gravedad de la alteración en pacientes sometidos a algún tipo de tratamiento (tabla 3)74.
Tabla 3 Grados de alteración gustativa de la Escala de Agudeza del Gusto Total Subjetiva
| Grado | Descripción |
| 0 | Misma agudeza que previa al tratamiento |
| 1 | Pérdida leve en agudeza, pero no inconveniente en la vida diaria |
| 2 | Pérdida moderada y a veces inconveniente en la vida diaria |
| 3 | Pérdida severa y frecuentemente inconveniente en la vida diaria |
| 4 | Pérdida casi completa o completa en la agudeza del gusto |
La evaluación objetiva puede realizarse mediante una gustometría química o eléctrica. En la electrogustometría (EGM), se aplican corrientes eléctricas débiles a los diversos campos de las papilas gustativas en la cavidad oral provocando un sabor ácido o metálico. Lo normal es obtener umbrales similares en ambos lados de la lengua. Una diferencia de más de 25% se considera anormal. La quimio-gustometría (QGM) consiste en aplicar soluciones gustativas específicas a distintas concentraciones en la lengua. Puede realizarse mediante un hisopo, colutorios o con tiras gustativas. Al igual que con el olfato, se pueden determinar 2 umbrales, el de discriminación (revela la concentración a la que un estímulo se identifica como diferente al agua) y el de percepción del umbral (concentración más baja a la que una persona reconoce que existe un sabor específico)75,76.
Tratamiento
El tratamiento de las alteraciones del gusto dependerá de la etiología. Se deben controlar los padecimientos de base que puedan condicionar la disgeusia. De ser posible, se debe valorar la suspensión o el cambio de los medicamentos previamente mencionados. En los casos de disgeusia severa, está indicado el uso de anestésicos tópicos como lidocaína en gel77.
La suplementación con Zn puede ser útil en pacientes que fueron sometidos a quimio o radioterapia, o con alguna enfermedad que pueda condicionar la deficiencia de este mineral (ej. en enfermedad renal crónica). Las dosis son variables. Van desde 45 mg 3 veces al día, hasta dosis de 300 mg al día78,79.
La disminución de la producción salival puede atribuirse a factores como la menopausia, contaminación ambiental, radiación a cabeza y cuello, diabetes mellitus y ciertos medicamentos. En este escenario pueden resultar útiles el uso de saliva artificial o estimulantes de saliva como la pilocarpina. Esta última ha demostrado una mejoría de la disgeusia posterior a al tratamiento79.
Se debe asegurar una adecuada higiene oral y un buen estado de las prótesis dentales. Algunas prótesis metálicas, pueden activar las papilas gustativas por corrientes eléctricas que se llegan a generar y pueden provocar dolor, sabores o sensaciones. Se ha demostrado que una limpieza bucal constante y adecuada, principalmente en pacientes mayores, disminuye los trastornos del gusto80,81.
En los casos donde no se identifica una causa de la disgeusia, la simple comunicación y asesora- miento del paciente pueden aminorar los síntomas de ansiedad y depresión. La valoración por un psiquiatra resulta de gran utilidad. Ciertas medidas generales pueden ayudar al paciente a sobrellevar su padecimiento. Se recomienda realizar comidas más pequeñas y con mayor frecuencia durante el día, utilizar condimentos, salsas, ingerir caramelos ácidos para aumentar la producción salival, entre otras medidas82.
En la figura 6 se muestra un algoritmo para el abordaje de pacientes con trastornos del olfato y el gusto.
CONCLUSIONES
El olfato y el gusto son formas de relacionarnos con nuestro ambiente, fuentes de placer y mecanismos de alarma para diversos peligros. Por la estrecha relación que guardan entre ellos, es común que ambos sistemas se encuentren alterados en el mismo paciente. Esta afección tiene un gran impacto en la calidad de vida. La etiología es diversa, por lo que se requiere un abordaje minucioso y sistemático. Por la prevalencia de estos trastornos y su impacto como marcador pronóstico en diversas enfermedades, su conocimiento y estrategia de evaluación deberá ser del dominio del médico.











 nueva página del texto (beta)
nueva página del texto (beta)