INTRODUCCIÓN
Los estudios genómicos estiman que los hongos tienen 900 millones de años de historia evolutiva asociada al establecimiento de interacciones biológicas favorables (mutualistas) con diversas especies de seres vivos, incluidos plantas y animales1. Actualmente, se reconoce que los hongos tienen un papel importante en el mantenimiento del equilibrio de los ecosistemas y su desaparición podría afectar directamente la subsistencia de otras especies. Sin embargo, aún existe resistencia para reconocer su impacto global en la salud humana, posiblemente porque muchas de las infecciones fúngicas cursan de manera asintomática o con manifestaciones intermedias, a pesar de ser en varios casos progresivas y de duración prolongada. De esta manera, la vigilancia epidemiológica se enfoca principalmente en los casos severos, aunque estos siguen subestimados debido a la carencia de pruebas diagnósticas específicas y a la falta de profesionales de la salud con especialidad en el área de la micología para la identificación correcta de los agentes etiológicos. La Fundación de Acción Global para las Infecciones Fúngicas (GAFFI, por sus siglas en inglés) ha estimado de manera reciente que más de 300 millones de personas en el mundo padecen enfermedades severas de etiología fúngica, y se calcula que cada año ocurren 1.6 millones de muertes, lo que es superior al número de defunciones por malaria y tuberculosis2. De las 300 especies de hongos reconocidas como patógenas para los humanos, las incluidas en los géneros Candida, Aspergillus, Histoplasma, Pneumocystis y Cryptococcus son las principales causales de enfermedad severa en pacientes inmunocomprometidos2,3. No obstante, las infecciones en personas inmunocompetentes por diversos géneros de hongos va en aumento, posiblemente por la aparición de especies más virulentas, seleccionadas como variantes resistentes a antimicóticos, o bien, por la introducción y la adaptación de especies fúngicas a nuevos nichos ecológicos, como se ha sugerido en el caso de las infecciones causadas por Cryptococcus gattii en Vancouver, Canadá4. Bajo esta realidad, es imprescindible continuar con el desarrollo de nuevos antifúngicos y terapias inmunomoduladoras que sean eficientes para el control de este tipo de infecciones.
Actualmente, existen cinco grupos de fármacos antifúngicos que se utilizan en la clínica, clasificados con base en su estructura química: polienos, azoles, alilaminas, lipopéptidos y pirimidinas5. El presente trabajo tiene por objetivo enfocarse a la descripción de los antifúngicos poliénicos.
GENERALIDADES DE LOS ANTIFÚNGICOS POLIÉNICOS
En la década de 1960 existía una lista larga de compuestos con actividad antifúngica que habían sido obtenidos y purificados a partir de cultivos de actinobacterias aisladas de suelos de diferentes regiones geográficas. Estos compuestos se clasificaron, de acuerdo con su estructura química, en poliénicos y no poliénicos, aunque la obtención del primer tipo era más abundante (20:1)6. Los antifúngicos poliénicos son compuestos macrólidos que comparten características químicas, pero difieren en sus espectros de absorción de acuerdo con el número de dobles enlaces conjugados presentes en su estructura (de tres a siete) y se les ha clasificado en trienos, tetraenos, pentaenos, hexaenos y heptaenos. Cuentan con un éster en la estructura interna, con un grupo carboxilo libre y una hexosa lateral asociada a un grupo amino primario denominado micosamina (figura 1). Son inestables en presencia de la luz y en soluciones ácidas o alcalinas, así como insolubles en agua6,7. A partir del repertorio de polienos derivados de las actinobacterias, se determinó, según su eficacia, que solo algunos de ellos podrían ser útiles en la terapéutica, y actualmente se utilizan con mayor frecuencia la nistatina y la natamicina, que son representantes del grupo de los tetraenos aislados a partir de cultivos de Streptomyces noursei y de Streptomyces natalensis, respectivamente; así como la anfotericina B, un heptaeno aislado de Streptomyces nodosus.

Figura 1 Estructura química de los antifúngicos poliénicos más utilizados en la clínica. Se resalta en el recuadro la micosamina, estructura común en las tres moléculas, que interactúa directamente con los esteroles (figura realizada con el JSME Molecular Editor).
La anfotericina B es uno de los antifúngicos de mayor espectro disponible hasta el momento, y se utiliza por vía intravenosa, principalmente para el tratamiento de micosis severas causadas por hongos de alta patogenicidad y oportunistas, tales como Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paracoccidioides brasiliensis, Cryptococcus neoformans, así como especies de Aspergillus y Zygomycetes. Aunque la resistencia frente a este antifúngico es poco frecuente, se ha detectado este evento en algunos aislados de infecciones por Pseudallescheria boydii, Aspergillus terreus, Candida lusitaniae, Candida guilliermondii, Fusarium spp. y Trichosporon spp.5,8.
La nistatina se utiliza principalmente para el tratamiento de infecciones cutáneas y de mucosas causadas por Candida spp. (no tiene actividad contra dermatofitos). Se utiliza comúnmente bajo sus presentaciones tópicas y orales. Este fármaco es bien tolerado, puesto que su absorción en mucosa oral, gastrointestinal y piel es mínima, aunque a dosis elevadas puede causar náuseas5. En el caso de la natamicina, su aplicación principal es como agente conservador para productos de leche fermentada y cárnicos (uso aprobado por la COFEPRIS). Sin embargo, también se utiliza para el tratamiento tópico de la queratitis micótica causada por hongos filamentosos como Fusarium spp. y Aspergillus spp.9,10.
MECANISMO DE ACCIÓN
Los estudios realizados en modelos in vitro con bicapas lipídicas artificiales y en experimentos con levaduras, indican que el principal mecanismo de acción de los antifúngicos poliénicos es a través de su unión al ergosterol11. En diversos estudios se ha reportado que la afinidad de la anfotericina B por el ergosterol es 10 veces mayor que su afinidad por el colesterol, lo que le confiere cierta selectividad por las membranas fúngicas12,13. El ergosterol, además de tener un papel estructural para la membrana fúngica, regula diversas actividades fisiológicas, como la fusión homotípica de vacuolas, la endocitosis y la señalización mediada por receptores de membrana (p. ej., receptores de feromonas)14. De esta manera, por el simple hecho de unirse la molécula poliénica al ergosterol, interfiere con funciones vitales para las células fúngicas. Esta interacción es mediada de manera esencial por la micosamina, que es un componente estructural común de los poliénicos (figura 2).

Figura 2 Interacción química entre la anfotericina B y el ergosterol a través de la micosamina (figura realizada con el JSME Molecular Editor, basada en referencia 14).
Los análogos sintéticos de la natamicina que carecen de la micosamina pierden su capacidad para unirse al ergosterol y, en consecuencia, su actividad citotóxica. Para la anfotericina B y para la nistatina (no para la natamicina), también se ha demostrado capacidad para formar poros en la membrana fúngica, lo cual altera la permeabilidad13,14. El grupo hidroxilo del carbono 35 (C35) de la anfotericina B es crítico para el ensamble de un canal iónico que atraviesa la bicapa lipídica, y se puede evaluar su formación mediante la salida de potasio (figura 3). Sin embargo, la alteración de la permeabilidad membranal es tan solo un mecanismo de daño secundario puesto que al eliminar el C35 de la anfotericina B se inhibe la formación del canal iónico sin alterar su capacidad de unión al ergosterol, y se conserva su actividad antifúngica, aunque la concentración mínima inhibitoria se eleva de 0.5 µM a 3 µM14,15. De esta manera, la permeabilización de la membrana es un mecanismo complementario que incrementa la potencia de la anfotericina B y de la nistatina.
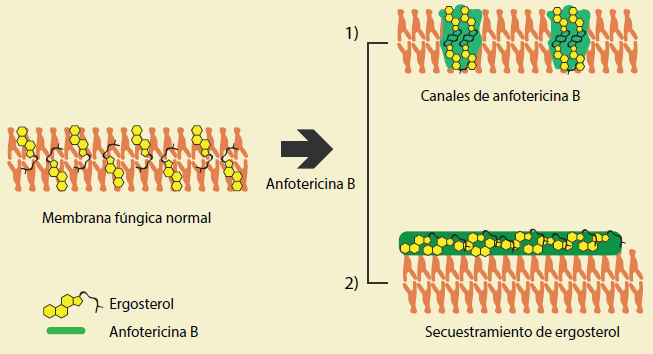
Figura 3 Mecanismos de acción de la anfotericina B. 1) Formación de canales en la que alteran la permeabilidad, 2) Secuestramiento del ergosterol para alterar la estabilidad de la membrana plasmática.
Por otro lado, se han identificado otros mecanismos indirectos de daño a las células fúngicas por efecto de los compuestos poliénicos, tales como los mediados por especies reactivas de oxígeno (ROS) y por la secreción de interleucina-1β (IL-1β) por parte de células del hospedero16,17. En el primer caso, se ha reportado que la anfotericina B y la nistatina aumentan la producción de ROS en biopelículas fúngicas, lo cual disminuye la viabilidad de hongos filamentosos y levaduras aun antes de que los compuestos poliénicos hayan permeabilizado la membrana18. Los análisis complementarios han mostrado que la anfotericina B induce la transcripción de genes de estrés oxidativo16. En cuanto a la inducción de IL-1β, se ha observado que el tratamiento de células dendríticas y macrófagos murinos con nistatina, anfotericina B y natamicina promueve la secreción de IL-1β en altas concentraciones, con respecto a antifúngicos azólicos. Este efecto es mediado por la activación del inflamasoma-NLRP3 y de la caspasa-1 que hidroliza a la pro-IL-1β hacia su forma activa (IL-1β), posiblemente como una respuesta a la secreción de iones potasio inducida por la formación de los canales iónicos17. De esta manera, los antifúngicos poliénicos tienen efectos directos e indirectos que median la eliminación de los hongos patógenos.
La anfotericina B puede encontrarse en diferentes presentaciones para su administración: como desoxicolato de anfotericina B, como complejo lipídico (con dimiristilfosfatidilcolina y dimiristoilfosfatidilglicerol), en forma coloidal (con sulfato de colesterol) y en forma liposomal12,19; todas estas presentaciones están formuladas para solubilizar de manera óptima la anfotericina B. Mientras que el desoxicolato de anfotericina B es la presentación que causa reacciones adversas de mayor severidad en los pacientes, la forma liposomal es la forma menos tóxica, posiblemente como consecuencia de la liberación de la anfotericina B en una región muy cercana a la membrana fúngica. Los liposomas están formados por dos tipos de fosfolípidos, colesterol y anfotericina B. Mediante microscopía electrónica se ha observado que los liposomas viajan a través de la pared fúngica hasta alcanzar la membrana plasmática, donde la anfotericina B es liberada como consecuencia de su mayor afinidad por el ergosterol fúngico que por el colesterol del liposoma que la transporta. Este es un mecanismo más eficiente para que el fármaco llegue a su sitio blanco, con menor afectación de las células del paciente que contienen colesterol20. Es pertinente mencionar que un mecanismo de resistencia fúngica ante los antimicóticos poliénicos consiste en reducir la síntesis de ergosterol21 o bien, en tener una mayor actividad de la enzima catalasa para reducir el daño por peroxidación de lípidos, también inducida durante el tratamiento con anfotericina B8,22.
FARMACOCINÉTICA DE LOS ANTIFÚNGICOS POLIÉNICOS Y FORMAS FARMACÉUTICAS
Nistatina
La nistatina se puede administrar por vía oral o cutánea; en ambos casos la absorción es baja o nula. Está indicada para tratar las formas de candidosis mucocutáneas. Se usa por vía oral para eliminar infecciones gastrointestinales y evitar extensión perianal o diseminación vía hematógena a partir de un foco intestinal en pacientes con inmunodeficiencias. Las formas farmacéuticas disponibles son: suspensión oral 100,000 UI/mL; grageas 500,000 UI; ungüento 100,000 UI/g y óvulos vaginales, 100,000 UI. En prematuros con bajo peso al nacer y lactantes, se administran 1 y 2 mL de la suspensión oral, respectivamente; mientras que en niños y adultos se recomiendan 4-6 mL, cuatro veces al día. Las grageas están recomendadas para tratamiento de candidosis del aparato digestivo23.
Natamicina
Su principal aplicación es para el tratamiento de queratitis micóticas, producidas por hongos de los géneros Aspergillus spp., Acremonium spp. y Fusarium spp. Se encuentra disponible en solución o crema de uso oftálmico al 5%, que se aplican cada dos horas. No se absorbe, pero puede causar irritación24.
Anfotericina B
La anfotericina B se absorbe en menos del 5% al administrarse por la vía oral, mientras que a nivel intramuscular su absorción es nula, razón por la que generalmente se administra por la vía intravenosa mediante una infusión con solución de dextrosa al 5%.22 Después de la administración sistémica de la forma con desoxicolato, la anfotericina B alcanza concentraciones de 1-2 µg/mL en circulación. El 95% del antifúngico se une principalmente a lipoproteínas plasmáticas y se distribuye en todos los tejidos con un volumen de distribución de 4 L/kg. La anfotericina B se puede detectar en hígado, bazo, pulmones y riñones. En líquido sinovial y humor acuoso, las concentraciones alcanzadas son del 50-60% de la concentración plasmática mínima. En líquido cefalorraquídeo se ha cuantificado 2-4% de la dosis administrada, pero este valor aumenta durante la inflamación de las meninges. Es metabolizada parcialmente en hígado y eliminada por bilis (< 15%) y por vía urinaria (cerca del 5%). La vida media de eliminación de la anfotericina B inicial es de 24 horas, seguida de una eliminación terminal más lenta que requiere alrededor de 15 días, aunque se han reportado concentraciones residuales en sangre hasta por siete semanas22. Este antifúngico es el tratamiento idóneo para casi todas las micosis sistémicas, aunque su limitante son las reacciones secundarias que produce en el paciente25. De las cuatro formulaciones disponibles, el desoxicolato de anfotericina B es la que se utiliza con mayor frecuencia por su menor costo con respecto a las formulaciones lipídicas, aunque es la que induce mayor toxicidad. En candidosis diseminada y criptococosis, se puede administrar con 5-fluorocitosina, que tiene un efecto sinérgico, lo que permite reducir la dosis de la anfotericina B para disminuir las reacciones adversas25,26.
Las formulaciones lipídicas ofrecen ventajas sobre el desoxicolato de anfotericina B en cuanto a que: 1) se pueden administrar en dosis diarias mucho más elevadas, 2) se obtiene mayor concentración en los diferentes órganos y tejidos, 3) la toxicidad se reduce de manera importante, principalmente con la forma liposomal y 4) se reduce de modo significativo la nefrotoxicidad27. Considerando el costo elevado de estas formulaciones, se recomienda usarlas si el paciente desarrolla insuficiencia renal durante el tratamiento o si hay progresión de la enfermedad después de la administración de 500 mg de desoxicolato de anfotericina B, lo mismo en pacientes que estén bajo tratamiento simultáneo con fármacos nefrotóxicos27),(28.
Las indicaciones terapéuticas de las diferentes formulaciones de la anfotericina B se presentan en la tabla 1.
Tabla 1 Posología e indicaciones terapéuticas de las diferentes formulaciones de la anfotericina B
| Anfotericina B desoxicolato | Anfotericina B dispersión coloidal | Anfotericina B complejo lipídico | Anfotericina B liposomal | ||||
|---|---|---|---|---|---|---|---|
| Indicaciones | Posología(mg/kg/día) | Indicaciones | Posología(mg/kg/día) | Indicaciones | Posología(mg/kg/día) | Indicaciones | Posología(mg/kg/día) |
| Candidosis esofágica | 0.3 | Aspergilosis invasiva; daño renal; infecciones refractarias o intolerantes a anfotericina B desoxicolato | 3.0-4.0 | Infecciones fúngicas invasivas, refractarias o intolerantes a anfotericina B desoxicolato | 5.0 | Neutropénicos con fiebre persistente posterior a tratamiento con antibiótico | 3 .0 |
| Blastomicosis, histoplasmosis diseminada y esporotricosis extracutánea | 0.5 | Meningitis por Cryptococcus en pacientes con VIH | 6.0 | ||||
| Meningitis por Cryptococcus | 0.6-0.8 | Infecciones por aspergilosis, candidosis, criptococosis refractarias o intolerantes a anfotericina B desoxicolato; pacientes con daño renal; leishmaniasis visceral | Inmunocompetentes: 3.0 Inmunocomprometidos: 4.0 | ||||
| Coccidioidomicosis | 1.0 | ||||||
| Mucormicosis o aspergilosis invasiva | 1.0-1.5 | ||||||
| Neutropénicos con fiebre persistente y tratamiento con antibiótico | 0.5-1.0 | ||||||
REACCIONES ADVERSAS
El hecho de que los antimicóticos poliénicos tengan efecto parcial sobre las células del hospedero implica que pueden inducir efectos secundarios o adversos en los pacientes bajo tratamiento. En general, la frecuencia de reacciones adversas producidas por el tratamiento con desoxicolato de anfotericina B es alta y pueden considerarse las de tipo inmediato, así como las relacionadas con la dosis y la duración del tratamiento. Las de tipo inmediato se presentan al momento de la administración y consisten en fiebre, escalofrío, temblores, cefalea, vómito, flebitis e hipotensión29; pueden durar alrededor de una semana. Dentro del segundo tipo de reacciones adversas, la más relevante es la nefrotoxicidad, que generalmente es reversible en pacientes sin antecedentes de lesión renal, aunque la recuperación puede requerir varias semanas30.
El 80% de los pacientes con infecciones sistémicas tratados con anfotericina B presentan incremento en los niveles de creatinina en suero; de ellos, del 40 al 60% tienen el doble del valor normal y el 15% desarrollan disfunción renal con necesidad de terapia por diálisis. Los mecanismos de toxicidad renal son resultado de la vasoconstricción de las arteriolas aferentes, lo que provoca la disminución de la filtración glomerular con incremento en los niveles de urea y creatinina en suero. La hipoxia y la isquemia en células epiteliales y endoteliales del túbulo conducen a un proceso inflamatorio y a la generación de especies reactivas de oxígeno que favorecen la lipoperoxidación en membranas celulares, daño al ADN y la pérdida de la viabilidad celular31,32. Por otro lado, se ha observado hipocalcemia e hipomagnesemia en el 25% de los pacientes32, eliminación de bicarbonato y desarrollo de anemia normocítica normocrómica, como consecuencia de la inhibición de la síntesis de eritropoyetina y por efecto directo sobre la médula ósea25,33. Asimismo, la producción de citocinas proinflamatorias por parte de células mononucleares expuestas al desoxicolato de anfotericina B y a la dispersión coloidal, contribuyen a los síntomas sistémicos adversos, mientras que la anfotericina B liposomal y el complejo lipídico se asocian con niveles predominantes de IL-10 con respecto a TNF-α.34
MEDIDAS PARA PREVENIR EL DESARROLLO DE TOXICIDAD DURANTE LA ADMINISTRACIÓN DE LA ANFOTERICINA B
Ante la escasa disponibilidad de las formas lipídica y liposomal de la anfotericina B, es un reto reducir la toxicidad de la formulación con desoxicolato en pacientes que están cursando con infección severa, ya que, como se mencionó, la anfotericina B se utiliza principalmente para tratar infecciones causadas por hongos de elevada patogenicidad, oportunistas y multirresistentes.
Una medida que aún es controvertida para reducir los efectos adversos de la anfotericina B, pero que ha dado buenos resultados en varios casos, es la disminución de la velocidad de infusión; se ha reportado que la nefrotoxicidad se reduce de manera importante si la infusión es continua a lo largo de un período de 24 horas, comparado con la infusión a seis horas35.
Para reducir el daño renal, también ha resultado positivo el proporcionar una adecuada hidratación a los pacientes; con la administración de una carga de 0.5-1.0 L de solución salina una o dos horas antes de la infusión de anfotericina B32. En caso de que el paciente no tenga falla renal previa, es conveniente también el pretratamiento con analgésicos-antipiréticos, como paracetamol, y con antieméticos, a fin de reducir los otros síntomas adversos asociados. La hidrocortisona y la heparina disminuyen el riesgo de flebitis si se administran 25-50 mg o 500-1,000 U/mL, respectivamente. La difenhidramina también puede reducir la fiebre, los escalofríos y la cefalea en dosis de 25-50 mg; también se han utilizado antiinflamatorios no esteroides, como ibuprofeno, 30 minutos antes de su administración36.
Finalmente, existen modelos animales que sugieren que el tratamiento con flavonoides, tales como la hesperidina y la diosmina, funcionan como una terapia alternativa preventiva del daño agudo renal, secundario al uso de la anfotericina B31. Sin embargo, hacen falta más estudios para que este tratamiento se aplique de manera estándar.
CONCLUSIÓN
La anfotericina B es el principal representante de los antifúngicos poliénicos y un recurso importante en la práctica clínica contra infecciones fúngicas invasivas y multirresistentes, a pesar de las reacciones adversas que produce, por lo que las nuevas formulaciones lipídicas han sido de gran beneficio para reducir los niveles de toxicidad en los pacientes. Sin embargo, es necesario que el costo de estas nuevas formulaciones se reduzca a fin de que exista mayor acceso a ellas y se logre descontinuar en algún momento al desoxicolato de anfotericina B. La información resumida en este trabajo puede ser de utilidad para conocer las propiedades y los mecanismos de acción de los antifúngicos poliénicos, así como sus aplicaciones en la práctica clínica y las medidas preventivas para reducir las reacciones adversas de las formulaciones aún disponibles en el sector salud.











 nueva página del texto (beta)
nueva página del texto (beta)


