INTRODUCCIÓN
En México, los tumores del sistema nervioso ocupan el tercer lugar de las neoplasias malignas. El meduloblastoma constituye el 20% de los tumores primarios del sistema nervioso central, y el 40% de los que se originan en el cerebelo, lo hacen en la capa granular externa, migra del vermis hacia la superficie de los hemisferios cerebelosos y de ahí hacia las porciones profundas para poblar la capa granular interna de las folias1.
En México, los tumores del sistema nervioso ocupan el tercer lugar de las neoplasias malignas. El meduloblastoma constituye el 20% de los tumores primarios del SNC. La OMS divide a los tumores del SNC de acuerdo al tipo histológico, características morfológicas asociadas al pronóstico y marcadores moleculares de citodiferenciación, y clasifica al meduloblastoma entre los tumores embrionarios grado IV, siendo el tumor maligno más frecuente del SNC en la edad pediátrica, típicamente localizado en fosa posterior.
El sistema de clasificación de tumores del sistema nervioso central (SNC) más completo y actualizado es el de la Organización Mundial de la Salud (OMS). En el cual divide a los tumores del SNC de acuerdo al tipo histológico, características morfológicas asociadas al pronóstico y marcadores moleculares de citodiferenciación2,3 (tabla 1). La OMS clasifica al meduloblastoma en el grupo de los tumores embrionarios grado IV4.
Tabla 1 Características de los tumores de acuerdo al grado de la OMS3
| OMS Grado I | Tumores circunscritos, de lento crecimiento y bajo potencial de conversión a un tumor de mayor malignidad |
| OMS Grado II | Tumores de borde difuso, lento crecimiento y algunos con tendencia a progresar a tumores de mayor malignidad |
| OMS Grado III | Tumores infiltrantes con células atípicas o anaplásicas y mayor número de mitosis |
| OMS Grado IV | Tumores de rápido crecimiento con alta tasa mitótica, pudiendo presentar vasos de neoformación y áreas de necrosis |
El meduloblastoma es el tumor maligno más frecuente del SNC en la edad pediátrica, típicamente localizado en fosa posterior5. Ocurre con mayor prevalencia en varones (ratio 1.5:1) y en pacientes menores de 10 años, también puede presentarse con menor frecuencia en adultos entre la tercera y cuarta décadas de la vida4. El pico de incidencia de este tumor es entre los 5 y 7 años de edad, pero puede presentarse hasta los 18 años1. Disemina por medio de líquido cefalorraquídeo (LCR) con metástasis al espacio subaracnoideo, alrededor de la médula espinal y de ahí pasa al hueso, hígado, médula ósea y otros sitios menos frecuentes1.
Su etiología es desconocida, se ha visto relacionado con el síndrome de carcinoma nevoide de células basales (síndrome de Gorlin), ataxia telangietásica, síndrome de Li-Fraumeni, neurofibromatosis tipo 1 y 2, síndrome de Rubinstein-Taybi, anemia de Fanconi, síndrome de Nijmegen, síndrome de Turcot tipo-2 y presencia de cromosomas extras en los grupos 6-12 y 4-51,4.
El cuadro clínico varía de acuerdo con la edad del paciente y la extensión de la lesión, ya sea local o metastásica; los hallazgos clínicos se relacionan con el aumento de la presión intracraneal por la hidrocefalia secundaria a la obstrucción tumoral (tabla 2). Los signos y síntomas son: cefalea de predominio matutino, con atenuación posterior a emesis, papiledema, irritabilidad, diplopía, nistagmos y aumento del perímetro cefálico en pacientes de edad muy temprana4. Los síntomas en pacientes con enfermedad diseminada varían dependiendo del sitio afectado (tabla 2)4.
Tabla 2 Síntomas de acuerdo con la localización del tumor y la compresión de estructuras adyacentes4
| Localización | Síntomas |
|---|---|
| Vermis | Ataxia asociada a espasticidad y marcha inestable |
| Lateral (más frecuente en niños de edad avanzada y adultos) | Ataxia de miembros y disdiadocinesia |
| Diseminación a hemisferios cerebrales | Convulsiones |
| Diseminación a canal espinal | Síntomas de compresión medular |
| Compresión del núcleo del IV par, tracción o presión de este en su trayecto en base craneal | Parálisis del nervio abducens |
| Presión del tronco-encefálico dorsal | Síndrome de Parinaud (parálisis de la mirada vertical y pupilas reactivas a la acomodación, pero no a la luz) |
El plan de tratamiento se ajusta para cada uno de los pacientes de forma individualizada considerando los factores de riesgo y el pronóstico; los 3 pilares para el tratamiento del meduloblastoma son: cirugía, quimioterapia y radioterapia4.
El PET/CT forma parte de los estudios de imagen utilizados para el diagnóstico y seguimiento de los pacientes con meduloblastoma4.
El PET/CT no solo juega un papel clave para el diagnóstico y seguimiento de los pacientes con tumores cerebrales primarios y metastásicos, sino también para la planificación del tratamiento y evaluar la respuesta que tienen los pacientes al tratamiento recibido1.
Existen diferentes radiofármacos utilizados en PET/CT para el estudio del meduloblastoma, dentro de los más utilizados encontramos el 18F-FDG y los análogos de somatostatina como el 68 Ga-DOTA-NOC. La concentración de estos radiofármacos parece estar asociada con la supervivencia de los pacientes6,7 y ambos son de gran utilidad para el seguimiento de los pacientes con esta patología8,9.
PET/CT COMO HERRAMIENTA DE NEUROIMAGEN
Con las técnicas de tomografía por emisión de positrones/tomografía computada (PET/CT) utilizadas en neuroimagen es posible evaluar no solo la parte morfológica convencional (CT), sino también la parte funcional o metabólica de los diferentes órganos y sistemas (PET), mediante la coincidencia de imágenes en reconstrucciones volumétricas (fusión de imágenes) que generan información anatómica y funcional de gran utilidad en el análisis de diferentes patologías. También ayudan a precisar la localización tridimensional de pequeñas lesiones ocupativas en el parénquima cerebral, y permiten conocer las coordenadas para abordajes quirúrgicos o terapéuticos10.
El PET/CT forma parte de estos estudios de neuroimagen y actualmente es una herramienta diagnóstica de gran importancia en la oncología, por lo cual es de utilidad en la evaluación de lesiones neoplásicas del sistema nervioso central. Los pacientes diagnosticados con meduloblastoma y que han completado su tratamiento generalmente llevan un seguimiento con estudios de neuroimagen que permiten detectar la recurrencia de la enfermedad11.
Como ya se mencionó, la radioterapia forma parte del tratamiento para el meduloblastoma local y metastásico. En los estudios de seguimiento en múltiples ocasiones se puede enfrentar un reto diagnóstico al intentar determinar si una lesión nueva o antigua detectada en resonancia magnética (RM), que es el estudio de elección, puede corresponder a pseudoprogresión, necrosis por radiación o recidiva tumoral11,12. Las características claves para el diagnóstico de recurrencia tumoral en las imágenes por resonancia magnética son: restricción al movimiento de las moléculas en las secuencias de difusión, altos índices de colina/creatina y colina/NAA por espectrometría, realce del tumor mayor al 25% en las secuencias contrastadas, aumento de la intensidad de señal en T2/FLAIR o que se encuentre una nueva lesión. El Grupo de Trabajo de Evaluación de Respuesta en Neuro-oncología (RANO) publicó un conjunto actualizado de criterios para incluir imágenes de resonancia magnética, además del uso de corticoesteroides y el estadío clínico13. Este definió las respuestas al tratamiento como respuesta completa, respuesta parcial, enfermedad estable y enfermedad progresiva.
Una de las principales limitaciones de la RM es su escasa especificidad para diferenciar entre recurrencia y pseudoprogresión o radionecrosis14, que también presentan alteraciones en las imágenes ponderadas en T2 y en las secuencias contrastadas; aunque la precisión diagnóstica puede llegar al 90% según algunas revisiones12. Es en estos casos donde la RM no define el diagnóstico diferencial donde el PET/CT puede brindar información funcional para poder diferenciar las lesiones secundarias al tratamiento de radioterapia de aquellas que corresponden a recurrencia tumoral debido a la especificidad del comportamiento molecular del tumor15.
RADIOFÁRMACOS
Existe una gama muy amplia de radiofármacos que pueden ser utilizados para la evaluación de lesiones neoplásicas y tumorales del SNC, mediante el estudio de PET/CT. Sin embargo, los más utilizados para evaluar el medulobastoma son: el análogo de glucosa 18F-FDG, y los ligandos del receptor de somatostatina, como el 68 Ga-DOTA-NOC11.
FDG Y SU UTILIDAD EN PACIENTES CON MEDULOBLASTOMA 18FDG o 18-fluorodesoxiglucosa
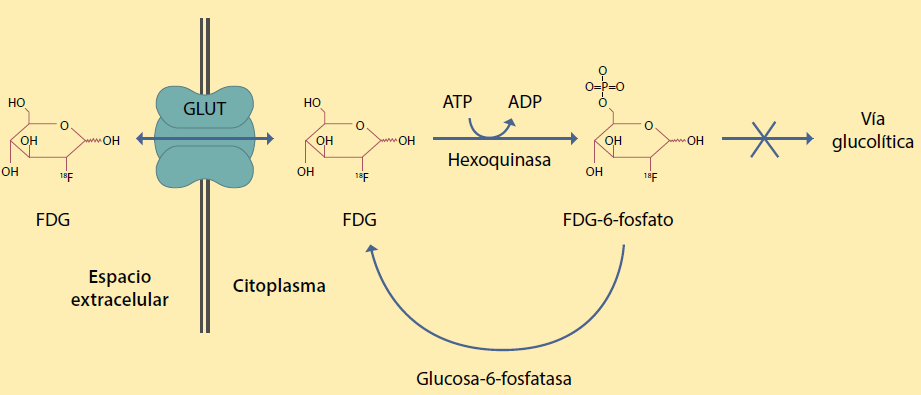
El análogo de la glucosa 18F-FDG es el radiofármaco de PET más utilizado como método de imagen en la oncológica clínica, ya que existe sobrexpresión de transportadores GLUT en las células cancerígenas debido a su metabolismo glucolítico aumentado, como es el caso del meduloblastoma. La concentración celular de la molécula 18F-FDG es mediada por proteínas transportadoras localizadas en la membrana celular, especialmente GLUT1 y GLUT3. Una vez dentro de la célula, la 18F-FDG es fosforilada mediante la enzima hexoquinasa. Debido a la falta de un grupo 2-hidroxi la molécula de 18F-FDG no puede experimentar un metabolismo a través de la vía glucolítica por lo que queda atrapada en el interior de la célula. La acción de la glucosa-6-fosfatasa puede revertir esta acción, permitiendo la salida del 18F-FDG de la célula. Esta ruta se muestra esquemáticamente en la (figura 1)11.
Muchas neoplasias, incluidos los gliomas y tumores cerebrales metastásicos, tienen mayor captación de glucosa debido a tasas de glucólisis elevadas, incluso en presencia de niveles adecuados de oxígeno, para apoyar la fosforilación oxidativa (el efecto Warburg), lo que favorece mayor acumulación de 18F-FDG en los tumores a diferencia de los tejidos sanos, donde la captación es menor11,16.
Se debe tomar en cuenta que las lesiones inflamatorias, por causas infecciosas o no infecciosas y el parénquima cerebral adyacente a hemorragias intraparenquimatosas subagudas también pueden tener una alta captación de 18F-FDG, disminuyendo la especificidad del 18F-FDG en la diferenciación de lesiones de etiología no maligna11.
La principal limitación del 18F-FDG PET/CT, como en todos los tumores cerebrales, es la alta absorción de la corteza cerebral normal que limita la delineación de tumores corticales o pericorticales17.
El PET con 18F-FDG en esta situación clínica varía con una sensibilidad del 73 al 100%, con una especificidad del 56 al 100%, valor predictivo positivo y negativo del 80 y 46% respectivamente. Comparada con la IMR el PET con 18F-FDG resulta ser superior, tanto en la detección de recidiva tumoral como en la de recurrencia. El máximo rendimiento se obtiene con la imagen de fusión PET/CT15.
RADIOFÁRMACOS ANALOGOS DE SOMATOSTATINA Y PET/CT EN PACIENTES CON MEDULOBLASTOMA
La somatostatina es un neuropéptido producido por neuronas, células endocrinas y células inmunes, se encarga de la regulación de las secreciones endocrinas y exocrinas; la modulación del sistema motor-sensorial, autonómico y cognitivo; así como funciones paracrinas y autocrinas e inhibición de la proliferación celular18. Los receptores de somatostatina (SSTR) son receptores de hormonas peptídicas localizados en membranas celulares del tejido pancreático, gastrointestinal y también en la superficie de las neuronas cerebrales. En el cerebro humano existe una distribución específica y densa de SSTR en áreas corticales y límbicas19. También se ha identificado la expresión de SSTR en tumores cerebrales, encontrando 6 diferentes tipos de receptores: 1, 2A, 2B, 3, 4 y 519. Se ha demostrado que los meduloblastomas expresan altos niveles de SSTRs especialmente tipos 2 y 3. Este hallazgo abrió la posibilidad de usar radiofármacos análogos de somatostatina en la evaluación de esta enfermedad con fines diagnósticos y de investigación20-23.
En la actualidad existen diferentes radiofármacos análogos de somatostatina, algunos de los disponibles para imágenes clínicas son 68Ga-DOTA-Phe1-Tyr3-octreotide (TOC), 68Ga-DOTA-NaI3-octreotide (NOC), y 68Ga-DOTA-Tyr3-octreotate (TATE). Estos agentes difieren principalmente con respecto a su afinidad por SSTR. Todos estos radiofármacos se unen para SSTR tipo 2, el 68Ga-DOTA-TOC también se une al SSTR 5, mientras que 68Ga-DOTA-NOC también se une a SSTRs 3, 4 y 24,25.
El SSTR 2 tiene mayor afinidad para 68Ga-DOTA-TATE, seguido de 68Ga-DOTA-NOC y 68Ga-DOTA-TOC22. Debido a su mayor espectro de afinidad de receptores el 68Ga-DOTA-NOC es el agente de elección para estudio de tumores intracraneales.
Los péptidos 68Ga-DOTA no pueden diferenciar entre diferentes tipos histológicos de tumores intracraneales que expresan SSTR. Se deben tener en cuenta estas limitaciones del estudio PET/CT con 68Ga-DOTA-péptido PET22,24,25.
El PET/CT también puede utilizar 68Ga-DOTA-péptido para la detección de metástasis a distancia (a nivel de medula ósea) y la detección de recidivas tumorales o recurrencia. Otra de las ventajas de estos radiofármacos para meduloblastoma es la selección de pacientes para terapia con péptidos radiomarcados (teranóstico), ofreciendo otra posibilidad terapéutica para los pacientes9. Esto último puede refinar la especificidad molecular del campo de radiación y reducir la discapacidad neurocognitiva relacionada con el tratamiento26,27.
Estos radiofármacos antes mencionados (FDG Y 68Ga-DOTA-péptido) permiten evaluar la extensión tumoral inicial, así como tumores recurrentes o lesiones metastásicas, ya que ambos radiofármacos permiten distinguir entre necrosis postradiación y tejido cicatrizal de recurrencia de la enfermedad17-22. La elección entre un radiofármaco y otro dependerá del sitio anatómico que se quiere evaluar, ya que se debe tomar en cuenta la biodistribución fisiológica de ambos radiofármacos para determinar cual es el ideal en cada paciente.
Los radiofármacos más utilizados en PET/ CT para el estudio del meduloblastoma son el 18F-FDG, que ha mostrado avidez por las lesiones compatibles con este tipo de tumores, debido a la sobreexpresión de receptores GLUT, en especial GLUT 1 y de igual forma el 68Ga-DOTA-péptido por la expresión que tienen estas lesiones de los diferentes tipos de receptores de somatostatina, especialmente tipo 2 y 3.
CONCLUSIONES
El PET/CT es una herramienta de neuroimagen que se utiliza en oncología diagnóstica ya que evalúa las lesiones desde el punto de vista tanto morfológico como funcional, permitiendo una localización anatómica más precisa de la actividad tumoral en el SNC. El meduloblastoma es el tumor más frecuente en la edad pediátrica, por lo que conocer sobre la utilidad de los estudios es de gran importancia, ya que permiten al médico tratante determinar el estadio clínico del paciente, localizar el mejor sitio para la toma de biopsia, orientar hacia el diagnóstico, evaluar la respuesta al tratamiento, la extensión de la enfermedad con la presencia o no de lesiones metastásicas y determinar la recurrencia de la enfermedad.
Los radiofármacos más utilizados en PET/CT para el estudio del meduloblastoma son el 18F-FDG (figura 2) el cual ha mostrado avidez por las lesiones compatibles con este tipo de tumores, debido a la sobreexpresión de receptores GLUT, en especial GLUT 1 y de igual forma el 68Ga-DOTA-péptido por la expresión que tienen estas lesiones de los diferentes tipos de receptores de somatostatina, especialmente tipo 2 y 3. El PET/CT es una herramienta diagnóstica no invasiva que presenta buena sensibilidad y especificidad para evaluar el meduloblastoma, especialmente al evaluar la respuesta al tratamiento y la detección de recurrencia, especialmente cuando la RM no es determinante. Por esta razón conocer la indicación precisa de los estudios PET/CT, permiten llevar un manejo adecuado en el seguimiento de los pacientes con meduloblastoma, evitando someter al paciente a procedimientos invasivos e innecesarios.

Figura 2 Masculino de 19 años con diagnóstico de meduloblastoma con implantes medulares. a) TC sagital de cuerpo entero con medio de contraste intravenoso que muestra lesiones hiperdensas diseminadas aleatoriamente en trayecto medular. b) y c) Imágenes de fusión PET/CT-18FDG de cuerpo entero en plano sagital, donde se observa incremento del metabolismo glucolítico en trayecto de la medula espinal.
CONFLICTOS DE INTERÉS
Ninguno.











 nueva página del texto (beta)
nueva página del texto (beta)