INTRODUCCIÓN
El uso de la marihuana está restringido en la mayor parte de los Estados Unidos y su utilización se considera una ofensa federal en cualquiera de sus estados. Aunque en la mayoría de los países del mundo su uso también está prohibido, es una de las drogas ilegales de mayor uso (Oficina para el Control de Drogas y Crimen de las Naciones Unidas, UNODEC1). En México, el 8.6%2de la población de entre 12 y 65 años la ha probado alguna vez, y su uso legal se restringe a 5 g por usuario.
La marihuana es una planta que ha sido utilizada con fines medicinales y mágico-religiosos, a lo largo de la historia de la humanidad3. Se han encontrado restos humanos acompañados de restos de la planta que testifican que la marihuana se ha utilizado con estos fines desde hace miles de años, aunque su uso meramente recreativo no está documentado. Asimismo, se ha registrado su empleo con fines industriales, como la utilización de su fibra para la fabricación de objetos útiles al humano.
Aunque por mucho tiempo no se reconocieron casos mortales asociados al uso de la marihuana, recientemente se han reportado muertes por síndrome de hiperémesis por cannabis (cannabis hyperemesis syndrome [CHS]4) y muerte por automutilación5. En el presente, el mayor uso que se le da en nuestro país y en el mundo es recreativo. La Encuesta Nacional del Consumo de Drogas, Alcohol y Tabaco (ENCODAT)2ha mostrado un aumento importante en el número de consumidores, al ser una de las sustancias de abuso más consumidas. Uno de los aspectos que ha tenido más resonancia social es la legalización de sus usos. Es decir, que se autoriza bajo un control estricto, lo que incluye la restricción de edad, (por ejemplo, no se permite a menores de 18 años), los espacios en los que se puede consumir, la cantidad de plantas que se pueden cultivar de manera casera y la pertinencia de formar clubes de consumidores. Lo que nos parece que se ha soslayado es establecer la cantidad de principio activo (delta-9-tetrahidrocannabinol, THC) que la planta debe tener, ya que dependiendo de la variedad puede ser de desde 1.4% (cáñamo) hasta 33%, y se cree que más3. Cabe señalar que la alta concentración de THC está asociada a un mayor riesgo de psicosis y muerte4.
LEGALIZACIÓN DE SU USO RECREATIVO
La propuesta de legalizar responde a la necesidad de reducir el abuso del que se hace objeto a los usuarios, tanto por parte del crimen organizado, como de algunas personas encargadas de ejercer la autoridad. Existen testimonios, sin comprobación, de usuarios que indican que teniendo como única imputación la de poseer marihuana para uso recreativo personal, pero en una cantidad mayor a 5 g, que es lo autorizado y, sin tener relación demostrada con el narcotráfico, han sido sujetos de encarcelamiento. Si así fuera el caso, los consumidores de marihuana y, de hecho, de cualquier droga, están expuestos al abuso de criminales y autoridades, sin tener ningún delito que perseguir más que ser dependientes a sustancias. En este contexto, para abatir este tipo de abusos, parece necesario que la ley permita el uso controlado de la marihuana. Con esta medida, además, el usuario tendrá acceso a un producto que se cultivará libre de impurezas y contaminantes que aumenten su toxicidad, lo que compete a la medicina preventiva también, y se prevendrá que sea abusado por criminales y autoridades.
El otro aspecto que es urgente cubrir es el médico, ya que la gran cantidad de usuarios que voluntariamente se han sometido a estudios neurobiológicos ha ayudado a constatar que el consumo constante de marihuana en cantidades altas produce cambios plásticos en el cerebro que propician la tolerancia y la dependencia a sus efectos. Asimismo, induce cambios estructurales y funcionales en el cerebro que reducen las capacidades de este, particularmente en la esfera cognitiva.
Existen evidencias científicas de que el uso obligado de marihuana, por la dependencia, induce una reducción en el tamaño de algunas estructuras del cerebro que propician un deterioro, como ya hemos mencionado, en las habilidades cognitivas6,7,8,9. Con todo, algunos de los múltiples componentes de esta planta pueden inducir algún efecto con valor terapéutico, que aún está en investigación. Así que, en esta revisión señalaremos los aspectos más relevantes de los daños que produce el consumo de marihuana en los usuarios dependientes y los beneficios que algunos de sus compuestos pueden producir a pacientes con algunas enfermedades. No debemos olvidar que el carácter ilegal en el que se tiene al uso de esta planta propicia un peligro igualmente importante para los usuarios, ya que favorece diversos aspectos que afectan la salud y el bienestar social. Por ejemplo, la marihuana a la venta en el mercado negro puede estar contaminada con diversas sustancias que se agregan a las ya muchas que tiene y que afectan también al cerebro, como insecticidas y otros venenos. En cuanto al bienestar social, el crimen organizado en cárteles puede hostigarlos mientras que los proveedores de justicia buscan la detención de los usuarios, muchas veces de manera ilegal.
LA MARIHUANA
La marihuana o cannabis es una planta que al consumirla aspirando el humo de la combustión de un carrujo o del hashish (hash, pronunciado jash) en un heater o pipa, induce efectos placenteros para el consumidor. En el ámbito callejero se le conoce como marijuana, café, mota, pasto, cáñamo y otros muchos nombres con los que circula entre los usuarios.
La marihuana, se consume con fines lúdicos, en la gran mayoría de los casos y muy raramente con fines medicinales, a pesar de que muchos de los usuarios dicen consumirla con dichos fines (figura 1). Hoy por hoy, no sabemos con todo el rigor que la ciencia exige, cómo esta planta induce placer, aunque se ha sugerido que el delta-9-tetrahidrocanabinol (THC) activa al sistema del placer10.

Figura 1 En esta encuesta se observa que prácticamente el 50% de los encuestados se declaró a favor de que se legalice el uso de marihuana con fines generales, lo que incluye el uso recreativo (a). Asimismo, más del 80% de los encuestados se declararon a favor del uso con fines medicinales.
En México, hasta el año pasado estaba prohibida su investigación médica-científica y, para fines prácticos, podemos decir que sigue prohibida, ya que las autoridades entorpecen el proceso de solicitud de permisos para investigarla. Debido a que contiene alrededor de 400-500 compuestos11,12, es difícil saber cuáles son los principios activos potenciales que generan la sensación subjetiva de placer y cuáles son potencialmente tóxicos. Sin embargo, el principio que más se ha investigado es el THC, al cual, además se le responsabiliza de los efectos psicotrópicos que induce la planta.
Investigaciones menos exhaustivas se han hecho para el canabidiol (CBD), pero sabemos que otros compuestos como el ácido tetrahidrocanabinolic (THCA), canabigerol (CBG), canabinol (CBN), tetrahidrocanabivarina (THCV), ejercen un efecto sobre el cuerpo y, potencialmente, sobre el cerebro.
Tenemos que aclarar que hay muchas razones por las que un sujeto busca ingerir marihuana, entre ellas aliviar dolor13,14, inducir sueño15, reducir la ansiedad16, aumentar el apetito17, aunque la más evidente es la búsqueda de una sensación subjetiva de placer18. Asimismo, la marihuana facilita la comunicación, por lo mismo, la integración a los grupos.
Como sabemos, la marihuana tiene efectos en el sistema del hedonismo, lo activa y hace que se dispare la sensación subjetiva de placer19(figura 2).

Figura 2 Sistema del hedonismo o del reforzamiento o de la motivación recompensa. El sistema libera dopamina y puede ejercer efectos excitadores al afectar sus receptores D1 o inhibidores, al afectar sus receptores D2. Los receptores se encuentran en las neuronas espinosas medianas, que son GABAérgicas del núcleo accumbens y el receptor D2 se encuentra en las terminales glutamatérgicas que llegan al núcleo accumbens desde la corteza prefrontal dorso medial. El receptor D2 también se encuentra en las neuronas piramidales y en las interneuronas GABAérgicas de la corteza prefrontal medial. De esta manera regula actividad de dichas neuronas.
Así que, la marihuana tiene un efecto claramente biológico en el cerebro y otro que es consecuencia del primero, la facilitación de la interacción social. A pesar de que no creemos que la sola activación del sistema del hedonismo es suficiente para explicar la sensación subjetiva de placer, al menos nos permite explicar parte de su mecanismo de acción.
Debido a que la mayoría de los investigadores en el mundo acepta que los efectos placenteros inducidos en el usuario por la marihuana, en gran medida están mediados por el THC, creemos que es crucial tener presente la cantidad de THC que tenga una planta de marihuana, ya que de esto depende el efecto que produzca. Se ha destacado que elcannabissilvestre tiene alrededor de 2 a 4% de THC, mientras que las cultivadas y generadas por cruzas mendelianas entre plantas llegan a tener entre 30 y 33%3. Se tiene registro que de 1995 a 2014 la potencia delcannabisha aumentado, expresada por la concentración de THC, de 4 a 12%, mientras que se ha reducido la del CBD casi a la mitad, modificando así la relación de THC/CBD de 14 a 80 veces20. En Internet anuncian la Y griega con cerca de 28% de THC (https://www.leafly.com). Claramente, los efectos hedónicos dependen de estas concentraciones del THC, pero no sólo los hedónicos, también los adversos, que incluyen una intoxicación aguda con crisis de ansiedad y pánico, o una conducta paranoide, el disparo de un brote del espectro de esquizofrenia o de otros trastornos psicóticos. Asimismo, puede propiciar brotes del trastorno bipolar o epilepsia, entre otros.
LOS RECEPTORES DE MARIHUANA EN EL CEREBRO
Sólo los principios activos de la marihuana THC y CBD se han investigado con mayor amplitud acerca del mecanismo por el cual afectan al cerebro y otras partes del cuerpo. No olvidemos que la cannabis sintetiza alrededor de 400-500 compuestos potencialmente activos, por lo que al consumirla como marihuana no sabemos cuáles de ellos afectan al cuerpo y cuáles no, y los que lo afectan, de qué manera lo hacen, incluso si la interacción de algunos de estos compuestos genera otro efecto.
Así que tendremos que conformarnos, por ahora, en describir los efectos de los mencionados compuestos, el THC y el CBD.
EL DELTA-9-TETRAHIDROCANABINOL (THC) Y OTROS DERIVADOS DE MARIHUANA
El THC es el principio activo de la marihuana más estudiado. Es el equivalente a la nicotina en el tabaco, a la cafeína en el café, a la lactosa en la leche. Activa una serie de receptores en el cuerpo que incluyen a los receptores cannabinoides 1 y 2 (CB1 y CB2). El CB1 participa en diversos procesos fisiológicos y cognitivos; mientras que el CB2 mayoritariamente en la regulación del sistema inmunológico21, aunque también se encuentra en el cerebro.
Asimismo, activa a otros receptores como el receptor 55 acoplado a la proteína G (GPR55), que regula la presión arterial y tiene un efecto sobre el aprendizaje; y al receptor de potencial transitorio vaniloide 1 (TRPV1), que participa en la regulación de la percepción del dolor y la temperatura.
La interacción del THC con el CB1 y del CBD con el CB2 es el área de mayor interés, porque es allí en donde podemos intervenir terapéuticamente.
La existencia de éstos y otros receptores que son activados por el THC y el CBD indica la presencia de una serie de moléculas que el cerebro sintetiza y que hacen las veces de marihuana en nuestro cerebro. Éstas son las llamadas marihuanas endógenas o endocannabinoides (eCBs).
La ciencia ha demostrado que la marihuana afecta a un sistema que naturalmente existe en nuestro cerebro, al cual llamamos sistema endocannabinoide. Así que los compuestos que la cannabis sintetiza pueden afectar al cuerpo porque este tiene receptores internos que los reciben, los cuales están naturalmente activados por los eCBs.
EL SISTEMA ENDOCANNABINOIDE
Los eCBs son moléculas que el cerebro y otros órganos del cuerpo sintetizan. Son lípidos o aceites o grasas que inducen naturalmente los mismos efectos que la marihuana. Este es un sistema que existe en nuestro cuerpo y creemos que se encuentra en todos los humanos, ya que se ha encontrado en todas las personas en las que se ha buscado. Los eCBs cumplen diversas funciones que van desde hacernos sentir placer hasta inhibir la sensación de dolor; y participan en generar apetito, sueño y deseos sexuales, entre otras.
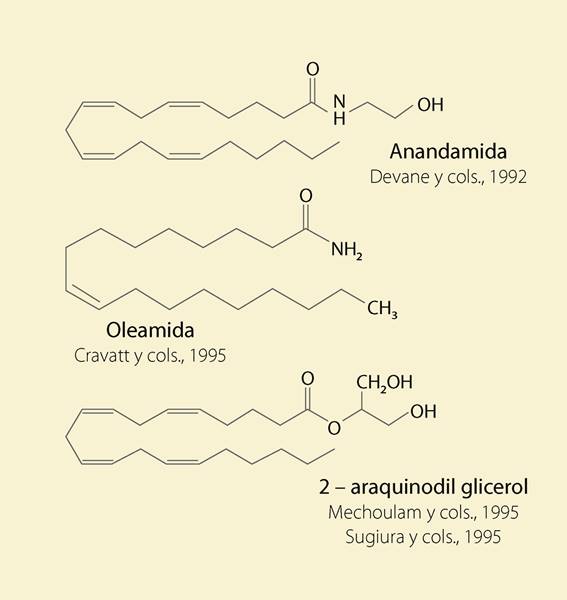
En los últimos casi 60 años, la investigación científica sobre cannabinoides ha evolucionado. El Dr. Raphael Mechoulam describió, en 1964, el principio activo de la marihuana, el THC. Casi 30 años después, en 1992, describió el primer eCB, al cual llamó anandamida22 (figura 3).
Su nombre químico es araquidoniletanolamida (AEA). En 1994, descubrimos un segundo cannabinoide al que llamamos oleamida23. Su nombre químico es cis-9-10-octadecenoamida.
El descubrimiento de estas 2 moléculas (figura 4) (anandamida y oleamida) disparó la investigación en el área de cannabinoides endógenos que ha generado la caracterización del complejo sistema endocannabinoide que regula funciones en el cerebro y en otras partes del cuerpo.
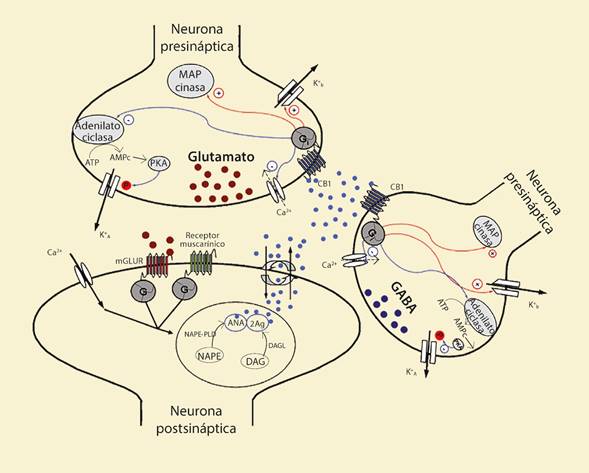
Figura 4 Se ilustra la síntesis y liberación de anandamida y 2-AG, asimismo la expresión y localización del receptor CB1 y sus efectos al ser activados en las neuronas glutamatérgicas y GABAérgicas
Figura 5 La activación del receptor CB1 por endocannabinoides como anandamida (AEA) u oleamida (ODA) aumenta la ingestión de alimento en ratas saciadas.
Las moléculas endógenas que el cerebro y otras partes del organismo sintetizan incluyen la anandamida (ananda quiere decir ‘bendición interna’, en sánscrito.) Este lípido activa a los receptores CB1 y CB2. El organismo también sintetiza a la oleamida, que además de activar al CB1 también activa a receptores serotoninérgicos, como el 5HT2c. Otro que sintetizamos es el 2-araquidonilglicerol (2 AG), que es el eCB natural más abundante en el cerebro, y también activa a los CB1 y CB2. Tiene más actividad en el CB1 que la anandamida y por ello es más potente, pero se une débilmente a los receptores CB2.
El cerebro sintetiza estos eCBs, y para ello utiliza enzimas cuyos nombres químicos son algo elaborados, por ejemplo, la A2-N-acil-fosfatidil-etanolamina-fosfolipasa A2 (NAPE-PLA2, por su nombre en inglés) y la diacilglicerol lipasa (DGL) o las que los destruyen, para que su efecto termine, como la amidohidrolasa de los ácidos grasos (FAAH, por sus siglas en inglés) y la monoacil glicerol lipasa (MAGL).
En el 2001, un cuarto endocannabinoide fue descrito por el grupo del Dr. Raphael Mechoulam, el 2-araquidonil-gliceril-eter (el noladin-eter), que se une al receptor CB1 y causa somnolencia, baja la temperatura corporal, reduce la movilidad intestinal y el dolor. Recientemente se ha descrito que el noladin-eter también se une al GPR55, un receptor que al activarlo provoca que la presión arterial baje. En el año 2016, nuestro grupo de investigación describió que el noladin-eter mejora los procesos de aprendizaje.
En el 2002, Porter y su grupo demostraron que el cuerpo sintetiza otra molécula que activa al receptor CB2 y lo llamaron virodhamida. Se ha mostrado que la virodhamida baja la temperatura corporal en ratones y antagoniza los efectos de anandamida, porque inhibe al receptor CB1.
La oleamida, a su vez, tiene propiedades inductoras de sueño e induce reforzamiento cuando se administra en el sistema del hedonismo; es decir, a las ratas les gusta sentir sus efectos. Aumenta la necesidad de ingestión de alimento en ratas saciadas y reduce la ansiedad y las conductas en ratas que sugieren depresión (figura 5). Nuestro grupo de investigación mostró en el 2001 que también la oleamida regula los procesos de memoria24. Previamente, en 1998, habíamos demostrado que la anandamida también modula la memoria25. Kruk-Slomka y col.26han confirmado nuestros resultados.
Se han descrito otras moléculas semejantes a los eCBs que también son sintetizadas por el cuerpo, las llamadas N-aciletanolamidas. Entre ellas está la oleoiletanolamida (OEA) que posee efectos antiinflamatorios y anoréxicos, además, facilita la vigilia y el palmitoiletanolamida (PEA) que promueve la reducción del dolor y regula la presión intraocular en los humanos. Estos hallazgos nos muestran la gran variedad de eCBs que el cuerpo sintetiza y con los que naturalmente regula nuestras funciones.
El sistema endocannabinoide es parte de otro sistema que ya mencionamos brevemente antes y que llamamos sistema de motivación y recompensa o sistema del hedonismo o del placer. En esta revisión lo llamaremos del hedonismo.
EL SISTEMA DEL HEDONISMO
Este sistema es el que se activa cuando llevamos a cabo una conducta que nos produce placer27, como estar jugando en un equipo deportivo, las conductas sexuales o cuando consumimos un alimento o una bebida refrescante. Se activa incluso cuando reímos (figura 6). Este sistema está dividido al menos en 2 partes funcionales: la motivación y la recompensa. La primera cumple con la función de hacernos sentir deseo por un reforzador. Frecuentemente está activado por una deficiencia que el hipotálamo detecta u otras estructuras como la circunvolución del cíngulo anterior y el lóbulo de la ínsula. La motivación es función del sistema formado por el área tegmental ventral (ATV) y la amígdala (AMY), las cuales proyectan al núcleo accumbens (NAC). El ATV estimula al NAc con dopamina y la AMY con glutamato. Esta combinación de acciones del binomio ATV/AMY hace que la motivación sea una sensación subjetiva de displacer. El hambre, la sed, deseo el sexual y el de dormir son deseos acompañados de displacer. Complementariamente, la recompensa u obtención del reforzador, que puede ser una conducta, como la sexual o el consumo de alimento, hace que el sistema marque la conducta como gratificante, por lo que desearemos volver a realizarla o el alimento volver a consumirlo. La madre naturaleza inventó este sistema con el fin de que deseemos repetir la experiencia y que el deseo por el reforzador sea una sensación de malestar, de sufrimiento.
¿QUIÉN CONSUME MARIHUANA?
La ENCODAT2, indica que aproximadamente 8.6% de la población mexicana entre los 12 y los 65 años ha fumado marihuana, al menos una vez en la vida. Actualmente, hay en el país aproximadamente 70 millones de personas en ese rango de edad, por lo que 8.6% significa aproximadamente 6’020,000 personas.
La marihuana es la droga ilegal de mayor uso en el mundo. En un reporte hecho en 2015 por la UNODC1se calcula que en 2013 había 181.8 millones de usuarios en el mundo. Esto significa el 2.6% de la población mundial.
LOS ADOLESCENTES Y LA MARIHUANA
Los adolescentes, como grupo etario, son vulnerables a consumirla. De hecho, la ENCODAT2reveló que niños de 12 años consumen marihuana. Los estudios han indicado que entre más temprano en la vida se inicie el consumo de sustancias de abuso, más difícil se hará la rehabilitación. El uso de la marihuana en Colorado, Estados Unidos, ha aumentado, desde que su uso lúdico es legal desde 201028.
El aumento en el consumo, abuso y dependencia es especialmente detectado en los jóvenes menores de 17 años. La percepción del daño ha disminuido y es posible que ello haya propiciado su uso. La mayor controversia reside en la idea de que la marihuana tiene propiedades medicinales. Estos datos fueron ampliados en un reporte que se ha llamado “The Legalization of Marijuana in Colorado. The impact” (“La legalización de marihuana en Colorado. El Impacto”29).
Esta información advierte que los cuidados médicos deben reforzarse si vamos a legalizar el uso recreativo de marihuana. Pero, ¿qué pasa específicamente en el cerebro?
EL LADO OSCURO DE LA MARIHUANA
Una pregunta frecuente que hace el público en general es si la marihuana le causa algún daño al cerebro. Mucha gente cree que no causa ningún daño o que el daño puede ser menor. En ese sentido, se ha popularizado la idea de que la marihuana hace menos daño que el alcohol, como resultado de la difusión de un estudio hecho en el Reino Unido por el Comité Científico Independiente sobre Drogas30. La percepción de riesgo está disminuida en toda la población usuaria y en muchos adolescentes no usuarios.
En este estudio se evaluó el daño que produce la marihuana, en comparación al que produce el alcohol o el tabaco, y declararon que es mucho menor, lo cual resulta cierto con los patrones de consumo del 2010, los patrones actuales de consumo han cambiado, es posible que el daño producido por la marihuana que había sido considerado menor no se mantenga y tengamos que enfrentar un daño mayor.
Este estudio ha demostrado también que el daño que la marihuana produce es mayor que el que produce la dietilamida de ácido lisérgico (LSD), las tachas (3,4-metilendioxi-metanfetamina [MDMA] o éxtasis) y los hongos alucinógenos. También produce mayor daño que la ketamina. Así que, en el sector salud debemos estar preparados para enfrentar una potencial escalada en el daño, si los patrones de consumo cambian, volviéndose más permisivos, como la legalización puede propiciar. Con esto no estamos diciendo que no se deba legalizar, sólo estamos considerando el impacto médico y como debemos estar preparados. En la siguiente sección reseñaremos los daños al cerebro inducidos por la marihuana que se han demostrado por estudios científicos.
LA MARIHUANA Y EL NEURODESARROLLO
Uno de los puntos fundamentales de estudiar el efecto de la marihuana en las mujeres embarazadas es mostrar la evidencia científica sobre el daño que su uso produce en el feto que se está gestando.
Globalmente, se ha estimado que el crecimiento del feto de madres usuarias de marihuana a la edad gestacional de 20 semanas es menor que el de las no usuarias31. Por otro lado, se ha tratado de estimar el daño a nivel de neuronas durante el desarrollo. El crecimiento de axones está bien establecido cuando un sujeto es un adulto joven, pero hay cambios que aún se pueden dar antes de los 30 años, propiciando que un sujeto aprenda nuevas estrategias, aunque el proceso de comunicación entre neuronas se empieza a realizar desde muy temprana edad. Por ejemplo, para la 4ª semana de gestación, el sistema nervioso central se ha formado en gran parte. Para el 5º mes, se estima que todas las neuronas que ese sistema nervioso central va a tener, las tiene y empieza en el proceso de elongación de los axones; es cuando la comunicación entre las neuronas se da y se forman los sistemas que regulan nuestra conducta y pensamiento. Este proceso continúa hasta la juventud. Se estima que la corteza prefrontal, que es la parte del cerebro de la que dependen las funciones ejecutivas, termina este proceso hasta los 30 años32.
Se ha mostrado que los endocannabinoides participan en la elongación de los axones33; ya que el receptor CB1 se expresa a todo lo largo del axón. Los endocannabinoides, a través de este receptor, hacen que los axones se orienten hacia las neuronas con las que deben conectarse. Los receptores que son activados son sólo los de la punta del axón, los que están a lo largo del axón no reciben al endocannabinoide porque hay enzimas que los destruyen antes de que activen al receptor.
Sin embargo, cuando la madre consume marihuana, hay un exceso de activación; los receptores que no deberían activarse se activan y el axón se maldirecciona o crecen colaterales del axón que forman una comunicación con neuronas que no debían comunicarse.
CONSECUENCIAS DEL CONSUMO DE MARIHUANA DURANTE EL EMBARAZO
La generación R es un estudio holandés prospectivo, de cohorte, desde la etapa fetal hasta la adultez temprana, orientado a detectar tempranamente causas genéticas y ambientales que afecten el crecimiento, el desarrollo y la salud de los participantes. Las madres que se embarazaron entre abril del 2002 a enero del 2006 fueron incluidas. Este estudio ha mostrado que los niños de esta generación, que han sido expuestos a marihuana durante el embarazo, presentan diversas alteraciones34. Por ejemplo, en la etapa prenatal hay un crecimiento reducido, la circunferencia de la cabeza es menor. Hay aumento de la resistencia de la placenta y reducción del diámetro interno de la aorta.
En la etapa neonatal, presentan peso y talla reducidos, aumento del reflejo de orientación y exhiben temblores, además de cambios en la manera en que duermen. A los 9 meses se detectó un retraso en el desarrollo mental. En las niñas se detectó un aumento en la agresividad y en la inatención a los 18 meses. Se detectaron también trastornos en la memoria a los 36-48 meses, reducción en los índices de desarrollo del lenguaje y un aumento en la ansiedad y la depresión34.
En los niños entre 6 y 10 años se encontró hiperactividad, dificultades para el razonamiento abstracto y alteraciones en el funcionamiento visoespacial.
En el adulto se ha documentado alteración de la memoria visoespacial. Los trastornos aparentemente no permanecen, por lo que indicarían sólo un retraso en la maduración de estos sistemas. De cualquier forma, el que haya retrasos indica que el aprendizaje y la capacidad cognitiva también está retrasada. Estos retrasos pueden tener consecuencias sociales que impidan que el niño se adapte a los grupos de su interés.
En los adolescentes, que son quienes más consumen marihuana, el cannabis promueve que los axones generen conexiones con neuronas que no deberían, haciendo que se presenten lo que llamamos conexiones aberrantes35. De hecho, se ha mostrado que la marihuana produce conexiones aberrantes en los jóvenes que han fumado marihuana antes de los 20 años36, así como una reducción en su volumen cerebral6.
LA MARIHUANA Y LA COGNICIÓN
Se ha mostrado que los endocannabinoides participan en las funciones que llamamos ejecutivas37, por ejemplo, la anandamida participa en la regulación de la toma de decisiones. La memoria de procedimiento está también regulada por los endocannabinoides en las ratas38,39y en humanos40; la memoria espacial, que es la que nos ayuda a saber hacia dónde dirigirnos, como cuando queremos ir, por ejemplo, de una parte de la ciudad a otra41, además de la memoria de trabajo, que es aquella que nos permite mantener y reorganizar información para poder cumplir con una conducta orientada por objetivo42.
Se ha mostrado que consumidores de marihuana que iniciaron desde los 14-18 años y llevaban alrededor de 9-11 años consumiéndola diariamente, tenían problemas con sus funciones ejecutivas7. Tenían además alrededor de 2 puntos menos en el CI, en relación con los no usuarios de marihuana u otra sustancia de abuso (figura 7).

Figura 7. En esta figura se ilustra que el uso de marihuana antes de los 18 años, con una frecuencia igual o mayor a una vez a la semana, reduce el coeficiente de inteligencia (CI) en los adultos (en este estudio de edad de 38 años). El cero indica el CI del sujeto cuando era niño (9-11 años). Las 2 primeras evaluaciones ilustradas se hicieron entre las edades de 18 y 32 años, mientras que la última se hizo a los 38 años. Se observa que los que redujeron su CI a los 38 años tuvieron el diagnóstico de dependencia a marihuana al menos en 3 de las entrevistas
Asimismo, se ha mostrado que aquellos jóvenes que consumían marihuana alrededor de 12 veces a la semana tenían un CI con alrededor de 5 puntos por debajo de los no usuarios43 (figura 8). Además, su velocidad de procesamiento estaba 10 puntos por debajo de los no usuarios. Esto es, eran más lentos para entender lo que se les decía o preguntaba. Los bajos consumidores (1.4 veces a la semana) no presentaron cambios en el CI.

Figura 8 Esta gráfica ilustra que los sujetos que se incluyeron en este estudio y que desarrollaron dependencia a marihuana ya tenían un coeficiente de inteligencia (CI) menor a aquellos que no desarrollaron dependencia a marihuana. Además, sugiere que la marihuana les reduce aun más el CI.
Otros estudios han documentado que la marihuana afecta la capacidad de atención y memoria y otras funciones ejecutivas, como reducción en el autocontrol con el consecuente aumento de la impulsividad44,45. Estas conductas desadaptativas se acompañan de hipo-funcionalidad, en áreas cerebrales como el lóbulo temporal además de reducción en el tamaño de los hipocampos y de las amígdalas46, relacionado con la memoria e hipofunción y reducción del grosor de la corteza prefrontal47, relacionada con la toma de decisiones, la atención y el autocontrol. Otras áreas del cerebro se reportaron afectadas también, como el tálamo48.
Se han estudiado las funciones ejecutivas, que ya definimos antes: memoria, velocidad de procesamiento de la información, razonamiento perceptual y la comprensión verbal, en sujetos cuando tenían una edad entre 8 y 13 años y no usaban sustancias de abuso de ningún tipo9y que fueron seguidos a lo largo de los años, hasta que cumplieron 38 años y fueron evaluados a los 18, 21, 26, 32 y 38 años.
Las evaluaciones incluyeron el uso de sustancias de abuso y la dependencia a la marihuana. Los resultados mostraron que aquellos sujetos que cumplieron los criterios de uso persistente de marihuana o dependencia, en al menos 3 evaluaciones, mostraron una importante caída en las mediciones de inteligencia de hasta 6 puntos. Es importante señalar que los afectados fueron todos aquellos usuarios que empezaron el uso de marihuana antes de los 18 años. Cuando se evaluó el efecto en aquellos que empezaron el consumo de marihuana después de los 18 años no se detectaron cambios en el nivel de inteligencia.
Este apartado muestra que el uso de marihuana afecta los procesos cognitivos y es posible que reduzca la inteligencia cuando se consume durante la adolescencia.
Desde el punto de vista práctico, la pregunta es si este efecto tiene alguna consecuencia en la vida del usuario. Stiby y col.49estudiaron 1,155 sujetos que tenían 16 años y que utilizaban marihuana desde los 15. Se les evaluó de acuerdo con lo que en el Reino Unido llaman el Certificado General de Educación Secundaria. Los aspectos que evaluaron fueron inglés y matemáticas. Aquellos adolescentes que no consumían marihuana obtuvieron 70.77 de 100 en inglés y 69.54 en matemáticas. Aquellos estudiantes que consumían marihuana 1 o 2 veces al mes obtuvieron 71.0 en inglés y 65.71 en matemáticas, y los que consumían al menos 1 vez a la semana obtuvieron 64.83 en inglés y 62.64 en matemáticas. Además, de los estudiantes evaluados que no fumaban marihuana, 1.18% abandonaron la escuela; mientras que de aquellos que fumaban 1 o 2 veces al mes, 2.3% abandonaron la escuela. De los que fumaban al menos una vez a la semana, 7.52% abandonaron la escuela. Otro estudio en Nueva Zelanda mostró que la probabilidad de obtener un grado universitario y el ingreso económico al alcanzar los 25 años de edad, disminuye en función de la cantidad de veces que se consumió marihuana entre los 14 y 21 años; mientras que la probabilidad de estar desempleado y de vivir dependiente de asistencia social aumenta50; igualmente, se observó un declive en la satisfacción en la vida y en la calidad de las relaciones con otros en función de la cantidad de ocasiones de uso de cannabis 50.
LA MARIHUANA Y LA PSICOSIS
Se ha documentado51que sujetos que presentaron su primer periodo de psicosis a los 23 años, fumaban marihuana entre 3 veces al mes hasta diariamente. Mientras que otros pacientes que no fumaban marihuana, presentaron su primer periodo de psicosis a los 28 años. Es decir, hubo una diferencia de aproximadamente 5 años. La psicosis, evaluada por la escala de síntomas positivos y negativos no difirió entre los 2 grupos, siendo la única diferencia, entonces, el momento de aparición del primer brote.
En otros estudios se ha estimado que la marihuana acelera la aparición de síntomas del espectro de esquizofrenia en 7.5 años, mientras que al trastorno bipolar lo acelera en 9 años. Ésta es una estimación que sugiere que una persona que tiene una vulnerabilidad para padecer esquizofrenia o trastorno bipolar, si fuma marihuana reduce el tiempo de vida sin síntomas en 7.5 y 9 años, respectivamente.
Estos estudios reseñados aquí y muchos otros que hay en la literatura científica indican que la marihuana no produce psicosis, pero si acelera su aparición. Lo mismo parece ocurrir con el trastorno bipolar52.
LA MARIHUANA, LA DEPENDENCIA Y EL USO DE OTRAS DROGAS
La marihuana se consume porque hace sentir bien al sujeto53. Esta sensación agradable se acompaña de la integración a un grupo, pero, adicionalmente a ello, mejora la percepción de algunos estímulos como los alimentos, ya que los perciben más sabrosos. También cierto tipo de música resulta más agradable, y a algunas mujeres usuarias las hace sentir erotizadas.
En nuestro laboratorio hemos mostrado que las ratas a las que les administramos oleamida, un eCBs, tienen un patrón de conducta sugerente de placer.
Haney54mostraró que la marihuana produce dependencia, ya que el periodo de abstinencia se acompaña de un intenso deseo de consumirla, ansiedad, irritabilidad y dolor de estómago, así como falta de apetito e insomnio. Estos datos y el de otros grupos55han sido contundentes para que se incluyera una guía para diagnosticar el síndrome de abstinencia a la marihuana. De hecho, el Diagnostic and Statistical Manual of Mental Disorders(DSM-V)56ya incluye los criterios para el diagnóstico de dependencia a marihuana.
En nuestro laboratorio hemos evaluado la presencia del síndrome de abstinencia en ratas, después de 15 días de una administración diaria de 2 cannabinoides sintéticos, por separado. Otros investigadores57han mostrado que el síndrome de abstinencia también se presenta en ratones.
En resumen, podemos decir que definitivamente la marihuana provoca dependencia, ya que produce su búsqueda y síndrome de abstinencia, y que puede facilitar la ingestión de cocaína, de metaanfetamina, alcohol, nicotina y otras drogas.
EL LADO BRILLANTE DE LA MARIHUANA
Algunas de las propiedades terapéuticas de la marihuana han sido conocidas empíricamente, por lo menos desde hace 2 mil años. Se han encontrado restos de hojas y de semillas de marihuana junto a un esqueleto humano en China, que tiene al menos 10 mil años de antigüedad. Tales hallazgos sugieren un uso ritual de la marihuana.
Información anecdótica adicional indica que la marihuana ha sido usada como una ayuda médica para curar o controlar diversos síntomas de enfermedades, como inflamación, pérdida del apetito, náusea, diarrea, constipación y otros trastornos digestivos; asimismo, para el control de enfermedades como ansiedad, depresión y psicosis, y también para la fatiga y el insomnio. La marihuana y el THC han sido usados para reducir la presión intraocular alta, como ocurre en el glaucoma, y también para controlar el asma y el dolor. Estos estudios son anecdóticos porque no usan el método científico para evaluar los efectos, por lo que varios de estos pueden ser consecuencia de un efecto placebo. Por otro lado, se considera que el THC no es más eficiente que otros fármacos para el tratamiento de diferentes condiciones patológicas. Sin embargo, se requieren estudios controlados para hacer estas comparaciones.
A pesar de la potencial utilidad médica que pueden tener los principios activos de la marihuana, la investigación es pobre debido a las restricciones de tipo legal. Aunque actualmente estamos viviendo el proceso de su permiso legal para su uso médico y para la investigación científica, asimismo para su uso controlado con fines recreativos. Esta condición, abre la posibilidad de estudiar científicamente sus compuestos de manera legal y, por lo mismo, sus propiedades potencialmente útiles en medicina.
En entrevista, 953 personas usuarias de marihuana con fines medicinales en Estados Unidos refieren que la requieren para controlar el dolor, la ansiedad, la depresión, la pérdida del apetito o el insomnio58. Cerca de 75% prefieren fumarla y algunos beberla como té. La mayoría la consume alrededor de 6 veces al día. Además, cerca del 60% de los casi mil entrevistados declararon cultivar su propia planta.
En México, hasta el año pasado, estaba fuera de consideración el que un médico utilizara abiertamente la marihuana como un arma terapéutica, como utiliza los demás medicamentos del arsenal médico.
Con todo, la ciencia siempre busca la simplificación. Así que, como hemos visto que los principios activos como el THC y el cannabidiol son los que están haciendo los efectos terapéuticos, creemos que es mejor aislarlos y quesean los que utilice la medicina. Cabe mencionar que además de estos compuestos, existen otros canabinoides aislados de la planta que pueden tener aplicación terapéutica y que, al igual que el CBD, no producen adicción, que es el efecto colateral por el que el uso del THC esta limitado.
Esta estrategia reduce la probabilidad de ocurrencia de los efectos indeseables y tóxicos que el paciente puede experimentar con la marihuana, y que no podamos controlarlos eficientemente. Además, una vez aislados, los podemos dosificar y determinar la dosis efectiva para cada caso. En este apartado revisaremos los estudios que se han hecho por diversos científicos con las moléculas extraídas de la marihuana, con algunas de origen sintético o con los endocannabinoides. A todos en conjunto los llamaremos cannabinoides.
LOS CANNABINOIDES Y EL DOLOR
Las hojas de marihuana puestas en alcohol las han utilizado algunas personas para mitigar dolores articulares. Ha sido un “remedio”, no muy popular pero utilizado con alguna frecuencia. No hay estudios controlados sobre su efectividad, pero, como también mencionamos en la introducción, es posible que algunos remedios o medicamentos no produzcan un efecto farmacológico sino un efecto fisiológico al cual llamamos “efecto placebo”.
Si la marihuana produce un alivio del dolor por un efecto placebo, entonces debemos considerar no usarla por sus potenciales efectos adversos. La certidumbre de que la marihuana y no el efecto placebo es la que produce el alivio sólo la darán los estudios científicos controlados.
Actualmente en Canadá están usando algunos cannabinoides sintéticos (nabilona) para tratar el dolor crónico no asociado al cáncer59.
LOS CANNABINOIDES Y EL CONTROL DE LA ANSIEDAD
A pesar de que hay diversos ansiolíticos disponibles en el mercado, desde valeriana y antihistamínicos, hasta las famosas benzodiacepinas, la posibilidad de que los cannabinoides sean utilizados como ansiolíticos existe.
Los experimentos que hemos hecho en nuestro laboratorio y los que han hecho otros investigadores en el mundo han mostrado que los fármacos sintéticos que activan al receptor CB1 reducen, e incluso hacen desaparecer, la ansiedad, en animales de experimentación60. Con todo, activar el sistema de eCBs en personas ansiosas puede producir un efecto benéfico que propiciará que el paciente pueda llevar una vida más productiva.
LOS CANNABINOIDES Y EL SUEÑO
Los estudios hechos en nuestro laboratorio con animales de experimentación han mostrado que facilitar la acción de los eCBs por medios farmacológicos tiene como resultado un aumento del sueño, especialmente en las fases profundas, que son las que parecen ser más importantes para el cerebro. La mayoría de los fármacos en uso médico no producen estas fases de sueño. Todas las sustancias que hemos usado son eCBs como la oleamida, la anandamida y el 2-AG, y producen sueño profundo61.
Se ha mostrado que utilizar compuestos que incluyen THC y canabidiol (CBD) combinados aumentan el sueño62. Estas presentaciones se han usado en humanos y se administran por medio de atomizadores por la vía oral. El único punto controversial es que los humanos eran pacientes que sufrían de esclerosis múltiple o dolor crónico intratable. Nos queda por mostrar que los cannabinoides en realidad facilitaron el sueño, porque es posible que los pacientes se hayan dormido porque ya no tenían dolor.
LOS CANNABINOIDES Y LA EPILEPSIA
La Organización Mundial de la Salud (OMS) indica que 30% de los pacientes que sufren epilepsia no tienen tratamiento porque son refractarios a los fármacos existentes.
Por ello, existe una imperiosa necesidad de desarrollar tratamientos que controlen la enfermedad en estos pacientes y se han puesto los ojos en los cannabinoides. Al principio se generaron experiencias anecdóticas, que no fueron estudios rigurosamente científicos, que sugirieron que la marihuana es capaz de producir un efecto benéfico en los pacientes con epilepsia, lo que se ha intentado comprobar a nivel científico.
El ejemplo más notorio es el de la niña Charlotte, tratada por el doctor Alan Eugene Shackelford, un internista de Colorado, que a pesar de no tener gran experiencia en neurología en general y epilepsia en particular, decidió tratar a Charlotte con un extracto de marihuana que contenía CBD en alta concentración. El tratamiento con CBD redujo las crisis de 300 a la semana a una al mes. Shackelford tomó la idea de administrar CBD de un estudio hecho por el grupo de Mechoulam63, los cuales mostraron que 8 pacientes con crisis epilépticas generalizadas, secundarias a un foco epiléptico en el lóbulo temporal, respondían al tratamiento con CBD. Cuatro de los pacientes tratados con este fármaco redujeron importantemente las crisis, mientras que 4 más mostraron una mejoría parcial. Lo que oscurece un poco este trabajo es que uno de los pacientes tratados con píldoras de azúcar también mejoró de manera notable.
Regresando al tratamiento de Charlotte, hay antecedentes científicos que auguraron éxito en este tratamiento64, lo que parece que resultó, motivando de esta manera gran demanda del público por este tratamiento. Esperemos que en la próxima década haya una gran cantidad de investigación sobre los efectos del CBD en epilepsia.
El CBD es uno de los 400-500 compuestos que la cannabis sintetiza. Además, se ha observado que no todas las variedades de marihuana fabrican la misma cantidad de CBD naturalmente; sin embargo, se pueden generar variedades que aumenten la producción de este compuesto.
Es importante recordar que hay diferentes tipos de epilepsia y que sólo algunas parecen responder al CBD, entre ellas el síndrome de Lennox-Gastaut y el de Dravet. Ello nos indica que la epilepsia se genera a través de diversos mecanismos, algunos de ellos controlables con CBD.
Actualmente, ya se dispone de un preparado a base de CBD que fabrica el laboratorio GW Pharmaceuticals y cuyo nombre comercial es Epidiolex. No está aprobado en ningún país del mundo, pero se está probando en niños con epilepsia intratable. Hasta ahora se ha reportado una reducción del 39% de las crisis epilépticas en los pacientes que han recibido Epidiolex. Sin embargo, la doctora Devinsky, quien está dirigiendo el estudio, ha reportado que al menos el 50% de los pacientes ha manifestado complicaciones graves. Entre éstas, algunos pacientes han desarrollado estado epiléptico que significa que el paciente tiene una convulsión seguida de otra, hasta que no se le intervenga terapéuticamente65,66. Si por alguna razón no se le atiende, el paciente puede morir.
Se han reportado67los efectos protectores de la cannabidivarina, uno de los compuestos de la cannabis, sobre la epilepsia inducida experimentalmente en ratas y ratones. De esta manera se incluye a este compuesto dentro del potencial arsenal médico para el tratamiento de la epilepsia68.
LOS CANNABINOIDES Y LAS ADICCIONES
Como se menciona en otro apartado, los eCBs participan en promover la sensación subjetiva de recompensa. Así, mientras la dopamina hace buscar el reforzador (“quiero” o “deseo”), los eCBs permiten disfrutar de consumirlo (disfrute o goce). En este contexto, parece que todas las drogas, a fin de cuentas, activan al sistema de eCBs para inducir sus efectos placenteros. Esto sugiere que, si se bloquea este sistema, la búsqueda de drogas desaparecerá, o al menos se reducirá.
También se ha mostrado69que el rimonabant, un fármaco desarrollado para bloquear al receptor CB1, provoca que una rata que se ha expuesto a la nicotina y que ahora la busca, deje de hacerlo. Lo mismo pasa con la cocaína70,71.
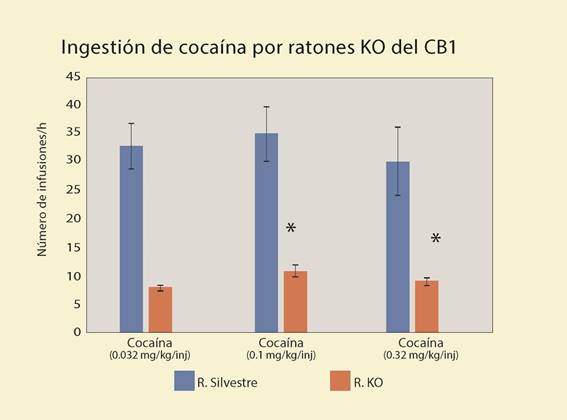
El bloqueo del receptor CB1 también reduce la búsqueda de metanfetamina72, de morfina73y de heroína74,75. Por otro lado, el CBD ha mostrado que reduce la búsqueda por fármacos tan poderosos como la morfina y la cocaína76,77 (figura 9).

Figura 9 La ausencia de receptor CB1 en los ratones knock out (KO) reduce importantemente la búsqueda de cocaína y otras drogas.
También, puede reducir la búsqueda de opioides, cocaína y tabaco en animales y en humanos (para una revisión ver el estudio de Prud’homme et al.78). Aún la información es escasa, pero todos los estudios apoyan que el CBD puede ser una herramienta farmacológica para apoyar a los pacientes que se quieren retirar del uso de drogas.
LOS CANNABINOIDES Y OTRAS ENFERMEDADES
Estas moléculas han mostrado tener algún efecto médico en otras enfermedades que, por el límite de páginas permitido en esta revisión, no se comentará, como son los trastornos del control motor, el cáncer79 y el glaucoma, entre otras.
QUÉ HACER SI YA NO QUIERO CONSUMIR MARIHUANA Y NO PUEDO DEJARLA
Frecuentemente se escucha que México no está preparado para lidiar con los pacientes que abusan de sustancias, que no está preparado para permitir el uso controlado de la marihuana.
Normalmente, la gente utiliza esta expresión para descalificar el potencial uso controlado de la marihuana, pero, en realidad, la medicina mexicana cuenta con estrategias farmacológicas y psicoterapéuticas para facilitar la rehabilitación del usuario que quiera hacerlo. No obstante, hay algo de razón cuando dicen que no estamos preparados. Por ejemplo, si todos los usuarios no sólo de marihuana, sino de cualquier sustancia de abuso, se quisieran rehabilitar, entonces queda claro que la medicina no tiene la capacidad para atender un número tan alto de solicitudes. No se tiene el suficiente personal preparado, ni los sistemas de diagnóstico ni los sitios físicamente acondicionados para recibir a los pacientes.
En ese sentido, estamos de acuerdo en que no estamos preparados; pero no desestimamos que sí hay sitios a los que el usuario puede acudir y rehabilitarse. Hoy por hoy, los Centros de Integración Juvenil (CIJ) son una alternativa. También están los Centros de Atención Primaria en Adicciones (CAPA), El Instituto Nacional de Psiquiatría “Dr. Ramón de la Fuente Muñiz”, El Hospital Psiquiátrico “Fray Bernardino Álvarez”. Asimismo, la UNAM tiene un Centro de Prevención y Atención de Adicciones, dependiente de Facultad de Psicología. También la Facultad de Medicina tiene la Clínica de Atención Integral para las Adicciones, en el Departamento de Psiquiatría y Salud Mental.
Hay otras instituciones dedicadas exclusivamente al estudio de las adicciones y a orientar al usuario que lo necesita, como el Instituto para la Atención y Prevención de las Adicciones (IAPA) de la Ciudad de México, la Comisión Nacional contra las Adicciones (CONADIC), El Centro Nacional para la Prevención y el Control de las Adicciones (CENADIC).
Hay diversas instituciones privadas que ofrecen el servicio, desafortunadamente a un costo muy elevado.
Regresando a la falta de preparación que tiene el país para investigar, prevenir, informar y tratar a los pacientes, es sólo cierto en el sentido de que necesitamos hacer más y si ahora no se hace todo lo mencionado es por falta de presupuesto y permisos legales que nos permitan a los investigadores usar las sustancias para investigar sus efectos benéficos y dañinos.
En el presente, el usuario de marihuana o de cualquier otra droga ilegal, es visto como delincuente.
Una parte de los usuarios es adicta, sí, y necesita atención médica. Puede ser que también sea impulsivo y agresivo, pero como todo ello es parte del síndrome, aún sigue siendo un paciente con derecho a atención médica. Esperemos que así sea.
CONCLUSIÓN
Legalizar no sólo la marihuana, sino todas las sustancias de abuso, aumenta el riesgo de tener más usuarios y, por lo mismo, más pacientes adictos. Sin embargo, legalizar su investigación e incluso facilitarla haciendo los trámites de solicitud de permisos más expeditos y dando apoyo económico para investigarlas, no solamente permitirá tener conocimiento para prevenir el uso o rehabilitar al dependiente, sino también para entender los mecanismos que se activan en el cerebro, ya que éste tiene sistemas sensibles a ellas. Usando las dosis efectivas que la investigación científica puede determinar, el aspecto satánico de las drogas puede domesticarse y utilizarse con fines terapéuticos.
Las drogas, entonces, se pueden ver como una fuente de fármacos que faciliten el bienestar del humano.











 nueva página del texto (beta)
nueva página del texto (beta)