ANTECEDENTES HISTÓRICOS
Las primeras menciones de la enfermedad infecciosa llamada esporotricosis, se hicieron a principio de siglo XIX. El aislamiento del agente causal de la esporotricosis fue obtenido en 1896 por B.R. Schenck, quien cursaba sus estudios de medicina en el Hospital John Hopkins, en Baltimore, Estados Unidos. En los años posteriores, el hongo recién descrito se consideró como un basidiomiceto del género Sporotrichum. Durante la década siguiente, entre Hektoen y Perkins (1900), quienes nombraron por primera vez al hongo Sporothrix schenckii, y De Beurmann y Gougerot (1911), surgen controversias acerca de la pertenencia del hongo a los basidiomicetos. Fue hasta 1962 que Carmichael y otros grupos de investigadores demostraron que el hongo no es un basidiomiceto, sino un representante de phylum Ascomycota1,2.
En México, Gayón y Aguirre-Pequeño publicaron los primeros casos en 1913, y actualmente en nuestro país, la esporotricosis es considerada como la micosis subcutánea más frecuente. Los estados más afectados son Ciudad de México, Puebla, Jalisco, Michoacán, Estado de México y Guanajuato3,4,5.
ECOLOGÍA
Los organismos de género Sporothrix forman parte del sistema saprofítico natural y son ubicuos en el medio ambiente. Hasta la fecha no se han descrito las formas sexuales de este hongo, por lo que es considerado anamorfo. Los estudios moleculares actuales sugieren que Sporothrix schenckii y otros representantes del complejo pueden tener su contraparte sexual entre hongos de la familia Ophiostomataceae6,7.
En 2018, de Beer y cols. propusieron y demostraron diferencias entre los géneros Sporothrix y Ophiostoma a través de estudios filogenéticos1. Hasta el día de hoy, no se conoce el morfotipo sexual de los hongos del complejo Sporothrix.
La división taxonómica actual hace referencia a 2 clados: ambiental y clínico o patogénico, basándose en la taxonomía y ecotopología1,8.
Algunas especies de Sporothrix pertenecen al grupo de patógenos primarios de animales, insectos y plantas. Entre estas se encuentran especies Sporothrix bien caracterizadas, pero también existen otras crípticas, con un potencial patogénico que requiere de estudios más profundos. Las especies S. schenckii, S. brasiliensis, S. globosa y S. lurei y, recientemente, S. mexicana y S. chilensis, han sido asignados al clado clínicamente relevante1,9,10, y forman parte de complejo S. schenckii.
Además de estudios taxonómicos, es importante resaltar que la biología de hongos-patógenos es fuertemente asociada a regiones tropicales específicas.
BIOLOGÍA DE SPOROTHRIX SCHENCKII
Sporothrix schenckii es un hongo dimórfico, lo cual quiere decir que puede manifestarse en 2 formas diferentes dependientes de la fase de vida libre o parasitaria.
En medios de cultivo artificiales o en la naturaleza,a temperaturas alrededor de 25 oC, el hongo se desarrolla en forma micelial, formada por hifas y conidios. Los medios de cultivo microbiológicos permiten imitar la reproducción asexual del hongo. Así, el cultivo de S. schenckii en condiciones de laboratorio a 20-25 oC, resulta en colonias filamentosas planas, de aspecto húmedo, blancas, oscuras o mixtas, a veces con una superficie estriada11 (figura 1). En el estudio microscópico de esta fase filamentosa, se observan hifas delgadas con un diámetro de 1-2 mm, septadas, con conidios hialinos, redondos, piriformes o triangulares, generados por un mecanismo simpodial, de pared gruesa, dispuestos sobre la hifa conidiógena o surgiendo desde conidióforos simples (figura 2). Con el tiempo, los cultivos pueden presentar una coloración oscura, característica que distingue la especie S. schenckii de las especies no patógenas2 (figura 3).
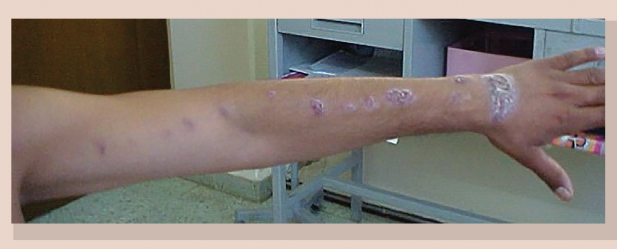
Foto: Dra. Yolanda Romo Lozano
Figura 1 Esporotricosis linfangítica en extremidad superior, constituida por diversos nódulos siguiendo el trayecto de los vasos linfáticos

Foto: Dr. Luis Javier Méndez Tovar
Figura 3 Examen microscópico de exudado de lesiones de esporotricosis. Se aprecian numerosas levaduras de Sporothrix redondas, algunas de ellas en proceso de gemación.
Cuando S. schenckii es desarrollado en medios de cultivo enriquecidos y a temperatura entre 35 y 37 °C, la forma micelial se transforma en la forma de levaduras. Los sustratos enriquecidos en nutrientes como la infusión cerebro-corazón (BHI), el agar sangre o altas concentraciones de glucosa, favorecen la transformación a levadura. Las levaduras llegan a medir de 2-6 mm y pueden desarrollar gemaciones únicas o múltiples. Los estudios de microscopia electrónica revelan la transición a estado de levadura a partir de la hifa: cercana a un septum, surge una gema en la posición media o terminal de la hifa sin aparente alteración a nivel de citoplasma celular, sin que el conidio origine la levadura12.
Una vez parasitados los tejidos, el hongo se expresa y parasita los tejidos exclusivamente como levadura (figura 4).
FACTORES DE VIRULENCIA
Los factores de virulencia son aquellas moléculas o estructuras morfológicas de los hongos que les permiten permanecer y proliferar dentro del organismo parasitado. Las moléculas de la pared fúngica son las primeras en interactuar con las células del hospedero. La quitina de Sporothrix spp. es el componente menor en las 3 formas de vida de hongo: hifa, espora o levadura, mientras que la b-glucanas y ramnomananas son las más abundantes9. La presencia de varios azúcares como manosa, ramnosa y galactosa caracteriza la pared celular de los hongos del complejo S. schenckii, y, en especial, la L-ramnosa asociada a péptido, tiene probables propiedades antigénicas13. Las glicoproteínas y las rutas biosintéticas de glicosilación proteica de Sporothrix están actualmente sujetas de diversos estudios. Las especies más virulentas como S. brasiliensis y S. schenckii, contienen en su genoma 9 y 10 genes respectivamente, que codifican para quitinasas, cuyo papel en la patogénesis no ha sido aún aclarado9.
La melanina y proteínas como adhesinas, así como glicoproteína, también son consideradas como factores de virulencia. La producción de melanina por Sporothrix spp. depende de la concentración de glucosa en el medio de cultivo14 o compuestos fenólicos como 3,4-dihydroxy-L-phenylalanine (L-DOPA)2, y protege al microorganismo de ser fagocitado15.
Otro factor de virulencia son las integrinas y adhesinas del hongo, que reconocen la matriz extracelular de la epidermis y, en particular, la fibronectina, laminina y colágeno tipo II16,17. Recientemente una glicoproteína de 70 kDa (Gp70) fue reconocida como un nuevo factor importante para la adherencia18.
El peróxido de ergosterol, enzimas proteolíticas, catalasas, péptidos asociados a ramnomananas, lípidos y la capacidad de formar biopelículas, también son parte de factores de virulencia, pero han sido menos estudiados en comparación con las moléculas anteriormente mencionadas.
RESPUESTA INMUNE
La respuesta inmune hacia S. schenckii y S. brasiliensis ha sido la más estudiada debido a la mayor frecuencia con que son aisladas estas especies en humanos y otros animales. En la respuesta inmune innata se enfatiza la activación del complemento de ambas vías (clásica y alternativa), y la participación de TLR4 en el reconocimiento de componentes lipídicos considerados como posibles patrones moleculares asociados a patógenos (o PAMP, por sus siglas en inglés) de origen fúngico19,20.
La respuesta inmune celular de tipo Th1 es considerada como principal en el control de la actividad patogénica del microorganismo y manifestaciones clínicas relativamente benignas. La respuesta Th1/Th17 se relaciona con la actividad de células dendríticas e instalación del inflamasoma, que controla la limitación del patógeno en las infecciones cutáneas y subcutáneas21,22. La exacerbación y curso clínico complicado es atribuido a la respuesta de tipo Th2. Las inmunodeficiencias desarrolladas a causa de infecciones o enfermedades crónicas, pueden causar diseminación distémica de hongo, con una grave afectación de órganos internos y fungemia.
EPIDEMIOLOGÍA
La esporotricosis puede ser adquirida a consecuencia de traumatismo con pérdida de continuidad de la piel asociado a la contaminación con cualquier material orgánico u objeto que contenga al hongo y, eventualmente, por arañazo o contacto con los gatos-portadores23, la mordedura de artrópodos, armadillos, ardillas, víboras, aves o peces, entre otros8.
Los casos asociados a la inhalación de conidios de Sporothrix spp. y en consecuencia el desarrollo de la enfermedad pulmonar y/o diseminada, también han sido reportados en la literatura médica, pero son poco frecuentes.
Las personas ocupacionalmente expuestas (POE), relacionadas con las actividades agronómicas como colectores de heno, los comerciantes de materiales como madera o plantas, jardineros, etc., son las que forman parte relevante y más conocida de la epidemiología de esporotricosis. Aunque el hongo se encuentra en el medio ambiente y puede tener una interacción constante con el humano, la incidencia de infección relacionada con actividades de tipo ocupacional, es baja en las personas inmunocompetentes. En las 2 últimas décadas la esporotricosis ha sido considerada como una enfermedad zoonótica emergente debido a 1,503 gatos reportados como portadores de S. schenckii2,24,25. Otros mamíferos, roedores, perros, armadillos e insectos, han sido diagnosticados como portadores generalmente asintomáticos de Sporohtrix sp. y han sido considerados en la transmisión zoonótica de patógena a humanos a través de mordedura y/o contacto abrasivo26.
PATOGÉNESIS Y FORMAS CLÍNICAS DE LA ESPOROTRICOSIS
Un factor importante en la evolución clínica de la esporotricosis es el tamaño de inóculo y la profundidad con la cual se depositan los conidios del hongo en el tejido del hospedero2.
Existen 3 principales formas clínicas en esporotricosis de acuerdo a la localización de la lesión: la cutánea, mucocutánea y extracutáneas. En la forma cutánea, el menor traumatismo en la epidermis puede ser el motivo de entrada de esporas e hifas infectantes, las cuales, al ser introducidas, no tardan en sufrir el cambio dimórfico, es decir, convertirse en levadura. El hongo, ahora en su fase levaduriforme, puede permanecer en el sitio de entrada o diseminarse a otros sitios siguiendo los vasos linfáticos (figura 5). La primera forma clínica corresponde a la forma cutánea fija o localizada, mientras que la segunda corresponde a la forma linfocutánea o linfangítica.

Figura 5 Aspecto microscópico de Sporothrix schenckii crecido en agar papa dextrosa, en el que se observan abundantes conidios redondos, hialinos, algunos formando la típica distribución en “flor de durazno” originadas por un mecanismo simpodial (100x).
La forma cutánea fija inicia como una lesión de tipo pápula o pústula, posteriormente se forma un nódulo subcutáneo. El nódulo se reblandece, se convierte en goma, se ulcera y secreta contenido purulento. Esta forma clínica se caracteriza por una sola o pocas lesiones cerca del sitio de inoculación.
Lesiones pueden ser ulcerativas, con bordes eritematosos o tener aspecto vegetativo, verrugoso, de tipo placa infiltrada y sin participación de las vías linfáticas. Las lesiones de tipo linfangítico se presentan en un 70% de los individuos infectados por Sporothrix spp., en quienes aparecen nuevas lesiones que siguen la circulación linfática regional y constituyen la forma linfangítica2.
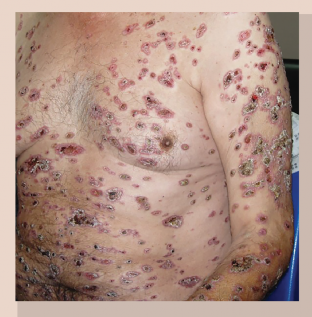
La forma cutánea diseminada puede tener diferentes componentes: lesiones linfangíticas y lesiones cutáneas no contiguas (figura 6). Las lesiones en las mucosas de pacientes, son otra forma de esporotricosis cutánea. Se sospecha auto-inoculación a partir de una lesión cutánea previa, una probable diseminación hematógena o, eventualmente, entrada de conidios del hongo por vía aérea y su diseminación a las mucosas27.

Foto: Autoras del artículo
Figura 6 Aspecto microscópico de Sporothrix schenckii crecido en agar harina de maíz, en el que se intensifica la producción de pigmento de los conidios (100x).
Las formas diseminadas de esporotricosis son difíciles de diagnosticar e inciden con el desarrollo de la enfermedad por inmunodeficiencia primaria, como la infección por VIH-sida. La vía de diseminación es hematógena, con afectación de piel y tejido óseo. Los individuos con alcoholismo, inmunodepresión por corticoides u otras causas de inmunosupresión idiopática, pueden desarrollar formas de esporotricosis pulmonar, con sintomatología que semeja la tuberculosis. La forma diseminada con el involucramiento del tejido osteoarticular es especialmente importante en los individuos con respuesta inmune debilitada o ausente.
DIAGNÓSTICO
El diagnóstico de laboratorio se basa en el estudio micológico. Un primer procedimiento es el examen directo del exudado de las lesiones o del líquido de lavado bronquioalveolar cuando se sospecha de una esporotricosis pulmonar. Este material se procesa con hidróxido de potasio (KOH) y se observa al microscopio, o puede hacerse un frotis y teñirse con Gram, Giemsa o PAS. Una tinción más específica para hongos es la de plata-metenamina (Gomori-Grocott). En este estudio se debe buscar la forma de levadura del hongo.
El procedimiento considerado el estándar de oro en el diagnóstico de la esporotricosis es el cultivo del material obtenido de las lesiones, secreciones, pus y/o tejido. Estos materiales pueden ser inoculados en agar-dextrosa Sabouraud con gentamicina o cloranfenicol, o agar Mycosel con cicloheximida, para obtener fase micelial del hongo. Si se desea recuperar la fase levaduriforme, esta se logra en medio agar infusión cerebro-corazón incubado a 37 °C8. En el agar-dextrosa Sabouraud generalmente se desarrollan colonias de aspecto húmedo, membranosas, de color blanco o pigmentadas. En los últimos años, ha sido más frecuente observar colonias de aspecto velloso. Microscópicamente se aprecian conidios redondos u ovoides, hialinos o pigmentados, que nacen directamente de la hifa, en conidióforos cortos o largos, tomando la distribución en forma de “flor de margarita” o “flor de durazno”. La producción de pigmento es estimulada al crecer al hongo en agar-harina de maíz.
Un estudio adicional con menor sensibilidad diagnóstica, es la histolopatología; en general, se observa una escasa distribución o presencia de estructuras levaduriformes en el tejido. La observación del cuerpo asteroide (una representación del fenómeno de Splendore-Hoeppli), constituido por una levadura central rodeada de membranas celulares del hospedero eosinofílicas, aunque no son patognomónicas, sí representan una alta probabilidad diagnóstica de esporotricosis8 (figura 7).

Foto: Dr. Luis Javier Méndez Tovar
Figura 7 Imagen de un cuerpo asteroide (flecha) de hongo Sporothrix observado en un corte histológico teñido con PAS.
Algunos métodos serológicos como ELISA o Western blot, han sido implementados para detectar anticuerpos dirigidos contra SsCBF (S. schenckii Con A-Binding Fraction) en casos de sospecha de esporotricosis cutánea. Otros biomarcadores antigénicos como Gp70 o Gp60, considerados también como factores de virulencia para Sporothrix spp. han sido propuestos28,29.
La aplicación intradérmica del antígeno metabólico de Sporothrix, conocido como esporotricina, es un recurso útil para reforzar el diagnóstico cuando se tiene un caso con lesiones sugestivas de esporotricosis. Se considera positiva una respuesta de induración de 5 mm o más, a las 24 o 48 h después de aplicado este antígeno. Es importante recordar que una respuesta positiva también indica contacto previo con el hongo, no necesariamente infección actual.
Considerando que el hongo forma un complejo de organismos con mayor o menor virulencia, es importante usar métodos moleculares para la identificación de especie a partir del cultivo. Los genes para calmodulina (CAL), b-tubulina (BT2) y factor de elongación 1a (EF-1a), han sido utilizados para la resolución taxonómica de las especies clínicamente relevantes8.
TRATAMIENTO
El tratamiento para la esporotricosis depende esencialmente de la forma clínica y del estado inmunológico del paciente, y los fármacos incluyen principalmente itraconazol, ioduro de potasio (KI), terbinafina y anfotericina B. El ioduro de potasio ha estado en el uso desde 1903 y fue sugerido por Sabouraud. Sin conocer la acción específica de KI sobre las levaduras de Sporothrix, esta sal aumenta la quimiotaxis de los neutrófilos hacia el granuloma, por lo que sigue siendo considerada como el tratamiento de elección. Cuando el KI causa intolerancia en el paciente, el itraconazol es la mejor alternativa; este medicamento inhibe la síntesis de la pared fúngica. Los fungicidas como la terbinafina o la anfotericina B liposomal, se usan cuando hay contraindicaciones del itraconazol, del KI o cuando se trata de una enfermedad diseminada8.
Además de los antifúngicos convencionales, existen terapias alternativas como la crioterapia y el tratamiento fotodinámico; este último se encuentra en fase de investigación experimental e in vitro.
PREVENCIÓN
La transmisión zoonótica es considerada de manera muy importante para al menos uno de los integrantes más virulentos de complejo de Sporothrix: S. brasiliensis. En el manejo de animales domésticos o silvestres se deben seguir las normas de higiene adecuadas, debido a diferentes enfermedades infecciosas relacionadas con estos. La esporotricosis detectada en animales debe ser tratada. El uso de guantes durante el manejo de animales con lesiones típicamente esporotricósicas, es indispensable todo el tiempo y hasta una completa curación del animal en cuestión. Los gatos domésticos infectados deben ser incinerados post-mortem con la finalidad de prevenir un foco infeccioso saprofítico por S.brasiliensis.
Debido a que la esporotricosis es considerada como una enfermedad ocupacional, se recomienda el uso de guantes o ropa con manga larga al realizar actividades relacionadas con el manejo de cualquier material que pudiese herir y contaminar las zonas corporales expuestas.
CONCLUSIONES
La esporotricosis es una micosis subcutánea causada por hongos dimórficos del complejo S. schenckii. Es endémica de México y está considerada como una enfermedad ocupacional debido a las diferentes fuentes de infección. Las formas clínicas más frecuentes en el humano son la forma cutánea fija, la forma linfangítica y la forma diseminada; esta última de mal pronóstico debido a su asociación con inmunodeficiencias. La transmisión zoonótica de la esporotricosis debe considerarse epidemiológicamente relevante.











 nueva página del texto (beta)
nueva página del texto (beta)