INTRODUCCIÓN
La hemorragia subaracnoidea (HSA) es una entidad clínica con fuertes implicaciones negativas para la salud de los pacientes, cuya morbimortalidad aumenta de manera considerable. Se estima que la incidencia a nivel global de la HSA se encuentra en torno a 9-10 casos por cada 100,000 habitantes1,2,3. Los aneurismas intracraneales (AI) son la principal causa de HSA no traumática, representando hasta el 85-98.9% de esta entidad nosológica1. Los aneurismas incidentales se definen como aquellos que son asintomáticos, en pacientes sin historia de HSA. Algunos estudios epidemiológicos sugieren que hasta 5% de la población alberga un AI a la edad de 75.8 años. El hallazgo de AI no rotos de manera incidental mediante resonancia magnética (RM) o tomografía computarizada (TC) es cada vez más común14.
La importancia del diagnóstico oportuno, así como su tratamiento, reside en poder evitar las lesiones tempranas y tardías ocasionadas por HSA, puesto que aproximadamente la mitad de los pacientes fallecen incluso antes de llegar a una unidad hospitalaria y, de los sobrevivientes, un alto porcentaje desarrollará algún tipo de déficit neurológico, ocasionando una importante disminución en la calidad de vida, con un fuerte impacto económico y social1,3,8.
El tratamiento endovascular para AI ha evolucionado sustancialmente y se ha convertido en el tratamiento de elección para diversos tipos de lesiones. A pesar de la enorme evolución en este campo, algunos desafíos permanecen vigentes, como son los aneurismas grandes, gigantes, de cuello ancho y fusiformes, lesiones en las que es difícil lograr una adecuada reconstrucción con otro tipo de dispositivos de tratamiento endovascular como los stents intracraneales autoexpandibles o los Coils7,12.
Los dispositivos diversores de flujo son una generación de nuevos dispositivos utilizados en la terapia endovascular cerebral para tratar AI. Diversos estudios multicéntricos han reportado la eficacia y seguridad de su uso en el tratamiento de los AI7. Actualmente se comercializan distintos tipos de diversores: Pipeline®, FRED® y SILK® son algunos de los más representativos; los dos primeros aprobados por la Food and Drug Administration (FDA) (figura 1). El Pipeline® embolization device (PED) ha sido el más usado alrededor del mundo y sobre el que se tiene mayor experiencia4,9.

Foto: Omar Pichardo Uribe.
Figura 1 Dispositivo diversor de flujo FRED (flow-redirection intraluminal device).
El Pipeline® es un dispositivo autoexplandible, de malla cilíndrica, compuesto de 48 microfilamentos individuales de cromo-cobalto y platino. Con un área de superficie de metal de 30-35% cuando se despliega completamente. Representa el primer dispositivo endovascular diseñado específicamente para funcionar como un dispositivo autónomo en la reconstrucción del vaso parental con enfermedad segmentaria donde se originó el aneurisma10. Debido a la importante cantidad de metal que se implanta en el paciente, es indispensable que se mantenga con doble antiagregación plaquetaria durante 12 semanas, con el fin de evitar que se formen trombos al interior del dispositivo y se genere un infarto cerebral10,13.
En este sentido y con los antecedentes ya comentados, reportamos el caso de dos pacientes con presencia de AI descubiertos de manera incidental, a quienes se les propuso la opción de tratamiento endovascular para prevenir los efectos indeseables de la HSA.
REPORTES DE CASO
Caso 1: Paciente varón de 62 años de edad, quien al realizar sus actividades laborales sufrió traumatismo craneoencefálico con pérdida del estado de alerta y cefalea holocraneana de moderada intensidad. Acudió a la unidad hospitalaria donde se encontró con escala de coma de Glasgow de 15/15. Se realizó protocolo de estudio para descartar presencia de hemorragia intracraneal y no se encontraron datos de HSA; sin embargo, en dicho estudio se evidenció la presencia de un AI en la arteria carotida interna (ACI) izquierda, segmento comunicante (C-VII), por lo que se ofreció tratamiento endovascular con colocación de PED.
Se ingresó a la Unidad de Hemodinamia y Rescate Cerebral del Hospital Regional 1º de Octubre ISSSTE. Se realizó aseo en región inguinal bilateral, se procedió a inyectar 10 cm3 de lidocaína al 2%, se puncionó la arteria femoral derecha con la técnica de Seldinger, se colocó introductor 6 Fr, se canuló de manera electiva la carótida interna izquierda y se colocó PED. Tres meses después del tratamiento se realizó angiografía de control donde se observó la endotelización del segmento C-VII en la ACI izquierda, así como adecuado flujo distal, con oclusión completa del saco aneurismático. Se mantuvo doble antiagregación plaquetaria (clopidogel 75 mg y ácido acetilsalicílico 350 mg) durante 12 semanas. El paciente se encuentra actualmente sin déficit neurológico y se reincorporó a su actividad laboral en 4 semanas. El tiempo de hospitalización desde la intervención hasta su alta fue de 48 h.
Caso 2: Mujer de 59 años de edad que acudió a unidad hospitalaria por presentar antecedentes de parestesias en hemicara izquierda y brazo ipsilateral de manera transitoria con incremento gradual de la intensidad y duración. Se inició protocolo de estudio mediante resonancia magnética. Se evidenció la presencia de dos AI, uno de 15 mm del segmento comunicante de ACI derecha y otro de 4 mm en ACI izquierda, segmento oftálmico (C-VI), por lo que se decidió la colocación de PED (figura 2) con posterior control angiográfico a los 3 meses, donde se observó una adecuada endotelización de la pared arterial y completa reconstrucción del segmento vascular, así como ausencia de sacos aneurismáticos (figura 3 y figura 4), con adecuado flujo cerebral y llenado distal. La paciente se encontró completamente asintomática, escala modificada de Rankin (mRS) 0, con reincorporación a sus actividades habituales 3 semanas después del tratamiento. El tiempo de hospitalización desde la intervención hasta su alta fue de 36 h.
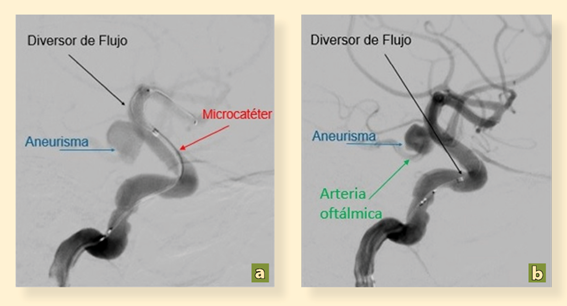
Foto: Omar Pichardo Uribe.
Figura 2 Angiografía con sustracción digital en proyecciones oblicuas de ACI. Despliegue del dispositivo diversor de flujo. a) Se observa microcatéter colocado en extremo distal de ACI (fecha roja), observado flujo y saco aneurismático (flecha azul) localizado en segmento oftálmico de ACI (segmento VI). Se observa despliegue de dispositivo diversor de flujo (flecha negra). b) Se observa saco aneurismático adyacente a arteria oftálmica (flecha verde) con despliegue del dispositivo diversor de flujo ocluyendo la totalidad del origen del aneurisma. Arteria carótida interna (ACI).
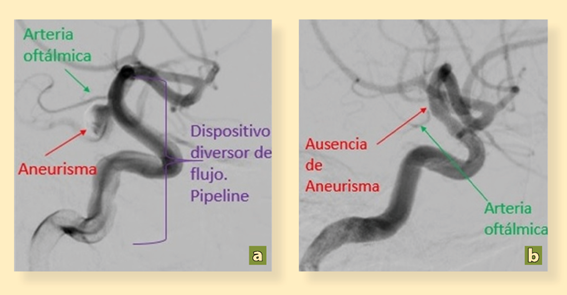
Foto: Omar Pichardo Uribe.
Figura 3 Angiografía con sustracción digital en proyecciones oblicuas. a) Postratamiento inmediato ACI derecha. Se observa dispositivo diversor de flujo desplegado en su totalidad (flecha morada) observado llenado parcial asociado a disminución de flujo en el saco aneurismático (flecha roja) y permeabilidad de rama oftálmica (flecha verde). b) Postratamiento mediato ACI derecha. Angiografía post tratamiento 3 meses después, observando permeabilidad de vasos distales, ausencia de saco aneurismático y endotelización de dispositivo diversor de flujo así como permeabilidad de arteria oftálmica (flecha verde).
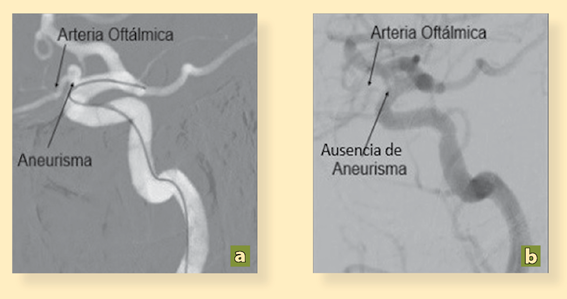
Foto: Omar Pichardo Uribe.
Figura 4 a) Angiografía cerebral pretratamiento ACI izquierda. Angiografía con Road Map, observado microcatéter localizado hacia ACM con presencia de saco aneurismático a nivel de arteria oftálmica. b) Angiografía cerebral postratamiento ACI izquierda. Angiografía con sustracción digital de ACI izquierda observado adecuado flujo vascular distal con ausencia de saco aneurismático, permeabilidad de arteria oftálmica y endotelización de dispositivo diversor de flujo. Arteria cerebral media (ACM).
DISCUSIÓN
Los nuevos dispositivos de terapia endovascular conocidos como diversores de flujo han sido ampliamente utilizados en centros hospitalarios en diferentes partes del mundo con óptimos resultados desde hace 7 años7,10; sin embargo, los primeros casos se realizaron en el 2007. En México, el uso de estos dispositivos inició en el 2013.
Los diversores de flujo ejercen su efecto mediante disrupción de flujo sanguíneo al saco aneurismático (figura 5). Al ser dispositivos densamente trenzados, retienen la mayoría del flujo de sangre dentro del lumen del dispositivo, resultando en una desviación y desaceleración del flujo sanguíneo en el saco aneurismático que conduce a la formación de un trombo y posterior escarificación de este (figura 6). Al final de este proceso, ocurre la endotelización mediante el desarrollo de una capa neointima que envuelve la endoprótesis y de esta forma se reconstruye todo el segmento arterial4,5.
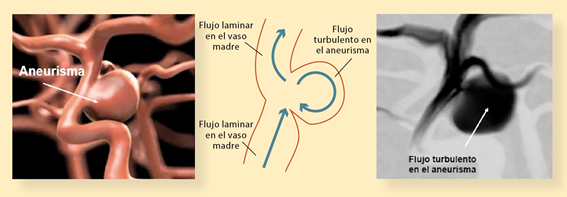
Foto: Omar Pichardo Uribe.
Figura 5 Esquema de un aneurisma cerebral previo al tratamiento donde se ejemplifica la inyección de medio de contraste y se observa el flujo turbulento en el mismo.

Foto: Omar Pichardo Uribe.
Figura 6 Esquema de un aneurisma cerebral post-tratamiento donde se ejemplifica la inyección de medio de contraste y se observa el cambio de flujo de turbulento a laminar.
A pesar de que existen determinadas limitaciones como el sitio anatómico y diversos escenarios clínicos, el dispositivo puede usarse con alto grado de efectividad, la reconstrucción mediada por PED parece representar una óptima modalidad de tratamiento10,11.
En un principio, el PED fue utilizado para lesiones aneurismáticas muy específicas y que se encontraran en la circulación anterior (que representa el 85% de la localización de los AI)6. Sin embargo, se fue extendiendo su uso a diversas topografías y distintos tipos de aneurismas, diversificando el uso de estos dispositivos a la circulación posterior, aneurismas altamente complejos, llegando a utilizarse en vasos menores a 3 mm, en vasos muy distales y en bifurcaciones, lo que representa un cambio en el paradigma, pues dichos estudios tienen como objetivo aportar evidencia científica para poder expandir las indicaciones de uso de los diversores de flujo en situaciones de alta complejidad, como los aneurismas rotos o en población pediátrica7,11.
Otro aspecto a resaltar es que la estancia hospitalaria se acorta de forma significativa respecto al tratamiento neuromicroquirúrgico convencional. El tiempo promedio de implantación es de 90 minutos, llegando a ser hasta de 30 minutos en centros con alta demanda y experiencia, en comparación con 240 minutos promedio de la cirugía. Contando el tiempo de estancia desde el día del procedimiento hasta el alta, tenemos 36 horas como media, lo cual muestra una clara ventaja respecto a las 120 horas con el tratamiento convencional. Todo esto se refleja en disminución en los costos hospitalarios y la reincorporación total a las actividades habituales de forma anticipada. Se debe hacer hincapié en la detección oportuna de los AI ya que se puede evitar la ruptura de los mismos y por consiguiente la aparición de HSA y sus complicaciones si se realiza este tipo de procedimiento mínimamente invasivo. El riesgo de ruptura de los AI que se detectan mediante resonancia magnética es de 18.5% y se incrementa anualmente.
A pesar de que se ha descrito en múltiples estudios la asociación de ciertos factores de riesgo como tabaquismo, hipertensión, género femenino (2:1), enfermedades como riñón poliquístico autosómico dominante, enfermedades del colágeno como Ehlers Danlos, síndrome de Marfan6,8. Hoy en día sigue siendo controversial la realización de métodos de cribado universal para la detección sistemática de AI6.
En el primer caso, no se contaba con antecedentes o factores de riesgo que hicieran sospechar la presencia de AI; sin embargo, debido a sintomatología por motivo diferente, se pudo detectar el caso de este paciente y tratarlo oportunamente.
En el segundo caso, sí existían factores de riesgo; sin embargo, no hubo sospecha clínica de esta enfermedad por el médico de primer y segundo contacto. El diagnóstico se logró después de que la paciente consultó a un especialista en neurocirugía.
CONCLUSIÓN
El uso de dispositivos diversores de flujo es una excelente alternativa para el tratamiento de aneurismas incidentales, con importantes ventajas de costo-efectividad, reduciendo tiempos quirúrgicos, de estancia hospitalaria y de recuperación. Además de tener un porcentaje de curación superior al 95% a 5 años.











 nueva página del texto (beta)
nueva página del texto (beta)



