Introducción
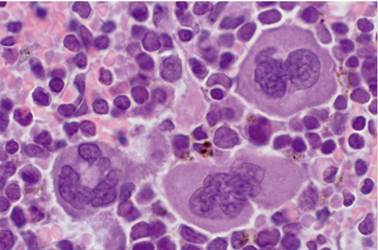
Los megacariocitos son células que miden entre 50 y 150 (m de diámetro, tienen un solo núcleo multilobulado y poliploide que puede llegar a tener hasta 64n, se dice que cada lóbulo del núcleo tiene 2n, de ahí su nombre, basado en la etimología mega ‘grande’, y karion ‘núcleo’. Tienen un proceso de crecimiento muy especial llamado endomitosis, que consiste en que la célula duplica su material genético e inicia el proceso de mitosis, pero sin citocinesis ni cariocinesis; así, al no separarse en 2 células hijas, esta célula se hace más grande, con mayor cantidad de citoplasma y con un núcleo lobulado cada vez de mayor tamaño. Durante el crecimiento de las células, también va madurando su citoplasma, es decir, se produce una gran cantidad de proteínas que son almacenadas en sus 3 tipos de gránulos, que son los que heredarán a las plaquetas: alfa o A, delta o densos y lambda o lisosomas. Finalmente, ocurrirá el proceso de desprendimiento del citoplasma para dar lugar a las plaquetas y el núcleo desnudo de los megacariocitos lo fagocitan los macrófagos de la médula ósea1. También se ha documentado la presencia de megacariocitos productores de plaquetas en el pulmón2 .
Un poco de historia
Hace poco más de cien años, las plaquetas se consideraban “el polvo de la sangre”. Posteriormente fueron descritas por Adisson, Osler y Hayem. En 1882, Bizzozero las llamó plaquetas y describió su adhesividad. Bizzozero también fue el primero en describir a los megacariocitos, sin embargo Howell les dio su nombre actual en 1890. James Homer Wright, utilizando la tinción nombrada como él, identificó a los megacariocitos como los precursores de las plaquetas3,4,5.
En un principio fue difícil entender la biología de esta célula, sobre todo por la dificultad de realizar cultivos y analizar sus funciones, pero a partir del descubrimiento del receptor de trombopoyetina6, llamado Mpl, en 1992, y posteriormente del descubrimiento de la trombopoyetina (TPO) en 1994, por varios grupos simultáneamente7,8,9,10, se ha avanzado mucho en el descubrimiento de la biología de los megacariocitos.
¿Cuál es la importancia de la trombopoyetina y su receptor MPL?
La principal hormona reguladora de la producción plaquetaria es la TPO, que es el estímulo más potente para las células formadoras de colonias de megacariocitos, y también promueve la supervivencia y expansión de las células troncales hematopoyéticas (CTH)11. De hecho, su receptor Mpl se encuentra presente desde la célula troncal hematopoyética hasta las plaquetas12.
La TPO se sintetiza principalmente en el hígado, y un poco menos en el riñón y en la médula ósea. Su producción es constitutiva y los niveles de TPO libre en sangre y médula ósea son inversamente proporcionales a la cuenta plaquetaria. La regulación de los niveles de trombopoyetina se basa principalmente en la unión a su receptor Mpl, su internalización y destrucción. Por lo tanto, si hay muchas plaquetas, se une mucha TPO a su receptor Mpl y hay poca TPO libre que aumente la maduración de megacariocitos. Sucede lo contrario si existen pocas plaquetas, hay pocos sitios de unión de la TPO a su receptor y mayor cantidad de TPO libre para estimular la megacariopoyesis13,14 (figura 1). La unión de TPO a su receptor Mpl activa a JAK2, que a su vez fosforila y activa a STAT3 y STAT5, que promueven el crecimiento celular. Además, las vías de MAPK se activan, lo que potencia la maduración de los megacariocitos12. La TPO estimula la endomitosis, maduración y una gran variedad de efectos antiapoptóticos en los precursores de megacariocitos y en los megacariocitos. El receptor de trombopoyetina Mpl está presente en una amplia variedad de células hematopoyéticas, como ya se mencionó, en todas las células del linaje megacariocítico, pero también en otras células como los miocardiocitos, neuronas, astrocitos y células microgliales y aún falta estudiar el efecto que tiene en todas estas otras células que no son hematopoyéticas15.

Figura 1 Regulación de la producción plaquetaria a través de la unión de TPO a su receptor MPL. Si hay muchas plaquetas (trombocitosis), la TPO estará unida al receptor MPL de las plaquetas y habrá muy poca TPO libre, por lo tanto no estimulará la proliferación de megacariocitos. En el caso contrario, cuando existen pocas plaquetas (trombocitopenia), no habrá muchos receptores MPL y por lo tanto la TPO libre aumentará y podrá llegar a médula ósea a estimular la megacariopoyesis para aumentar la producción plaquetaria.
¿Qué es la megacariopoyesis?
Es un proceso que dura de 5 a 7 días, mediante el cual ocurre la diferenciación y proliferación desde la CTH hasta el megacariocito maduro12.
La megacariopoyesis se lleva a cabo en la médula ósea roja, aunque también se ha descrito que se realiza en el pulmón de manera muy importante2,16. Para comprender este proceso de manera sencilla, se puede separar en 2 fases: la fase proliferativa, en la cual se lleva a cabo la expansión de los precursores megacariocíticos y la madurativa, en la cual se producen los 2 sucesos principales de este linaje. El primero es a nivel nuclear, la poliploidización por endomitosis; y el segundo es la maduración citoplásmica17.
La CTH da origen a un progenitor mieloide común (PMC) y este a su vez origina un progenitor eritroide-megacariocítico (PEM) o un progenitor megacariocítico unipotencial18. Los progenitores megacariocíticos se dividen (por mitosis común) y avanzan en la maduración convirtiéndose en promegacarioblastos, que son células diploides (2N). La progresión al estadio de maduración siguiente, de promegacarioblasto a megacarioblasto, se produce porque estas células cambian del proceso mitótico al endomitótico19. Morfológicamente, algunas células del linaje megacariocítico se pueden reconocer: el megacarioblasto mide aproximadamente 10 µm de diámetro y tiene núcleo bilobulado; el promegacariocito mide de 10 a 50 µm de diámetro y su núcleo es arriñonado (su ploidía es de 4 a 8N) y el megacariocito, que mide entre 50 y 150 de diámetro con núcleo multilobulado (este estadio de maduración es el más abundante y fácil de distinguir)17 (figuras2 y 3). Cuando la poliploidización se detiene, los ahora megacariocitos ya incrementaron notablemente su masa citoplásmica, la cantidad de organelos, la formación de gránulos específicos y generaron al sistema de demarcación de membrana20. Al final, reorganizan el citoesqueleto para formar largos pseudópodos llamados proplaquetas que se fragmentan y forman a las plaquetas20.

Figura 2 Etapas de la megacariopoyesis. La célula troncal hematopoyética (CTH) da origen al progenitor mieloide común (no ilustrado) y este origina al progenitor eritroide-megacariocítico (PEM), posteriormente hay la formación de unidades formadoras de colonias de megacariocitos (no ilustrado) y empezará la diferenciación de las células precursoras. El megacarioblasto inicia la endomitosis y tiene un núcleo bilobulado, el promegacariocito continúa con la endomitosis y tiene varios lóbulos (4 a 8N) y por último el megacariocito maduro que puede llegar a 64N y tiene gran cantidad de citoplasma.
¿Cómo sucede la endomitosis?
El megacariocito tiene que crecer tanto debido a que entre más grande es, mayor es la cantidad de plaquetas que puede generar. Para aumentar la masa citoplásmica, la diferenciación megacariocítica tardía cambia, de ser una mitosis clásica, al proceso de endomitosis; este proceso conduce a la formación de una célula gigante21,22. La endomitosis es el mecanismo por el cual estas células son poliploides y gigantes; se describe como un proceso mitótico “abortado” o inconcluso.
El núcleo multilobulado del megacariocito es el resultado de la poliploidización por el proceso endomitótico y se explica a continuación.
Los megacariocitos maduros son poliploides (4, 8, 16, 32 o 64N), lo más común es que sean 16N22. En condiciones de mayor demanda de plaquetas, el nivel de ploidía puede ser mayor (hasta 128N). La poliploidización es un proceso indispensable para su maduración terminal. Sin embargo, existen los micro-megacariocitos (2N y 4N) que son células maduras, esto sucede en el hígado fetal y en algunas patologías23.
El aumento en el número cromosómico de cualquier célula, es decir la poliploidización, involucra varias rondas sucesivas de replicación de ADN, lo que se logra por 2 mecanismos diferentes: la endorreplicación con endociclos (sucede en la mosca de la fruta -Drosophila-, las plantas y en el trofoblasto) o la endomitosis22. La diferencia entre ambos es la entrada o no a la mitosis. En el caso de los megacariocitos, los estudios confirman la entrada al proceso mitótico21.
Durante la megacariopoyesis, son los megacarioblastos quienes inician este proceso. Estos entran en mitosis, desarrollan un complejo mitótico multipolar (si es 2N, 2 polos; si es 4N, 4 polos y así sucesivamente), con segregación asimétrica de los cromosomas hacia los diferentes polos, pero sin que haya consecuencia funcional, ya que solo se forma un núcleo multilobulado24. Los primeros estudios, sobre las diferentes etapas de esta mitosis incompleta, mostraron que hasta la anafase todo es normal, pero después se omite la telofase y la citocinesis25. Otros estudios más recientes, mostraron que la endomitosis se produce por un defecto en la citocinesis y que en la transición de 2N a 4N, existe una verdadera telofase. Las 2 células hijas casi se separan con una aparente zona media normal y el surco de escisión se forma, pero el surco sufre una rápida regresión y las 2 células hijas se fusionan. Un fenómeno similar ocurre durante la transición de 4N a 8N y la ploidía aumenta, en estas células se observa que la morfología semeja los “pétalos de una rosa”. Lo anterior indica que las anormalidades en la formación del surco son importantes para entender el proceso endomitótico26.
El proceso endomitótico es más complejo que solo una citocinesis defectuosa. La citocinesis defectuosa concluye con la formación de células multinucleadas, pero en maduración de los MKs, también la cariocinesis es anormal; el núcleo es multilobulado porque los puentes nucleoplásmicos persisten entre los núcleos de las células hijas, estos puentes implican que los núcleos se separen de manera incompleta y cuando las células hijas se fusionan, los núcleos se fusionan también y se obtiene una célula 4N con un solo núcleo bilobulado (así se forma un megacarioblasto)27. Conforme avanza la diferenciación, este proceso se repite y se van sumando lóbulos al núcleo.
En todos los tipos celulares, la mitosis es un proceso que se regula exhaustivamente, con el fin de evitar que se produzcan células alteradas. Sin embargo, durante la megacariopoyesis, este proceso presenta cambios muy importantes, que terminan con la generación de células poliploides. La poliploidización de los megacariocitos es el resultado de la endomitosis, y la endomitosis es el resultado de la mitosis inconclusa (sin citocinesis y sin cariocinesis). Esta abismal diferencia entre la mitosis y la endomitosis, se explica por los factores de crecimiento a los que responde, los factores de transcripción que expresa, la ausencia, la presencia y la cantidad de ciertas proteínas.
¿Por qué deben ser poliploides los megacariocitos?
La poliploidización es más eficiente para incrementar el número de plaquetas que la división celular. Los megacariocitos maduros que son 2N pueden liberar 1 o 2 plaquetas, mientras que un megacariocito 16N dará lugar a 2,000 plaquetas, aproximadamente. Esto significa que 3 pasos de replicación de ADN llevarán a una producción de 16 plaquetas por la vía mitótica y 2,000 por la endomitótica20, visto así, la importancia de la poliplodización en la diferenciación megacariocítica, salta a la vista. En el caso del ser humano, durante la vida intrauterina, los primeros megacariocitos también son diploides28. Por lo tanto, la poliploidización de estas células no es estrictamente esencial, pero constituye una excelente forma de hacer la producción plaquetaria mucho más eficiente.
Los megacariocitos no existen en otras especies, aparecen en los mamíferos y, en ellos, el genoma se duplica completamente en cada ronda de poliploidización. En este genoma los alelos permanecen funcionales con la misma distribución de heterocromatina. Por ejemplo, en los 16N, todos los 32 alelos están funcionando, excepto aquellos localizados en el cromosoma X en las hembras (Raslova et al., 2003). Esto implica que la célula tiene una actividad metabólica alta, capaz de incrementar la síntesis de proteínas y es más capaz de resistir al estrés metabólico y genotóxico y por supuesto, a la haploinsuficiencia29.
La poliploidización está regulada por muchos factores y, por supuesto, el principal factor de crecimiento es la TPO, ya que tiene efectos sobre las CTH y sobre todo el proceso de diferenciación megacariocítica. TPO en conjunto con otros factores de crecimiento, regula el ciclo mitótico y endomitótico en la transición G1/S. La regulación extracelular de la poliploidización (pero no la formación de proplaquetas) está regulada por la TPO. La célula también tiene una regulación autónoma, que está dominada por una gran cantidad de factores de transcripción21.
Los defectos en la poliploidización ocasionan problemas en la maduración de los megacariocitos y por lo tanto, la consecuencia es la trombocitopenia. Por el contrario, la alta poliploidía está presente en la trombocitosis21.
¿En qué consiste la maduración del citoplasma de los megacariocitos?
Durante el proceso de maduración, el citoplasma de los megacariocitos se especializa de manera importante, y la aparición progresiva de varios tipos de gránulos como los densos y los gránulos alfa, además de lisosomas es una característica destacable en este proceso19. Desde etapas muy tempranas, como células precursoras de megacariocitos, se pueden identificar estos elementos en pequeñas cantidades y van aumentando conforme progresa la maduración30.
Los lisosomas de los megacariocitos se forman antes que los gránulos alfa y gránulos densos, y se sabe que su composición es mucho más heterogénea. Se forman a través de la vía RER-Golgi-endosomas y contienen enzimas hidrolíticas tales como glucosidasas, proteasas y lipasas involucradas en la degradación de carbohidratos, proteínas y lípidos respectivamente. Contienen también fosfatasa ácida, aril sulfatasa y catepsinas D y E31. Además de estas proteínas, los lisosomas en los megacariocitos contienen proteínas ubicuas de las membranas lisosomales como LAMP-1, LAMP-2 y LAMP-3 (CD63)32.
Por otro lado, los gránulos alfa y densos de los megacariocitos son altamente especializados y pertenecen a la familia de organelos “relacionados con los lisosomas”33. Estos se distinguen de los gránulos secretores convencionales en que se desarrollan a partir de pequeñas vesículas formadas en el complejo de Golgi, de donde se convierten en cuerpos multivesiculares que interactúan con vesículas endocíticas para formar los gránulos alfa y densos maduros34,35,36. Los gránulos alfa poseen un tamaño y densidad uniformes, mientras que los densos tienen un fondo granular pálido rodeado por la membrana plasmática, que encierra un núcleo de mayor densidad que puede estar en posición central o excéntrica.
Los gránulos más abundantes son los alfa, que contienen factores clave para la adhesión plaquetaria, la angiogénesis, la inflamación, factores de crecimiento para reparación de heridas y remodelación del tejido óseo37. Tienen forma esférica con densidad uniforme y un ligero centro denso. Las proteínas contenidas en los gránulos alfa de los megacariocitos pueden ser de distintas clases. La primera clase son aquellas sintetizadas específicamente por los megacariocitos tales como el factor de plaquetas tipo 4 (PF4) y la tromboglobulina; la segunda clase son proteínas sintetizadas por el megacariocito, aunque no de manera específica, y como ejemplos tenemos al factor de coagulación tipo V, la trombospondina, la P-selectina y el factor de Von Willebrand (VWF). Conforme la maduración megacariocítica avanza, la expresión de todos estos factores incrementa, y se localizan en los futuros gránulos alfa. Finalmente otras proteínas, como el fibrinógeno, la inmunoglobulina G y la albúmina, son sintetizadas por otras células distintas a los megacariocitos y luego son endocitadas por ellos uniéndose a glucoproteínas de la membrana plasmática como las GPIIb o IIIa31,38. Algunos gránulos alfa contienen también exosomas (40-100 nm) que tienen a la proteína CD63 (proteína lisosomal) que se libera en respuesta al estímulo de trombina34.
En cuanto a los gránulos densos, contienen una variedad de factores de importancia hemostática, predominantemente para la activación y reclutamiento de plaquetas en los sitios de daño vascular, incluyendo sustancias que se secretan al medio extracelular durante la activación plaquetaria, tales como la serotonina, catecolaminas, adenosin 5-difosfato (ADP), adenosin 5-trifosfato (ATP), calcio y polifosfatos35,39. Además de estos factores, los gránulos densos contienen componentes integrales de membrana como la glucoproteína IIb, la glucoproteína Ib (GPIB), P-selectina y granulofisina (marcador específico de los gránulos densos)31. En la tabla 1 se resumen los principales componentes de los gránulos de los megacariocitos y la función de cada uno de ellos.
Tabla 1 Resumen de los tipos de gránulos del megacariocito y de las principales moléculas que contiene cada tipo de gránulos
| Tipo de gránulo | Contenido de los gránulos |
|---|---|
| 1. Gránulos alfa | |
| Contienen factores de crecimiento que favorecen síntesis de matriz extracelular, moléculas de adherencia plaquetaria o coagulación | Factor plaquetario 4 (CXCL4) |
| Trombospondina 1 y 2 | |
| ( Tromboglobulina | |
| Factor de Von Willebrand | |
| PDGF (factor de crecimiento derivado de plaquetas) | |
| TGF beta (factor de crecimiento transformante () | |
| EGF (factor de crecimiento epidérmico) | |
| VEGF (factor de crecimiento endotelial vascular) | |
| 2. Gránulos densos o delta | |
| Contienen agonistas plaquetarios, moléculas que activan a las plaquetas | Adenosin trifosfato (ATP), adenosin difosfato (ADP) |
| Serotonina, histamina, adrenalina | |
| Calcio, magnesio | |
| 3. Gránulos lambda o lisosomas | |
| Misma forma y contenido que en otras células | Hidrolasas ácidas: fosfatasa ácida, proteasas, glucosidasas, lipasas, nucleasas |
¿Cómo sucede la trombopoyesis?
La trombopoyesis es el proceso mediante el cual se producen las plaquetas e incluye los últimos eventos de la maduración de los megacariocitos, los cuales inician la formación de proplaquetas y la liberación de las plaquetas directamente al torrente sanguíneo12.
Una vez que ocurre la megacariopoyesis y maduran los megacariocitos, la trombopoyesis se desarrolla en el nicho vascular de la médula ósea, es decir, el megacariocito migra hasta los sinusoides, donde el microambiente favorece la producción de plaquetas. Las células mesenquimatosas y las células reticulares presentes en la médula ósea, están implicadas en la reorganización del citoesqueleto40 y en la producción de factores quimiotácticos que atraen a los megacariocitos hacia los capilares sinusoidales41. Entre los factores de crecimiento involucrados en la producción de plaquetas, están los SCF (factores de células madre), IL3, IL6, IL11, y el factor inhibidor de leucemia42. En los nichos donde se encuentran los megacariocitos predominan la colágena IV, la laminina y el fibrinógeno, los cuales participan al sostener y dirigir a las proplaquetas hacia los sinusoides43.
Las células reticulares producen SDF-1 (factor 1 derivado de células estromales), también llamado CXCL-12; el receptor de esta quimiocina es el CXCR-4. La interacción de SDF-1 con CXCR-4 es una señal muy importante para que los megacariocitos migren hacia los sinusoides41. Al aproximarse los megacariocitos a los sinusoides, se adhieren a las células endoteliales y se ha reportado la participación del FGF-4 (factor de crecimiento de fibroblastos 4) en esta adhesión ya que promueve la expresión de VCAM-1 (molécula de adhesión celular vascular 1) en las células endoteliales de los sinusoides44.
El megacariocito se modifica físicamente para formar prolongaciones del citoplasma de 2 a 4 µm de diámetro45. La formación de estas prolongaciones llamadas proplaquetas, así como el transporte de gránulos y organelos hacia ellas, depende de los microtúbulos46,47.
Una vez que se han formado las proplaquetas dentro de los sinusoides, al fragmentarse, liberan finalmente a las plaquetas individuales, dando lugar aproximadamente de 2,000 a 5,000 nuevas plaquetas por megacariocito48. El estímulo mecánico que ejerce el flujo sanguíneo sobre las proplaquetas, produce una tracción hasta que se liberan las plaquetas49,50(figura 4).

Figura 4 Esquema de la trombopoyesis. Se observa un megacariocito extendiendo sus proplaquetas hacia el interior de un sinusoide. El flujo sanguíneo ayuda a desprender a las plaquetas de las proplaquetas y terminar su liberación a la circulación.
Existen otros factores que participan en la trombopoyesis; por ejemplo, las especies reactivas de oxígeno (ROS) participan en la maduración de los megacariocitos y en la formación y fragmentación de las proplaquetas51. El sistema nervioso simpático también estimula la producción de plaquetas al favorecer la adhesión y migración de los megacariocitos y la formación de proplaquetas52.
Existe otro modelo propuesto de trombopoyesis, llamado la teoría de la fragmentación explosiva, en la que el megacariocito presenta ondulaciones, protrusiones y formas similares a ampollas y la presencia en el citoplasma de zonas con membranas internas que demarcan plaquetas preformadas que se liberan cuando se fracciona el citoplasma. Se propone que esto sucede en situaciones que requieran aumentar las concentraciones de plaquetas en sangre en poco tiempo, ya sea bajo condiciones proinflamatorias o de pérdida aguda de plaquetas53,54.
Para la formación de plaquetas se requiere la actividad de la caspasa 355. Las células endoteliales dañadas y las plaquetas activadas liberan IL1α (interleucina 1α), la cual activa a la caspasa 3 en megacariocitos maduros sin desencadenar la apoptosis de la célula56. La producción de plaquetas mediada por IL1α es 20 veces mayor que en la vía clásica de trombopoyesis y las plaquetas generadas por esta vía son de mayor tamaño y son funcionalmente normales56.
¿Cuáles son las funciones de los megacariocitos? Los megacariocitos dan origen a las plaquetas
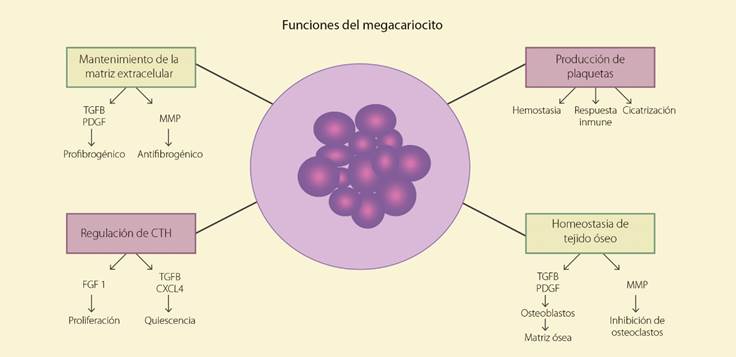
La principal función de los megacariocitos, como se ha explicado a lo largo del artículo, es la producción de plaquetas. Es importante entonces, mencionar el papel funcional de las plaquetas, que participan en la hemostasia formando el coágulo primario, en la reparación de las heridas, en la inflamación y respuesta inmune innata57. Muchas de las funciones que llevan a cabo son determinadas por los elementos de membrana y el contenido de sus gránulos que tienen su origen en los megacariocitos. Por ejemplo, las glucoproteínas de membrana y el factor de Von Willebrand son fundamentales para la adhesión y agregación plaquetaria y estas aparecen desde etapas tempranas de la megacariopoyesis31. Los múltiples factores de crecimiento que el megacariocito sintetiza y almacena en los gránulos alfa que están presentes en las plaquetas, tienen como función la proliferación de los fibroblastos y el aumento en la síntesis de colágena y de matriz extracelular en general, lo cual será fundamental para el papel de las plaquetas en la cicatrización y reparación de tejidos58. Por último, se le da cada vez más importancia al papel que juegan las plaquetas en la respuesta inmune y para ello tienen la expresión de varias moléculas producidas por el megacariocito, como son la p-selectina o CD62P que participa en la unión de plaquetas con leucocitos o los receptores de tipo Toll (TLR) que son moléculas capaces de reconocer algunos microorganismos y que son el primer paso para que la plaqueta produzca algunas sustancias bactericidas o interleucinas que activen a neutrófilos o a otros leucocitos59.
Los megacariocitos participan en el mantenimiento del tejido óseo
Otra función de los megacariocitos es la participación en la homeostasia del tejido óseo, lo cual se ha demostrado en estudios in vitro e in vivo en modelos animales y en enfermedades humanas. Los megacariocitos regulan la proliferación y diferenciación de los osteoclastos ya que expresan ciertas proteínas que pueden estimular (como RANKL) o inhibir el desarrollo de osteoclastos (como osteoprotegerina [OPG])60,61. Por otro lado, aumentan la formación de osteoblastos que, bajo la influencia de los megacariocitos, también aumentan la síntesis de matriz ósea, sobre todo aumentan su producción de colágena de tipo I, osteocalcina, fosfatasa alcalina y de osteoprotegerina62,63.
En modelos animales con sobreexpresión de TPO, que cursa con aumento de megacariocitos, se ha demostrado que estos megacariocitos producen mayor cantidad de factor de crecimiento transformante ( (TGF() y factor de crecimiento derivado de plaquetas (PDGF) por lo que se desarrolla un aumento en la densidad ósea, debido a que ambos factores estimulan la proliferación de osteoblastos y la síntesis de matriz ósea. En este mismo modelo se aumenta la producción de osteoprotegerina por los megacariocitos, lo que inhibe la formación de osteoclastos64.
En ratones con deficiencia de los factores de transcripción GATA-1 o NF-E2 los megacariocitos no maduran de manera normal y se presenta una megacariocitosis con trombocitopenia, asociado con aumento en la masa ósea. En la enfermedad de von Willebrand en modelos animales y en humanos, en la que hay aumento en los megacariocitos, también se observa un aumento en la densidad ósea con disminución de marcadores de resorción ósea65.
Los megacariocitos regulan la proliferación y quiescencia de las CTH
Existen estudios en los que se evidencia que los megacariocitos tienen la capacidad de regular la quiescencia y por otro lado, en condiciones específicas, aumentar la proliferación de las CTH. La autorrenovación de estas células depende de algunos factores de crecimiento producidos por los megacariocitos como PDGF, factor de crecimiento epidérmico (EGF) y serotonina. De hecho, se ha visto en cultivos de CTH que proliferan mucho mejor si son cultivadas con megacariocitos66. En transplantes de médula ósea en modelos animales, las CTH se localizan preferentemente junto a los megacariocitos y la inhibición de los megacariocitos impide el éxito del transplante. En un principio se pensó que este efecto era producido por los megacariocitos de manera indirecta, al estimular a los osteoblastos en el llamado nicho osteoblástico, pero ahora se ha visto que el efecto es directo. La producción de factor de crecimiento fibroblástico 1 (FGF1) por los megacariocitos estimula la proliferación de las CTH. Experimentalmente se ha visto que los megacariocitos aumentan la producción de FGF1 después del tratamiento con quimioterápicos para aumentar la hematopoyesis y lograr la recuperación de la médula ósea67,68.
Sin embargo, la proliferación de las CTH está muy regulada, de hecho la mayoría de estas células se encuentra en un estado no proliferativo o quiescente. En un estado basal en la médula ósea, los megacariocitos restringen la proliferación y favorecen la quiescencia de estas células. El TGF( y el CXCL4 llamado también factor plaquetario 4 producido por megacariocitos y por células del estroma son responsables de la quiescencia de las CTH67,69.
En algunos estudios se ha demostrado que la interacción entre los osteoblastos, los megacariocitos y los osteomacs, es fundamental para el mantenimiento del nicho donde se desarrollan las células troncales hematopoyéticas. Los megacariocitos son estimulantes de los osteomacs, un tipo especial de macrófagos con fenotipo CD45+ F4/80 que son fácilmente detectables en la calota neonatal70. Todas estas interacciones celulares son importantes para la conservación de las CTH, que al final están relacionadas con la diferenciación adecuada de todos los linajes de la hematopoyesis.
Los megacariocitos juegan un papel en el mantenimiento de la matriz extracelular y participan en el desarrollo de la mielofibrosis
Los megacariocitos sintetizan factores profibrogénicos y antifibrogénicos. Entre los antifibrogénicos se encuentran las metaloproteinasas (MMP), como MMP-2, MMP-9, MMP14, MMP-24 MMP-25 que degradan varios componentes de la matriz extracelular. Esta función es importante para que los megacariocitos migren del nicho osteoblástico al nicho vascular, así como para extender sus podosomas y generar las proplaquetas en los sinusoides66.
Sin embargo, en modelos animales y en pacientes con enfermedades en las que existe una proliferación de megacariocitos, como en la leucemia megacarioblástica aguda, así como en neoplasias mieloproliferativas, existe un riesgo aumentado de fibrosis de la médula ósea o mielofibrosis71. Estos megacariocitos patológicos aumentan la síntesis y secreción de factores profibrogénicos, como el TGF( y PDGF que estimulan la proliferación y activación de fibroblastos y, a su vez, los fibroblastos aumentan su producción de colágena I y III, lo que predispone a la fibrosis72. El papel que juegan los megacariocitos en esta complicación, es un tema de investigación que aún tiene mucho por descubrir y que pudiera ser usado como un blanco terapéutico o preventivo de la mielofibrosis.
En la figura 5 se sintetizan las principales funciones de los megacariocitos.
Conclusiones
Los megacariocitos son células muy interesantes que poco a poco han ido develando sus secretos. Actualmente se conoce más acerca de su biología, cómo llegan a ser células tan grandes y poliploides, en qué consiste la endomitosis, cómo madura el citoplasma y los mecanismos que participan en la liberación de las plaquetas. Su función más relevante es la producción de plaquetas, pero se le reconocen cada vez más funciones, como su papel en el mantenimiento del tejido óseo, su participación en el mantenimiento de la matriz extracelular y su papel regulador de las células troncales hematopoyéticas. Aún existen muchas preguntas para resolver que involucran a los megacariocitos; por ejemplo, si será posible que, a través de regular la megacariopoyesis, se pudiera mejorar la recuperación de la médula ósea después de una quimioterapia o mejorar el éxito de los transplantes de células troncales modulando los megacariocitos; además, si se lograra modular la megacariopoyesis, tal vez no serían necesarias tantas transfusiones de concentrados plaquetarios o por otro lado, la inhibición de los megacariocitos podría prevenir la mielofibrosis. La investigación en este campo, promete ser aún más interesante y con una gran utilidad en la medicina clínica.
Agradecimientos
Se agradece a Armando Zepeda Rodríguez y a Francisco Pasos Nájera su apoyo para el procesamiento de las imágenes, y a la histotecnóloga Raquel Guerrero Alquicira por el procesamiento de las muestras que sirvieron para ilustrar esta revisión, todos integrantes del Departamento de Biología Celular y Tisular de la Facultad de Medicina, UNAM.











 nueva página del texto (beta)
nueva página del texto (beta)