INTRODUCCIÓN
El timo es el órgano linfoide primario donde se lleva a cabo la maduración y diferenciación de los linfocitos T. Al igual que en la médula ósea, los procesos de maduración en el timo permiten, por un lado, que salgan a la circulación linfocitos inmunocompetentes, y por el Otro que se elimine la mayor parte de las clonas autorreactivas. El proceso de eliminación de estas últimas en órganos linfoides primarios se conoce соmо tolerancia central, y si bien, la mayor parte de las células autorreactivas son eliminadas, algunas llegan a salir a la circulación y eventualmente podrían montar una respuesta de tipo autoinmune a nivel periférico. Existen diversos mecanismos adicionales para eliminar o contener a las células autorreactivas que llegaron a la periferia, uno crucial es la presencia de distintas poblaciones de células reguladoras que tienen la capacidad de suprimir clonas potencialmente peligrosas. Desde la década de los sesenta se demostró la presencia de células con efecto supresor, pero a pesar de la evidencia de su efecto biológico, la imposibilidad de establecer su fenotipo hizo que el interés por éstas decayera.
Es hasta 1995 que Sakaguchi y cois, definieron fenotípicamente y caracterizaron una población de linfocitos Т соn actividad supresora1; a partir de entonces se han identificado Otras poblaciones, no sólo de células T reguladoras (Treg), sino también de linfocitos B, que se diferencian en la periferia de acuerdo con cada microambiente. La población de linfocitos Т supresores que describió Sakaguchi, a comparación de Otras poblaciones reguladoras, puede distinguirse tanto en el timo соmо en la periferia, lo que las ubica en un contexto de capital importancia. En este trabajo nos enfocaremos en las células Treg que se diferencian en el timo; cabe recordar que en este órgano se diferencian también Otras poblaciones de linfocitos T, y por lo tanto no debemos olvidar contextualizar la información en relación con todas las poblaciones de linfocitos Т sujetas a los diversos procesos de educación tímica.
Actualmente hay un interés creciente por el estudio de estas células Т reguladoras, no solo para dilucidar los diversos mecanismos supresores que ejercen sobre Otras células, particularmente aquellas con reactividad autoinmune, sino también por el papel que juegan en diversas patologías. Por ejemplo, se ha demostrado que además de controlar la respuesta autoinmune, también participan en el control de la respuesta inflamatoria aguda y crónica, así соmо en enfermedades alérgicas e infecciosas. Esta versatilidad y la capacidad moduladora que se han hecho evidentes por el creciente número de trabajos enfocados al estudio de las células T reguladoras motivaron el interés de la presente revisión.
CONTEXTO MORFOLÓGICO
El timo se encuentra localizado en el mediastino superior y anterior, formado por 2 lóbulos conectados por la línea media, rodeado por una capa de tejido conjuntivo que forma la cápsula, que emite ramificaciones que no llegan a fusionarse, pero que limita a los lobulillos (estructuras que están comunicadas entre sí). En el tejido conjuntivo que forma la cápsula, соmо las trabéculas, se encuentran los vasos sanguíneos y linfáticos y la inervación del órgano.
Cada lobulillo está poblado por linfocitos T en diferentes estadios de maduración, células a las que se les conoce соmо timocitos. En cada lobulillo identificamos una zona densamente poblada por corpúsculo timocitos en la periferia, la corteza, y otra menos poblada, la médula. Esta distribución también sugiere el flujo de maduración de los timocitos, que va de los menos diferenciados en la corteza a los más diferenciados en la medula. Otras células que se observan son las dendríticas, los macrófagos y los seis tipos de células epiteliales no linfoáticas,2 entre ellas, las células epiteliales de la corteza que producen IL-7, una citocina muy importante durante las etapas tempranas del desarrollo de los linfocitos T.
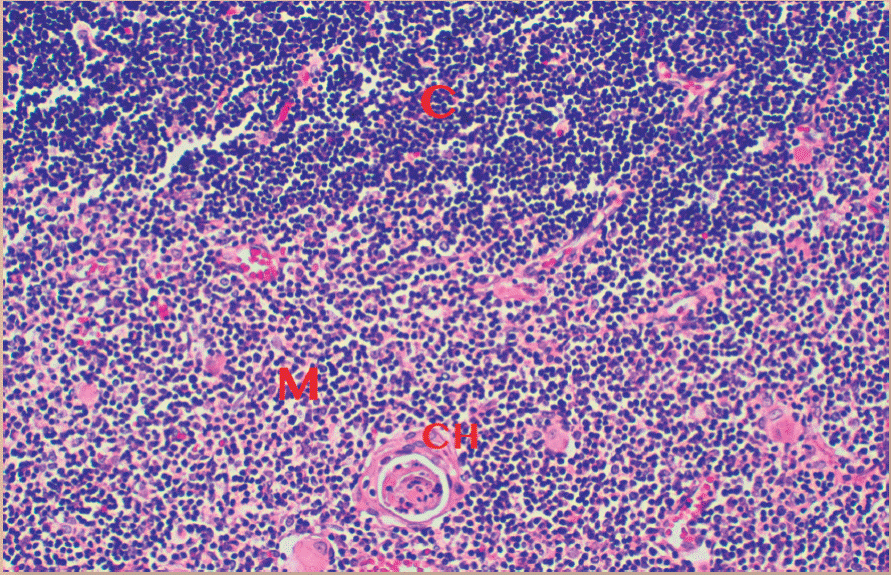
En la médula tirnica existe otro tipo de células epiteloides llamadas células epiteloides medulares (TMC), cuya importancia radica en su capacidad de presentar antígenos propios a los linfocitos T en desarrollo, 10 que da lugar a la eliminación células autorreactivas. Esto constituye uno de los mecanismos más importantes de tolerancia a lo propio y evita que linfocitos T potencialmente autoinmunes salgan a la circulación. Un marcador histológico distintivo de la médula tímica es la presencia de las células epiteliales de tipo VI o corpúsculos de Hassall, de los que se sabe que producen grandes cantidades de queratina (Figura 1)2.
Fotos otorgadas por los autores
Figura 1 Corte histológico del timo en el que se observa la corteza (C) y la médula (M). Se aprecia en la médula un corpúsculo de Hassall (CH), formado por varias células aplanadas y organizadas de manera concéntrica. (400 X)(H.E.).
El timo inicia su desarrollo embrionario a las 4 semanas, a partir de las III y IV bolsas branquiales. A las 8 semanas, empieza a ser colonizado por las células precursoras de los timocitos, las cuales migran al timo gracias a la quimiocina CCL25, ligando del receptor CCR9 expresado en la superficie de dichas células3.
MADURACIÓN DE LOS TIMOCITOS
Los timocitos se encuentran expuestos a diversos micro ambientes que proveen las señales necesarias para su desarrollo desde el momento en que ingresan al timo y a 10 largo de su desplazamiento desde la corteza hasta la médula tímica. En la corteza tímica se dan los rearreglos de los segmentos génicos que contienen la información que darán lugar al receptor para antigeno del linfocito T (TcR), ya sea del tipo Υδ o del tipo αß. También aquí comienza la expresión de las cadenas que forman al CD3 asociado a las cadenas ζ (CD247), así como la de los correceptores CD4 y CD8, que posteriormente definirán el desarrollo de los linfocitos T hacia cooperadores o citotóxicos respectivamente.
El proceso de maduración de los linfocitos T es complejo y requiere el seguimiento de una serie de pasos con un orden preciso de reordenamiento gènico y de expresión de diversas moléculas que da como resultado la definición de diversos estadios. Cuando los timocitos ingresan a la corteza tímica no expresan en su superficie el TcR, CD3, cadenas ζ, CD4 ni CD8; debido a la ausencia de expresión de estas 2 últimas moléculas, se les denomina dobles negativas (DN). Una vez en la corteza, los timocitos expresan ya tanto el TcR como CD4 y CD8 simultáneamente, por lo que se les denomina células dobles positivas (DP); este estadio de maduración es conocido como pro-linfocito T, y es esencial para la selección positiva.
Selección positiva
En este proceso de educación tímica, los timocitos DP (CD4+ / CD8+) interactúan con las moléculas del MHC de clase I у II, que se expresan en las células epiteliales de la corteza tímica con el objetivo de seleccionar a los linfocitos Τ que reconozcan al MHC propio. En esta etapa, el suceso crítico es que el TcR reconozca a las moléculas del MHC, tanto clase I como clase II con la intensidad correcta. El reconocimiento será exitoso en función de la avidez del TcR por la molécula del MHC, ya que tanto las interacciones con alta como con baja avidez darán como resultado la eliminación de esos timocitos, y serán únicamente exitosos aquellos que hayan mostrado una avidez intermedia, asegurando así la eficacia del reconocimiento de los linfocitos Т a las moléculas del MHC propias4.
Selección negativa
Durante la selección negativa, los timocitos migran hacia el centro del timo con ayuda de la expresión del receptor para quimiocina CCR7, esta selección ocurre en la región de la corteza tímica próxima a la unión corticomedular, en la propia región corticomedular y en la médula tímica5. Una vez en la zona, los linfocitos dobles positivos son sometidos a la presentación de antígenos propios en el contexto de las moléculas del MHC clases I у II, de tal manera que aquellos linfocitos que reconozcan con gran avidez a los autoantígenos son eliminados por apoptosis. Si bien este proceso de selección negativa se da para la mayor parte de los linfocitos T DP que tienen una alta afinidad por el complejo МНС/ autoantígeno y que son, por ende potencialmente autorreactivas, existe una pequeña fracción de estas células que no son eliminadas y se diferencian a una subpoblación con características fenotípicas у funcionales de células supresoras, llamadas células Τ reguladoras.
El proceso de selección negativa se debe a la presentación de numerosos antígenos propios en el timo; por años, la manera en que dichos antígenos llegaban al timo para ser presentados fue una gran interrogante, ya que muchos de ellos son característicos de otros tejidos. Se planteó la posibilidad de que células presentadoras de antigeno periféricas migraran al timo acarreando y presentando estos antígenos a los timocitos, pero esta explicación no aseguraba que hubiera una presentación de todos los antígenos del organismo, por lo que esta teoría se descartó como el mecanismo responsable. Posteriormente se demostró que son las mismas células epiteliales de la médula tímica las que presentan antígenos de otros tejidos, lo que llevó a la siguiente pregunta: ¿Cómo las células epiteliales de la médula tímica presentan esta gran variedad de antígenos? La respuesta fue dada por la demostración de la expresión de una molécula reguladora de la transcripción denominada regulador autoinmune (AIRE, autoimmune regulator), que les permite a las células epiteliales de la médula tímica expresar y presentar estos autoantígenos llamados ectópicos. El descubrimiento de mutaciones en el gen AIRE hizo evidente su importante papel en la eliminación de clonas autorreactivas, pues éstas dan lugar a un "síndrome autoinmune poliglandular", llamado distrofia ectodérmica, candidiasis, poliendocrinopatía autoinmune (APECED, autoimmune polyendocrinopathy-candidiasis-ectodermaldistrophy), acompañado de la presencia de autoanticuerpos específicos contra los tejidos endocrinos6.
Un mecanismo adicional de eliminación de timocitos autorreactivos está mediado por las células plasmocitoides dendríticas (pDC), que transportan antígenos propios al timo y los presentan a los timocitos que están bajo el proceso de selección negativa, de igual manera, aquellos timocitos que reconozcan antígenos propios se eliminarán por apoptosis. Las pDC expresan el receptor de quimiocina CCR9 y llegan desde la circulación al seguir a su ligando, la quimiocina CCL25 producida en el timo; estas células expresan también TLR9, una molécula que reconoce secuencias ricas en dinucleótidos de citocina y guanina no metiladas (CpG) de patógenos, cuya activación tiene como consecuencia la regulación negativa de CCR9. Así pues, si la pDC ha encontrado y procesado antígenos de patógenos, pierde su capacidad de migrar al timo7, de esta forma se garantiza que los timocitos capaces de reconocer antígenos de patógenos no sean eliminados, lo cual tendría consecuencias funestas para el organismo, ya que lo dejaría susceptible a posibles infecciones.
Factores de transcripción involucrados en la diferenciación de los linfocitos TCD4 y TCD8
Cabe mencionar que la selección negativa y positiva influencian también la decisión del compromiso de linaje que tomarán los linfocitos, es decir, influyen en la direccionalidad hacia la diferenciación a CD4+ o a CD8+. Esta decisión está mediada de manera importante por la activación de diversos factores de transcripción, por ejemplo, RunX compromete al linfocito Т a madurar como CD8+, mientras que la activación secuencial de GATA3 y ThPOK lleva a la célula a diferenciarse hacia CD4+. ТҺРОК tiene una función dual, ya que inhibe en los linfocitos CD4 la expresión de genes característicos del linaje CD8 y en los linfocitos T CD4 que se convertirán en células Т reguladoras y permite la expresión del factor de transcripción ҒохРЗ, que es miembro de la familia de factores de transcripción forkhead y que es el factor determinante en la diferenciación de las células T reguladoras8.
CÉLULAS Т CD4 REGULADORAS
Como ya se mencionó, una pequeña subpoblación de linfocitos Т CD4+ que reconoce antígenos propios durante el proceso de selección negativa, da lugar a la diferenciación de células Treg en el timo. Los linfocitos Т CD4+ reguladores expresan en sus superfide y de manera constitutiva la molécula CD25, que es la cadena alfa del receptor para IL-2, una citocina crítica para la activación y proliferación de los linfocitos T; también expresan en su superficie otras moléculas como el receptor del factor de necrosis tumoral inducido por glucocorticoides (GITR, glucocorticoid-induced tumour necrosis factor receptor) y el antígeno-4 asociado al linfocito T citotóxico (CTLA-4, cytotoxic T Lymphocyte Antigen 4) o CD152, cuyo papel se relaciona con mecanismos de supresión.
Ninguno de estos constituye marcadores fenotípicos absolutos de células T reguladoras, pues todos se expresan en linfocitos convencionales en diferentes momentos posteriores a la activación, de ahí la importancia del descubrimiento de la expresión del factor de transcripción llamado ҒохРЗ como marcador exclusivo de las Treg.
Mutaciones en el gen que codifica para este factor dan lugar al síndrome autoinmune poliglandular y enteropatía ligada al X(IPEX)9; en estos casos, la mayoría de los pacientes mueren jóvenes por diabetes autoinmune. Desde el descubrimiento de ҒохрЗ como marcador fenotípico de esta población celular hasta la fecha, se ha publicado un número creciente de trabajos tanto con modelos animales, como en pacientes con enfermedades autoinmunes.
Las células Treg CD4+ FoxP3+CD25+, se originan tanto en el timo (Figura 2) como en la periferia. Aquellas que se originan en el timo fueron inicialmente llamadas células Treg naturales o nTreg y a las que se diferencian en la periferia se les llamó células Treg inducibles o iTreg. Recientemente ha cambiado esta denominación y se les llama tTreg y pTreg, respectivamente. La diferenciación de ambas poblaciones depende de señales mediadas por сitосіnas у de la activación de factores de transcripción10,11. Las células tTreg se originan durante el proceso de selección negativa y se les encuentra en la región de la médula tímica, aunque también se les ha observado en menor proporción en la corteza. Es interesante que se ha reportado la existencia de linfocitos TCD4 + FoxP3+CD25+ fetales que son además ya funcionales y tienen la capacidad de suprimir la proliferación de linfocitos Т convencionales.
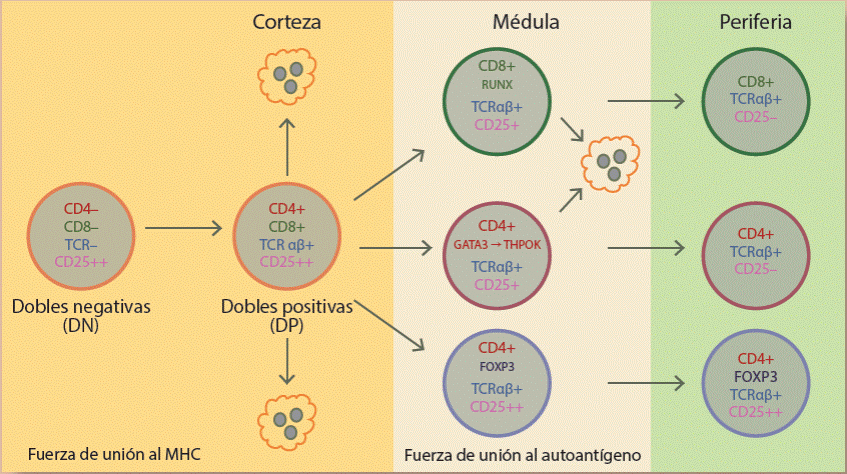
Figura 2 Visión general de la ontogenia de los linfocitos T. La selección positiva lleva a la eliminación de clonas de linfocitos Т incapaces de reconocer al MHC propio mientras que generalmente la selección positiva elimina a los linfocitos T que reconocen antígenos propios. La excepción son las células Treg, que se caracterizan por su capacidad de reconocer antígenos propios con alta avidez, estas células "escapan" de la selección positiva y sobreviven con el fin de controlar clonas autorreactivas en la periferia.
Citocinas y factores de transcripción en la diferenciación a células T reguladoras
La diferenciación de los linfocitos TCD4+F0xP3+CD25+ en el timo ocurre con un "vigoroso" reconocimiento de lo propio, pero sin consecuencias apoptóticas. Curiosamente las células Treg requieren señales constantes de rescate celular, es decir, siempre deben tener ayuda de alguna señal molecular que impida la ejecución de un proceso apoptótico. Esto se relaciona en gran medida con ҒохрЗ, que si bien es el factor de transcripción que les confiere todas sus capacidades supresoras también induce la expresión de proteínas proapoptóticas y reprime la expresión de BcL-2, una molécula antiapoptótica12. Irónicamente, la señal de IL-2 que favorece la expresión de ҒохрЗ a través de STAT 5, promueve también una señal vía la cadena gC que induce la expresión de MCL-1, una molécula antiapoptótica crítica para la sobrevivencia de las células Treg13.
Aunado a los mecanismos de sobrevivencia en las Treg, se ha demostrado que durante la generación de estas células, la señalización vía TGF-ß sumada a la estimulación vía TCR, induce la expresión estable de ҒохрЗ14. Dicha estabilidad parece estar relacionada con eventos epigenéticos como la remodelación de la cromatina del locus ҒохРЗ, en especial por una demetilación de una secuencia conservada no codificadora en la región TSDR. La estabilidad de la expresión de ҒохрЗ es un tema determinante, pues se ha demostrado que a diferencia de las nTreg, las PTreg suelen tener un fenotipo inestable, lo que sugiere que en cualquier momento pueden perder sus capacidades supresoras.
Finalmente, hay evidencia experimental de que с-Rel, que es un miembro de la familia de factores de transcripción NF-kВ, regula la transcripción de ҒохРЗ, sugiriendo que c-Rel actúa como un factor de transcripción en la iniciación de la transcripción de ҒохРЗ en los precursores de las células Treg en el timo, sin embargo, la evidencia no demuestra la total contundencia de c-Rel en el compromiso de los timocitos para diferenciarse a células Treg15.
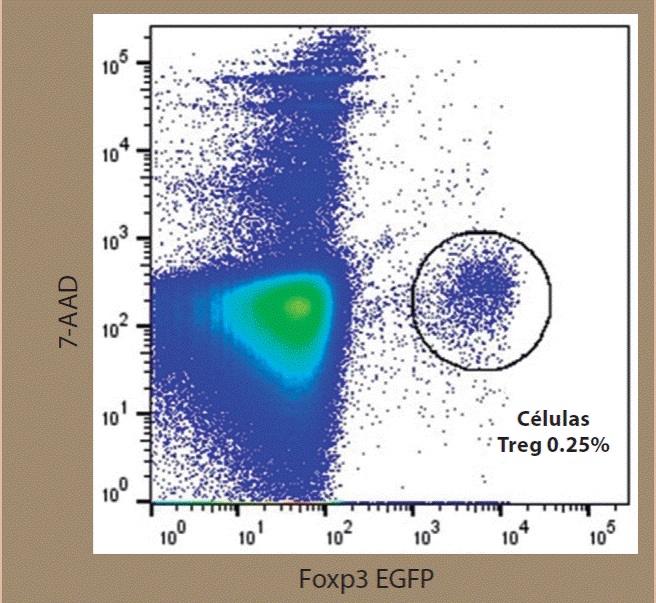
Lo anterior sugiere que el camino que lleva a la generación de células tTreg es una mezcla delicada de señales donde la combinación adecuada de avidez antigénica y señalización por citocinas genera una célula supresora con la capacidad de desarrollar un fenotipo estable y alta tolerancia a la apoptosis; esto último coincide con el de hecho de que aun cuando las células Treg se encuentran en muy baja proporción en el timo, su viabilidad es extremadamente alta (Figura 3). Es tentador especular que el hecho de que las células Treg existan en una sutil línea entre la apoptosis y la sobrevivencia, sea también un mecanismo per se de tolerancia.
Correlación de la expresión de ҒохРЗ con los estadios DN y DP
La expresión de ҒохрЗ en el timo postnatal se da principalmente en linfocitos CD4+CD8- y en menor proporción en linfocitos CD8+CD4-, pero también se ha observado su expresión junto con CTLA-4 y GITR desde la etapa en que los linfocitos son DP. De hecho, las células tTreg DP, contribuyen de manera importante en la población total de las tTreg en las simples positivas, sugiriendo que la decisión que lleva a una célula a convertirse en reguladora podría ser tomada antes de la decisión del linaje.
También se ha hecho evidente que una proporción importante de los linfocitos simples positivos TCD4+F0xP3+ en el timo pueden ser linfocitos TCD4+F0xp3+ recirculantes, ya que aproximadamente la cuarta parte de estos linfocitos simples positivos reguladores, han perdido la expresión de CD31, pero han ganado la de ICOS y Т-bet. Estas células CD4SP+ ICOS+ CD31-, expresan altos niveles de ҒохРЗ y se ha propuesto que interactúan con las células epiteliales túnicas de la médula a través de ICOS con ICOSL (ligando)11,16.
Otro factor que contribuye en la diferenciación de las células T reguladoras es el hallazgo de que los cuerpos de Hassall producen la hormona linfopoyetina del estroma tímico (TSLP), que activa a las células dendríticas mieloides que a su vez son capaces de inducir a partir de linfocitos simples positivas TCD4+ CD25- a células Treg3. Cabe recordar que la mayor parte de estos hallazgos se han hecho en ratones, debido a las limitaciones experimentales para estudiarlos en modelos humanos.
CÉLULAS Т REGULADORAS EN PROCESOS FISIOLÓGICOS
Reproducción y embarazo
Las células Treg juegan un papel importante en el mantenimiento de la tolerancia durante la gestación, pues se ha demostrado que hay un incremento del número de estas células tanto en la decidua como en circulación.
Se ha reportado también que durante la fase folicular del ciclo menstrual se incrementa el número de células Treg, mientras que en la fase lútea el número de éstas decrece, lo que sugiere que el organismo se prepara para entrar a un estado más tolerante en caso de que ocurra la fertilización.
Adicionalmente, en modelos murinos de embarazo se ha demostrado que la depleción de células Treg lleva a una interrupción de la gestación, lo que demuestra que la protección del feto a la respuesta inmune aloreactiva en la interfase materno-fetal depende en gran medida de las células Treg17,18,19.
Células T reguladoras y enfermedades
Como se menciona en la introducción, la disfunción de estas células juega un papel de primer orden en la fisiopatogenia en diversas enfermedades, o estados patológicos y citaremos varios ejemplos:
Choque séptico
En un modelo murino de choque séptico se observó un incremento en el número de células TCD4+ Foxp3+CD25+ CD127- proporcional a la gravedad del choque, lo que resultó en una disfunción de la respuesta inmune20.
Enfermedad pulmonar obstructiva crónica (EPOC)
En pacientes con EPOC, se ha reportado una correlación entre el incremento de células T reguladoras circulantes y la exacerbación de las manifestaciones clínicas. De igual manera se ha encontrado un incremento de estas células en los tejidos de pacientes fumadores con enfisema secundario. Al estudiar los folículos linfoides, se observó un incremento de ҒохрЗ, sin embargo, es probable que esta población sea en realidad de pTCD4 ҒохрЗ o Th3, ya que las células epiteliales alveolares de tipo II proveen un microambiente rico en TGFß. Al tratarse de células reguladoras inducidas, su estabilidad es menor y su capacidad reguladora podría verse afectada, en consecuencia, la respuesta inflamatoria exagerada ante partículas nocivas y gases se agravaría por un estado proinflamatorio21.
Periodontitis
Existe evidencia de la participación de las células Treg en procesos inflamatorios bucales como la gingivitis en pacientes con periodontitis y esto se ha atribuido a un desbalance entre células Treg y células efectoras tipo Тh1722.
PERSPECTIVAS
La gran información que se ha generado sobre las células Т CD4+ Foxp3+ en relación con su diferenciación, así como los mecanismos supresores sobre células autorreactivas, ha abierto un desafiante panorama en el desarrollo de nuevos tratamientos que permitan inducir tolerancia en algunas enfermedades autoinmunes. En este sentido, se han desarrollado diversos modelos para identificar clonas de células Treg específicas a autoantígenos y expandirías tanto in vitro como in vivo, así como ensayos de transferencia adoptiva23, sin embargo, los retos inherentes al sistema no se han hecho esperar y se ha descrito que detalles como la estabilidad de las células Treg, así como el número de células requeridas para las transferencias, son aún cuestiones cruciales pendientes por resolver23,24. Sin embargo, cabe recordar que la inmunología ha demostrado ser una de las ciencias básicas con mayor potencial traslacional, y es importante mantener estas células en mente, pues en pocos años seguramente serán parte de la cartera de tratamientos ofrecidos por la inmunoterapia.











 nueva página del texto (beta)
nueva página del texto (beta)