Introducción
La proliferación celular en el hígado de mamíferos se inicia por diferentes causas. Una de ellas resulta del recambio natural de células por envejecimiento, pero también a consecuencia del daño crónico por químicos o, simplemente, desencadenarse por un trauma mecánico. La respuesta de los hepatocitos maduros a la hepatectomía parcial de 2/3 de hígado en mamíferos ha sido el primer y mejor modelo para estudiar la regeneración de tejidos u órganos1-5.
Existen otros modelos de daño hepático como el inducido por el tetracloruro de carbono (CC14), el ligamiento de duetos biliares o el tratamiento con асetaminofén, que han permitido comprender mejor los mecanismos de organogénesis del hígado humano.
Las células del parénquima hepático son representadas en mayor parte por los hepatocitos terminalmente diferenciados y ocupan aproximadamente 60-70% de la masa total de hígado6. Se estima que tan sólo uno entre 20,000-40,000 hepatocitos se encuentra con actividad mitótica en el momento determinado, por lo que el hígado es considerado como un órgano quiescente3. Antes de envejecer y de ser reemplazado por uno nuevo, cada hepatocito tiene de seis a siete ciclos proliferativos7,8. Sin embargo, un daño mecánico mínimo hace que se inicie una respuesta proliferativa importante y los hepatocitos maduros, a través de uno a dos ciclos celulares, pueden restablecer al parénquima dañado8.Este evento, desde el punto de vista regenerativo, es muy exitoso9,10.
Distintos linajes celulares se ubican en zonas intrahepáticas, pero también en localizaciones extrahepáticas, como las vías biliares que se extienden hasta el páncreas y el duodeno. Estas poblaciones troncales en estado no diferenciado o poco diferenciado, responden a diversos estímulos o señales y contribuyen a la regeneración, no sólo del hígado, sino también de las vías biliares y el páncreas6,11,1
Las células troncales se encuentran en una cantidad menor en comparación con los hepatocitos maduros que constituyen el parénquima, y que residen en nichos o compartimentos específicos, distribuidos en zonas hepáticas asignadas o en vías extrahepáticas11,13,14. Diversos factores hepatotrófieos provenientes de células mesenquimales y endoteliales actúan sobre el proceso de maduración de los linajes15,16.
Identificación de las zonas del hígado y nichos de células troncales/progenitoras intrahepatics
El hígado tiene una arquitectura compleja. Las unidades llamadas acinos o lobulillos hepáticos están divididos en tres zonas: Zi, Z2 y Z3; cada una tiene células con diferentes características (Figura 1). La Z3 tiene hepatocitos llamados perivenosos debido a la cercanía con la vena central, ubicada en el centro de acino. La Z2 se conoce como medio-acinar y se conecta con la Zl, que tiene hepatocitos periportales de la región de la vena porta y del canal de Hering. La caracterización de la Zl in situ, el cultivo primario y la selección de las células aisladas desde esta zona y alrededor de los canales de Hering por reconocimiento inmune han hecho patente su capacidad de autorenovación, tal y como lo hacen las células troncales. (Figura 2)17Además de la división simétrica, los linajes de Zl pueden diferenciarse en células hepáticas tanto in vitro, como in vivo18. Ocho linajes madurativos ubicados entre la Zl y la Z3 se han descrito en el órgano interno más grande que posee el ser humano11. De tal forma que alrededor de la triada portal hepática hay células con mayor troncalidad, la que va disminuyendo en dirección hacia la vena central6(Figura 3). Los ocho linajes hallados en el hígado adulto comprenden subpoblaciones con marcadores específicos, que son característicos del desarrollo temprano o tardío (Tabla 1) y se distinguen entre sí por: la ubicación anatómica, la relación con las células de origen mesenquimal, la morfología, el tamaño, la ploidía, su expresión génica, el potencial de crecimiento y la capacidad de respuesta a señales que perciben de su entorno11,19.

Figura 2 Comportamiento de la célula troncal por división simétrica, que resulta en la autorrenovación, o en la diferenciación tejido-específica. Estos cambios ocurren como respuesta a las señales, que se originan de acuerdo con el sitio específico en el que se ubiquen estas células troncales.
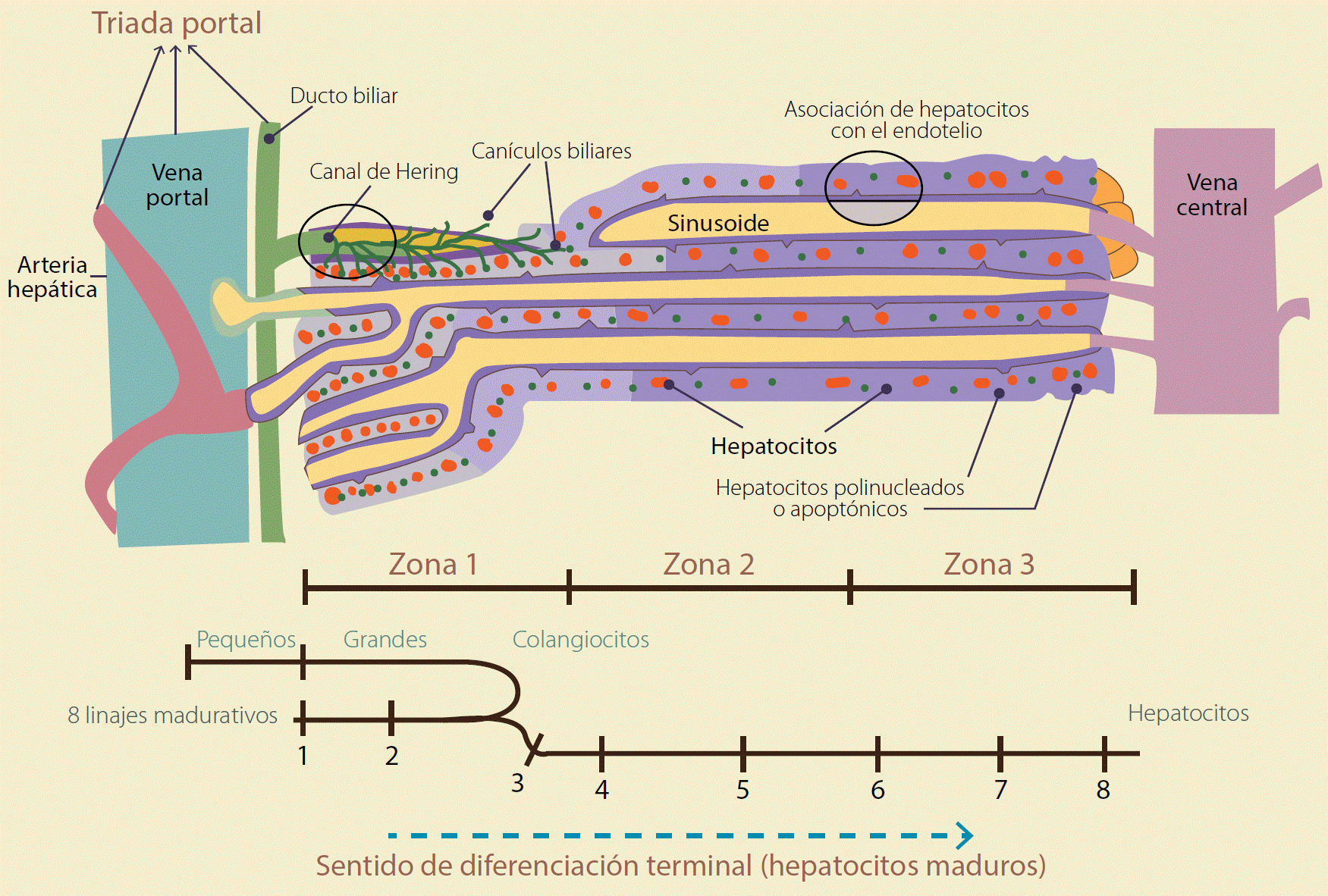
Figura 3 Representación de las zonas del acino hepático y sentido de maduración de ocho estirpes celulares del parenquima hepático. Imagen modificada de Turner y col., 2011.
Tabla 1 Marcadores específicos de células troncales/progenitoras localizadas en el hígado y en el árbol biliar del humano

En el nicho intrahepático ubicado en la Z1 y alrededor de canal de Hering se conocen, al menos, cuatro subpoblaciones de células troncales: a) multipotenciales (HpSCs, de inglés hepatic stem cells), b) hepatoblastos (HBs, de inglés hepatoblasts), c) las células progenitoras o comprometidas (CPs, de inglés committed progenitors) y d) una mezcla de células adultas que actúan en condiciones especiales y se dividen en hepatocitos/colangiocitos pequeños11,14. Cada uno de estos linajes tiene la capacidad de diferenciación en hepatocitos o colangiocitos maduros y no comparten algún marcador de angioblastos y células mesenquimales, las cuales también pueden diferenciarse en células hepáticas en condiciones especiales11,13.
En general, los linajes hepáticos con menor grado de diferenciación se inician en la zona periportal y, conforme se acercan hacia la vena central, muestran una mayor especialización. Se estima que 0.5-2% de todas células parenquimatosas de hígado son HpSCs y HBs, se ubican dentro y en la cercanía de los canales de Hering, y después del nacimiento declinan a un 0.01% (Figura 4)11,20,21.Actualmente, no se conoce dónde se originan los restantes linajes de células troncales/progenitoras del hígado.
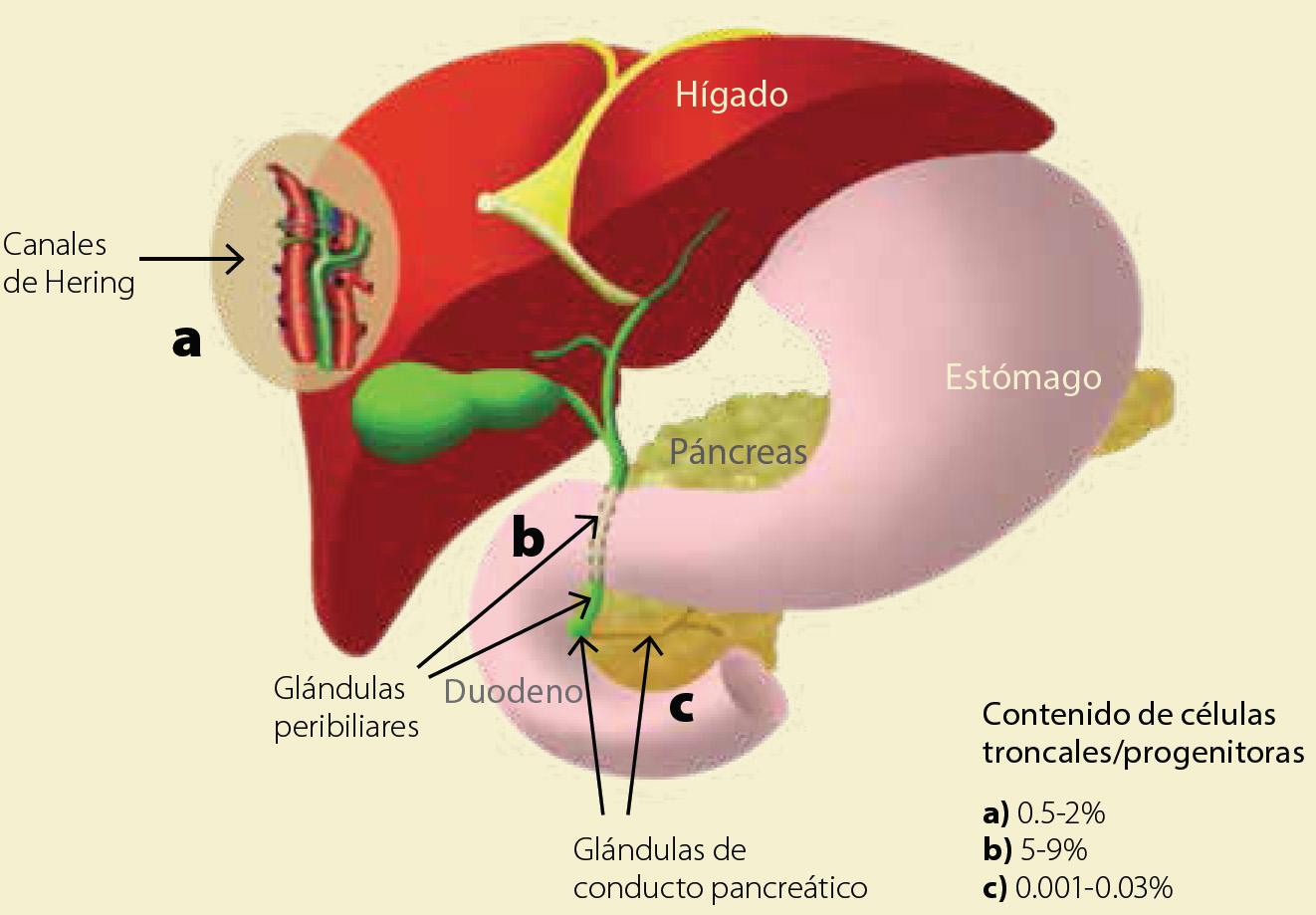
Figura 4 Tres nichos y el contenido de células troncales con la capacidad de dar origen a células hepáticas maduras.Células troncales en canales de Hering (a), en el colédoco (b) y en el conducto pancreático (c). Adaptado de https://stanfordhealthcare.org/content/dam/SHC/conditions/cancer/images/liver-cancer-diagrambiliary-system.gif
Árbol biliar y nichos de células troncales extrahepáticos
El árbol biliar se forma de una red de conductos pequeños que se inician en el parénquima hepático, éstos desembocan en la vesícula biliar y páncreas y llegan al intestino delgado (Figura 4). Existen tres compartimentos para células troncales y progenitoras exclusivos de las vías biliares. Los canales de Hering son el primer nicho, fueron descritos como tal desde hace varias décadas17 y tienen células HpSCs y HBs6. El segundo compartimento, relevante desde el punto de vista de la regeneración hepática, lo son las glándulas peribiliares. Éstas se ubican adheridas tanto por fuera, como por dentro de los duetos biliares, que se extienden hasta la base de la vesícula biliar22. No se ha reportado el contenido celular de las glándulas externas de los duetos, pero las células en las glándulas intramurales, cerca de la capa fibromuscular de los duetos biliares tanto intra y extrahepáticos son troncales (BTSCs, del inglés billiary tree stem cells) y heterogéneas, al expresar simultáneamente marcadores de hígado, páncreas y de endodermo temprano (Tabla 1). Las células BTSCs pueden migrar hacía los canales de Hering para dar origen a células troncales que tienen la capacidad de originar hepatocitos maduros, colangiocitos, así como células pancreáticas, tanto in vivo como in vitro23. Se estima que en las glándulas de los conductos biliares extrahepáticos puede haber de 5 a 9% de células troncales aproximadamente (Figura 4)25.
Por último, el tercer y más reciente nicho descrito es el de las células troncales/progenitoras en glándulas del ducto pancreático (PSCs, del inglés pancreatic stem cells)19,24. Esta población expresa marcadores de pluripotencialidad (Tabla 1) y su presencia ha sido confirmada en el páncreas de feto y del adulto en la edad geriátrica. Los recientes hallazgos arrojan entre 0.001 y 0.03% de células troncales ubicadas en las glándulas de duetos pancreáticos (Figura 4)24,26.
Conclusiones
Las células troncales y progenitoras contribuyen a la organogénesis de manera significativa durante todas las etapas del desarrollo humano. Los nichos especializados intra y extrahepáticos, tienen subpoblaciones de células capaces de dar origen a las contrapartes terminalmente diferenciadas y con funciones tejidoespecíficas. La zona periportal del lóbulo hepático tiene sólo aquellas células troncales/ progenitoras que participarían en la regeneración del hígado in situ. Mientras que a lo largo del árbol biliar existen nichos con poblaciones de células con el potencial múltiple de diferenciación, tanto hacia hepatocitos o hacia células que regenerarían el páncreas.











 nueva página del texto (beta)
nueva página del texto (beta)




