¿QUIÉNES CONSUMEN DROGAS DE ABUSO? ESTADÍSTICAS DEL USO DE SUSTANCIAS Y DEFINICIÓN DE ADICCIÓN
El Informe Mundial sobre las Drogas 2014 señaló que alrededor de 243 millones individuos (5% de la población mundial) de 15-64 años de edad consume alguna droga ilícita, de los cuales el 0.6% (aproximadamente 1 de cada 200) tiene problemas con el consumo1. En México, según el último informe del Sistema de Vigilancia Epidemiológica de las Adicciones2, la edad promedio en la que los usuarios consumen una droga de abuso por primera vez es a los 14.5 años, y la droga de inicio más frecuente es el alcohol (39-7%), seguida por la marihuana (31.1%) y el tabaco (20.8%). De la misma manera, el alcohol es la principal droga de impacto entre los usuarios (30.5%), seguido por la cocaína (17.5%), y la marihuana ocupa el cuarto lugar con un 11.5%. Según la Encuesta Nacional de Adicciones3, el consumo de sustancias ya existe en las edades de 12 años y estima que del total de la población mexicana que consume alcohol, el 6.2% padece trastorno del consumo de alcohol (ТСА).
Estas evidencias sugieren que a pesar de que todas las personas están expuestas a consumir drogas como el alcohol y la nicotina, cuyo consumo es legal, solo un porcentaje bajo es vulnerable a la dependencia a éstas o a cualquier droga de abuso. Como hemos dicho, se tiene evidencia que sugiere la existencia de una relación entre los cambios genéticos y el ambiente, que provocan disfunciones en algunos sistemas cerebrales que tornan vulnerable a un individuo a padecer dependencia a una droga de abuso.
La adicción o dependencia a sustancias de abuso, según la Organización Mundial de la Salud (OMS)4, es una enfermedad cerebral que provoca la búsqueda y uso compulsivo de la droga, a pesar de las consecuencias adversas que ésta provoque.
Según el Diagnostic and Statistical Manual of Mental Disorders V (DSM-V)5, para que un sujeto sea diagnosticado con trastorno por consumo de sustancias (TCS), debe manifestar 3 de los siguientes criterios diagnósticos: consumo riesgoso, problemas sociales o personales relacionados con el consumo, abandonar actividades que son ajenas al consumo de la droga, tolerancia a los efectos de la droga, síndrome de abstinencia cuando interrumpe el consumo de la misma, consumir grandes cantida des de la droga por largos periodos, intentos fallidos de abandonar el uso, utilizar mucho tiempo del día consumiendo la droga de abuso o en actividades relacionadas con el consumo, presentar problemas físicos o psicológicos relacionados con el consumo, renunciar a otras actividades por consumir la droga y sentir un fuerte deseo por consumirla (ansia por el consumo o craving).
¿POR QUÉ SE CONSUMEN DROGAS DE ABUSO?
Mecanismos cerebrales, el sistema de motivación-recompensa
Sentir placer cuando llevamos a cabo conductas que son críticas para nuestra existencia nos motiva a repetirlas. El placer se produce porque disponemos de un sistema cerebral que nos permite experimentarlo, el cual fue descubierto en 1954 por James Olds y Peter Milner6. Los investigadores implantaron en las ratas un electrodo para estimulación eléctrica en la zona cerebral que ahora conocemos como sistema de motivación y recompensa o de reforzamiento (Figura 1).

Figura 1 Rata implantada con un electrodo para estimulación eléctrica. a) Se muestra en un dibujo de corte sagital de cerebro de rata el lugar en donde Olds y Milner colocaron el electrodo de estimulación. b) Una rata implantada presionando la palanca de estimulación.
En este paradigma, la rata podía oprimir una palanca que activaba un interruptor que le permitía auto estimularse a través del electrodo, y era capaz de hacerlo hasta 2 mil veces en 1 hora, ignorando otros estímulos como comida, agua o sexo. Las ratas se atrevían a transitar por superficies electrificadas y soportar choques eléctricos dolorosos para conseguir la autoestimulación. Con base en estas observaciones, Olds y Milner6 llegaron a la conclusión, revolucionaria para la época, de que la conducta estaba impulsada por el placer.
Ahora sabemos que la sensación placentera que experimentamos al llevar a cabo conductas como comer, beber o tener sexo es regulada por diversos sistemas. El más estudiado es el sistema de Olds y Milner6, el sistema de motivación y recompensa, que está anatómicamente constituido por neuronas dopaminérgicas agrupadas en la llamada área ventral tegmental (AVT). Estas neuronas del AVT proyectan al núcleo accumbens (NAcc) yala amígdala (AMI), constituyendo la vía mesolímbica, y a la corteza prefrontal (CPF) constituyendo la vía mesocortical, en donde la dopamina ejerce su acción sobre los receptores dopaminérgicos DI y D2 expresados en las neuronas del núcleo accumbens y sobre terminales glutamatérgicas que llegan de otras estructuras, como la CPF y la AMI (Figura 2). Cabe señalar que no son las únicas vías dopaminérgicas en el cerebro, pero sí las importantes para el sistema de motivación y recompensa.

Figura 2 Sistema dopaminérgico. a) Principales vías dopaminérgicas en dibujo de corte sagital de cerebro humano, b) Sinapsis dopaminérgica; adicionalmente señala que el transportador de dopamina es bloqueado por cocaína facilitando la acumulación de dopamina
El AVT se activa cuando realizamos una tarea gratificante, como comer o tener sexo (al alimento y al sexo los llamaremos reforzadores necesarios, porque responden a una necesidad homeostática), consecuentemente aumenta la liberación de dopamina en el NAcc y lo activa; mientras que a la AMI, la inhibe (Figura 3)7. Este mismo sistema es activado por drogas de abuso (a las drogas las llamamos reforzadores vacíos, porque no responden a una necesidad homeostática). A diferencia de los reforzadores necesarios, las drogas de abuso activan intensamente al AVT, promoviendo una mayor liberación de dopamina y facilitando una mayor sensación placentera9,10. (Figura 3) Estas sustancias afectan al sistema de motivación y recompensa, generando una liberación masiva de dopamina asociada al consumo y una reducción en su liberación, incluso por debajo de la liberación basai al cesar el consumo11.
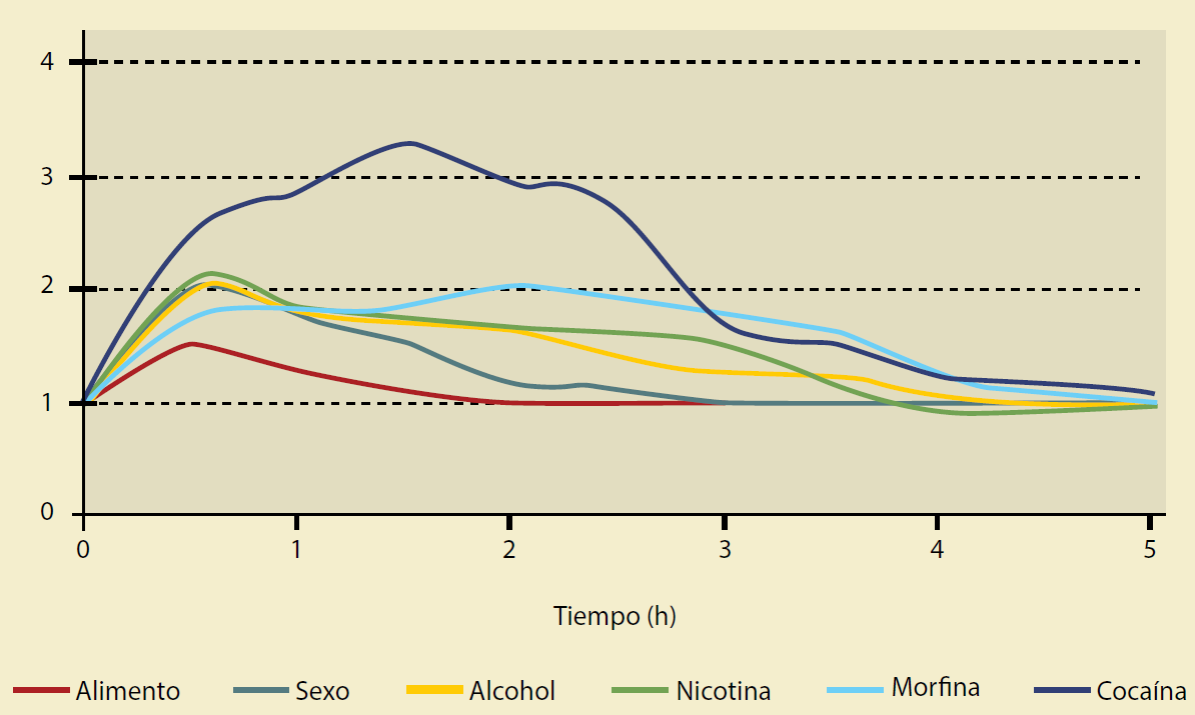
Figura 3 Liberación de dopamina en el núcleo accumbens inducido por diferentes reforzadores (necesarios y vacíos). (Modificada de Rawson R, 2016).
Durante la abstinencia del consumo de la droga se manifiesta esta reducción en la liberación de dopamina, que se ha relacionado con el estado de ánimo disfórico que afecta al usuario, que puede ser craving o síndrome de abstinencia y que frecuentemente lo obliga a consumir la sustancia de nuevo.
Con base en estudios de imagen en humanos, se ha demostrado una disminución del metabolismo basal de la glucosa en la corteza orbitofrontal, zona de la corteza prefrontal asociada a la jerarquización de los estímulos y una disminución de la expresión de receptores D 2 en el NAcc12. Estos sistemas subcorticales de motivación-recompensa están bajo la regulación cortical, particularmente de la CPF. Así que una CPF disfuncional puede ser responsable de la expresión de conductas mal adaptativas que lieven a un sujeto a la adicción13. La disfuncionalidad de la CPF puede ser producto de una carga genética o de regulación epigenética anormales.
¿QUÉ PERSONAS PUEDEN VOLVERSE ADICTAS A UNA DROGA DE ABUSO?
Personalidad adictiva
Se ha sugerido la existencia de una relación entre los rasgos de la personalidad y la vulnerabilidad a desarrollar dependencia a una droga de abuso. La mayoría de las personas predispuestas a la adicción tienen signos y síntomas definidos antes de empezar a consumir drogas. Por ejemplo, impulsividad, es decir, responden a un estímulo sin reflexionar y sin que anticipen las consecuencias de sus respuestas.Tienen dificultad para establecer y seguir planes,así como una actitud de urgencia y conductas autolesivas no suicidas. También exhiben un pobre control de la atención, por lo que pierden fácilmente el interés en un objetivo o una meta. Agresividad, responden fácilmente con violencia a estímulos a los que la mayoría de las personas no responde de esta manera. Hay varias entidades nosológicas psiquiátricas que presentan algunos de estos signos y síntomas, o todos. Por ejemplo, de las más frecuentemente asociadas son la psicopatía y la sociopatía14. También el trastorno de déficit de atención con y sin hiperactividad, el trastorno bipolar y el trastorno limítrofe de personalidad, entre otras. La comorbilidad de uno o más de estos trastornos psiquiátricos y el TCS es más la regla que la excepción15,16. El sujeto que padece TCS frecuentemente está involucrado en actos delictivos ya sea porque sufre de síndrome de abstinencia y su ansiedad lo lleva a cometerlos para conseguir los medios para obtener la droga, o porque su trastorno psiquiátrico lo orilla. La mayoría de las veces es su psicopatía o sociopatía la que de alguna manera lo obliga a la comisión de dichos actos17. Los psicópatas y sociópatas tienen una personalidad adictiva; es decir, son proclives al consumo de drogas de abuso18,20.
En modelos animales, se ha observado que las cepas de ratas clasificadas como impulsivas mediante la tarea de descuento por retraso (TDR, delay discounting task) consumen más alcohol que las no impulsivas21. Asimismo, mediante la TDR Perry y cois.22 catalogaron a las ratas en altas y bajas impulsivas, posteriormente las sometieron a un procedimiento de autoadministración de cocaína, y encontraron que el 80% de los sujetos del grupo de ratas con altos niveles de impulsividad adquirieron la conducta de autoadministración, mientras que en el grupo de ratas con bajos niveles de impulsividad sólo el 20% de los sujetos adquirieron dicha conducta. Este experimento adicionalmente resalta un hallazgo frecuente: no todos los impulsivos desarrollan adicción. En este estudio el 20% de los impulsivos no desarrollan gusto por la cocaína. Un fenómeno por demás interesante, ya que podemos constatar la existencia de resiliencia, que es la capacidad de superar la adversidad e incluso salir fortalecido23.
El sustrato neuroanatómico del control de la expresión de la conducta se encuentra en el sistema de inhibición de la conducta, cuya función es inhibir impulsos y tendencias de respuesta. Se ha propuesto un modelo que explica el control de la inhibición de la conducta a través de la comunicación corteza prefrontal-núcleos de la base-tálamo-corteza.
La corteza frontal se comunica con estructuras subcorticales para el control de la conducta. Esta comunicación puede ocurrir de 3 formas. La vía directa, en donde la corteza frontal envía señales excitadoras (glutamato [GLU]) al núcleo estriado (STR); el STR inhibe (ácido gammaminobutírico [GABA]) al globo pálido interno (GPI o entopeduncular [de aquí en adelante nos referiremos a éste como ЕР]) y a la sustancia negra pars reticulata (SNr) y entonces la respuesta se da. La vía indirecta, parte de la corteza frontal (GLU) y excita al STR. El STR inhibe (GABA) al globo pálido externo (GPE), el cual normalmente inhibe al EP. En esta condición ya no lo inhibe, por lo que el EP (GABA) se libera e inhibe al tálamo y la respuesta no se da. Finalmente, la vía hiperdirecta muestra que la excitación proveniente de la circunvolución frontal inferior derecha (rIFC, GLU) excita al STN. Éste a su vez excita al ЕР y éste consecuentemente inhibe al tálamo y la respuesta no se da24,25. La vía hiperdirecta, con menos sinapsis, es más rápida y resulta más eficiente para inhibir una conducta. Se ha demostrado que la disfunción de la rIFC se relaciona con trastornos en la inhibición de la conducta. Аron y cois.26 encontraron en humanos una relación directa entre el tamaño de la lesión en la rIFC que ocurrió por traumatismo o evento vascular cerebral y la impulsividad medida con una tarea llamada tarea Go/No-Go.
Por otro lado, el EP que es preferentemente GA-BAérgico, también tiene neuronas GLU, las cuales se comunican con un núcleo del mesencèfalo llamado habénula lateral (HbL) activándola27,28. LaHbL es glutamatérgica y está comunicada con la región caudal del área ventral tegmental (tVTA/RMTg, GABA), la cual proyecta a la región rostral del VTA y a interneuronas GABAérgicas dentro del mismo VTA. Como ha sido ampliamente descrito, el VTA proyecta al NAcc y forman la vía fundamental del sistema de motivación y recompensa29. EL circuito HbL-tVTA se ha involucrado con el proceso de valorar el reforzador, por ejemplo, cuando el reforzador es desagradable la HbL se activa y la conducta de búsqueda no se da; al contrario, si es placentero la HbL se inhibe y la conducta de búsqueda se da30. Ante la competencia de reforzadores, parece que la HbL inhibe la conducta de adquisición del reforzador menos apetecible para la obtención del que se le asigna más valor31,32. Estas evidencias proveen nuevas herramientas que nos permiten entender las bases de el o los sistemas que regulan las conductas motivadas.
Este circuito neuronal requiere de la participación de diversos transmisores, por ejemplo, GABA, GLU y dopamina (DA). Adicionalmente, desde hace más de una década, estudios de autoradiografia realizados en cerebros de humanos revelaron una alta concentración del receptor a canabinoides 1 (CB1) en estos núcleos, particularmente en el GPI33. También se ha demostrado que existen receptores CBl en las terminales de células GABAérgicas en el VTA provenientes de TVTA y se sugiere la presencia de éstos en las terminales glutamatérgicas de la HbL que proyectan a tVTAy a las interneuronas del mismo VTA34. En nuestro laboratorio hemos observado que bloquear la actividad del receptor CB1 en el EP de la rata, mediante la administración del antagonista AM251, favorece el consumo de alcohol; mientras que la administración del agonista endógeno anandamida, la disminuye35. Esta evidencia sugiere una función del CB1 en los mecanismos que subyacen el control de las conductas motivadas.
La CPF es considerada la región cerebral de integración, gracias a la información que envía y recibe de prácticamente todos los sistemas sensoriales y motores, y por lo tanto se encarga de las funciones ejecutivas36,37. Entendiendo como función ejecutiva al conjunto de habilidades cognitivas que permiten la anticipación y el establecimiento de metas, la formación de planes, la autorregulación de las tareas y la habilidad de llevarlas a cabo eficientemente. Cabe señalar que la maduración de las funciones ejecutivas ocurre durante la infancia y la adolescencia38. La mayoría de las personas alcanza una capacidad ejecutiva similar a la observada en el adulto a principios de la segunda década de vida; sin embargo, los procesos de maduración pueden ser más lentos en algunas personas y prolongarse hasta los 30 años y en algunos hasta más tarde39. Esta capacidad ejecutiva del adulto mantiene una meseta que algunos autores sugieren que declina en la tercera edad40.
La CPF se desarrolla lentamente. El desarrollo cerebral es un proceso prolongado, complejo y sensible que involucra la interacción de factores genéticos y ambientales (experienciales) que dan forma al cerebro y en última instancia al comportamiento, proveyendo la oportunidad de modificar continuamente las funciones cognitivas, pero también genera vulnerabilidad a la formación de circuitos anormales que comprometen la conducta. Se ha observado que el cerebro es especialmente vulnerable a las experiencias que ocurren durante la infancia y la adolescencia.
¿EL MEDIO AMBIENTE AFECTA AL INDIVIDUO?
Cambios epigenéticos inducidos por el cuidado materno
La adaptación al entorno es un proceso fundamental de los seres vivos, para el que se requiere mecanismos dinámicos que permiten realizar cambios relativamente rápidos en respuesta a los estímulos medioambientales. El principal mecanismo de adaptación que subyace a la adaptación en la mayoría de los seres vivientes es la epigénesis (del griego epi: 'sobre'; génesis: 'generación', 'origen', 'creación') y se refiere a la regulación de la expresión de los genes sin afectar la secuencia del ácido desoxirribonucleico (ADN)41.
Estudios realizados por Meany y Szyf42, sugieren que la expresión frecuente de la conducta materna (lamido y acicalamiento [licking and grooming]) aumenta la expresión del receptor a glucocorticoides, generando crías que regulan la respuesta a un estresor más adaptativamente (poco ansiosas) cuando son adultas. Lo contrario ocurre con las crías de ratas que estuvieron expuestas al cuidado materno de forma menos frecuente. Éstas exhiben una respuesta exagerada al estresor (son ansiosas) y cuando son forzadas a resolver pruebas de aprendizaje y memoria, exhiben menos eficiencia43. De la misma forma, se ha demostrado que la frecuencia con que una cría recibió la expresión del cuidado materno correlacióna negativamente con la cantidad de cocaína que consumen cuando son expuestas a ésta44. Lo mismo ocurre con el consumo de alcohol y anfetaminas45,46. Por lo tanto, los meanismos epigenéticos que regulan el funcionamiento de los sistemas que regulan el estrés (ΗΡΑ), el aprendizaje y la memoria (hipocampo), y la motivación-recompensa (NAcc, el AVT y la CPF) parecen sensibles a los estímulos proporcionados por el cuidado materno. Hay evidencias que sugieren que una de las estructuras más sensibles a la modulación epigenética es la CPF47,48. Esto es debido a que, como ya mencionamos, la CPF tiene un proceso largo de maduración, por lo que si no recibe los estímulos medioambientales adecuados para alcanzar su desarrollo, presentará un desequilibrio en sus sistemas de neurotransmisión. Probablemente el sistema endocanabinoide (seCB) de la CPF sea uno de los blancos de la modulación epigenética que, si termina siendo disfuncional, participe en la generación de la a la adicción.
¿SISTEMA ENDOCANABINOIDE (SECB)?
Actualmente el seCB es uno de los sistemas de mayor interés en el área de la salud debido al creciente conocimiento de su implicación en la regulación de los procesos fisiológicos y su involucro en el desarroIlo del TUS. Los endocanabinoides más estudiados son la anandamida (AEA), el 2 araquidonil glicerol (2-AG) y la oleamida (ODA). Los principales sitios de unión son los receptores a canabinoides CB1 y CB2, aunque hay otros receptores que son activados por estos ligandos endógenos. De estos receptores, el más estudiado es el CB1, que tiene una amplia distribución en el Sistema Nervioso Central (SNC), incluyendo: CPF, hipocampo, hipotálamo, cerebelo, amígdala, EP, HbL, entre otros. El CB1 se expresa principalmente en los botones presinápticos de las células GABAérgicas y glutamatérgicas. Está acoplado a una proteína G inhibidora49, y al activarse inhibe la liberación del neurotransmisor.50 Por otro lado, se ha descrito que el CB2 también se expresa en el SNC y se le ha relacionado con los mecanismos que regulan el consumo de cocaína y nicotina. De hecho, la activación de este receptor reduce la búsqueda de cocaína51. Los endocanabinoides se sintetizan y liberan en respuesta a la activación de la neurona. Es decir, no se almacenan en vesículas como los neurotransmisores clásicos, sino a demanda, sugiriendo que se producen en momentos de intensa actividad del SNC. Anandamida y 2-AG se sintetizan en la membrana celular a partir del ácido araquidónico; mientras que la oleamida se sintetiza a partir de ácido oleico. Hay enzimas que los sintetizan y enzimas que los degradan52,53.
Diversos estudios describen la función del seCB en las adicciones. Se ha demostrado que los niveles endógenos de anadamiday 2-AG aumentan después de que los animales de experimentación (ratones) han sido expuestos de manera crónica al consumо de alcohol54. Adicionalmente, se ha observado que los ratones carentes del CB1 (KOCB1) muestran una reducción en el consumo voluntario de alcohol en comparación con los ratones control, y son incapaces de desarrollar condicionamiento de preferencia de lugar (CPP) inducida por alcohol54. Mientras que la preferencia por el alcohol disminuye después de bloquear al receptor CB1 con AM25155. Asimismo, hemos demostrado que la anandamida y la oleamida son capaces de inducir CPP por sí solas, cuando se administran directamente al NAcc. El CPP inducido por alimentos apetitosos como arroz inflado sabor chocolate o papas fritas saladas, disminuye con el bloqueo del CB1 con AM251, sugiriendo que este sistema también regula la sensación placentera inducida por reforzadores necesarios56.
En nuestro laboratorio observamos que la expresión del receptor CB1 en el NAcc de la rata adolescente y de la rata vieja está reducida en comparación con la rata adulta; las adolescentes también tienen reducido el CB2 en comparación a las adultas. En la CPF, la rata adolescente tiene reducida la expresión del CB1 y CB2 en comparación con la adulta y vieja. Esta baja expresión del CB1 y CB2 puede explicar cierta impulsividad que las adolescentes exhiben cuando se les da a elegir entre un alimento regular entregado inmediatamente y uno apetitoso entregado con demora, sugiriendo una toma de decisiones poco eficiente. Asimismo, hemos demostrado que el bloqueo del CB1 con AM251 en el EP, favorece el consumo de alcohol en la rata, mientras que la activación del CB1 con anadamida disminuye el consumo57. Por lo tanto, las evidencias indican que el seCB tiene una función en el control de la inhibíción de la conducta y su desregulación puede llevar al consumo de una droga de abuso.
Para ampliar la idea de que el seCB participa en la conducta de búsqueda y consumo de sustancias de abuso, se han hecho estudios en los que se ha demostrado que las ratas entrenadas a autoadministrarse sustancias de abuso, como la cocaína, reducen la búsqueda de ésta droga una vez que se les bloquea el receptor CB1 con el antagonista SR141716A (rimonabant)58. De la misma forma, la preferencia por el alcohol en ratas disminuye significativamente con la administración del SR141716A". Asimismo, los ratones que no expresan el receptor CB1, al ser entrenados a autoadministrarse cocaína, muestran una pobre preferencia por la droga cuando se comparan con los ratones que sí lo expresan59.
Por otro lado, se sabe que la marihuana (Cannabis sativa) y su principal componente activo el delta-9-tetrahidrocanabinol (А9-ТНС) al activar al CB1 aumentan la liberación de DA en el nace, y asociado a ello puede aumentar la ingestión de alimento60. Asimismo, la anandamida también favorece la ingesta de alimento61. En nuestro laboratorio hemos demostrado que el antagonista AM251 previene el condicionamiento de preferencia de lugar inducido por alimentos apetitosos, dulces (arroz inflado sabor chocolate) o salados (papas fritas), sugiriendo que el seCB regula la valencia de la emoción asociada al acto de comer62. Uno de los descubrimientos más importantes en la era de la investigación de canabinoides fue el efecto anoréxico inducido por el SR141716A en humanos. Este antagonista del CB1 previene la hiperfagia observada en pacientes con obesidad mórbida y disminuye la ingestión de alimento basal63.
Con base en la evidencia presentada podemos proponer que además de contar con un sistema de motivación-recompensa regulado por dopamina, contamos con otro que amplifica la sensación placentera que tenemos al consumir un alimento, llevar a cabo una conducta sexual o consumir una droga de abuso. El seCB regula en gran medida la sensación subjetiva de placer, por lo que su activación por sustancias de abuso promueve la dependencia a ésta.
CONCLUSIONES
La adicción o dependencia a sustancias es un problema mundial, pero limitada a un tipo de población (4-8%). Sin embargo, es un problema que preocupa a un porcentaje alto de proveedores de salud y a algunos usuarios que han sufrido consecuencias adversas de esta enfermedad. Por ello, la descripción de los mecanismos cerebrales involucrados en la vulnerabilidad a la adicción es crucial. Aquí sólo nos hemos avocado a 2 mecanismos: la falta de integridad de la CPF y la relación desventajosa del individuo con el medio ambiente. Asimismo, hemos propuesto que el seCB, particularmente en la CPF y en el sistema de motivación y recompensa, puede ser parte de estos mecanismos que se alteran. Conocer a detalle estos mecanismos nos permitirá plantearnos estrategias que nos faciliten identificar a los individuos vulnerables al TCS y generar herramientas farmacológicas y terapias conductuales que nos permitan prevenir las adicciones o rehabilitar al paciente cuando éste lo solicite.











 nueva página del texto (beta)
nueva página del texto (beta)



