INTRODUCCIÓN
Los marcadores tumorales son indicadores bioquímicos que pueden ser cuantificados en sangre y orina. Algunos marcadores se encuentran normalmente en etapas embrionarias y fetales, sin embargo, cuando hay alteraciones tumorales su concentración se incrementa, y por ello son muy importantes en medicina. Recientemente ha aumentado el número de marcadores, y entre ellos encontramos el glipican 3, que es una proteína oncofetal; los antígenos MAGE-A3, utilizados para el diagnóstico de melanoma, y los marcadores NY-ESO-1 y SSX-2, para carcinoma in situ testicular. Algunos marcadores también se sobreexpresan en pacientes con hepatoma celular, al igual que la telomerasa de la transcriptasa inversa (TERT)1. En este escrito nos referiremos en especial a la alfa-fetoproteína (AFP), ya que se le considera el marcador “universal” para el hepatoma celular.
La AFP fue descubierta por Abelev en 19632. Esta glicoproteína se produce en el humano durante el desarrollo fetal en el hígado fetal y el saco vitelino. El hígado se convierte en la principal fuente de AFP, ya que el saco vitelino degenera en el segundo trimestre. La concentración de esta proteína en el suero del feto es muy alta (1-10 mg/ml), y durante el segundo trimestre del embarazo es en promedio de 30 mg/ml, además, la AFP tiene afinidad por el oxígeno y tiene un papel importante en el transporte de éste, remplazando la función de la hemoglobina fetal. Posteriormente es secretada a la circulación fetal y, finalmente, localizada en el líquido amniótico en concentraciones de entre 7 y 20 µg/ml, durante las semanas 14 y 16 del embarazo.
La síntesis de AFP declina gradualmente y desaparece de 6 a 12 meses después del nacimiento3,4, cuando se inicia una mayor síntesis de albúmina sérica. Se ha sugerido que una función importante de la AFP durante la gestación podría estar relacionada con la supresión de la respuesta inmune de la madre durante el desarrollo del embrión5.
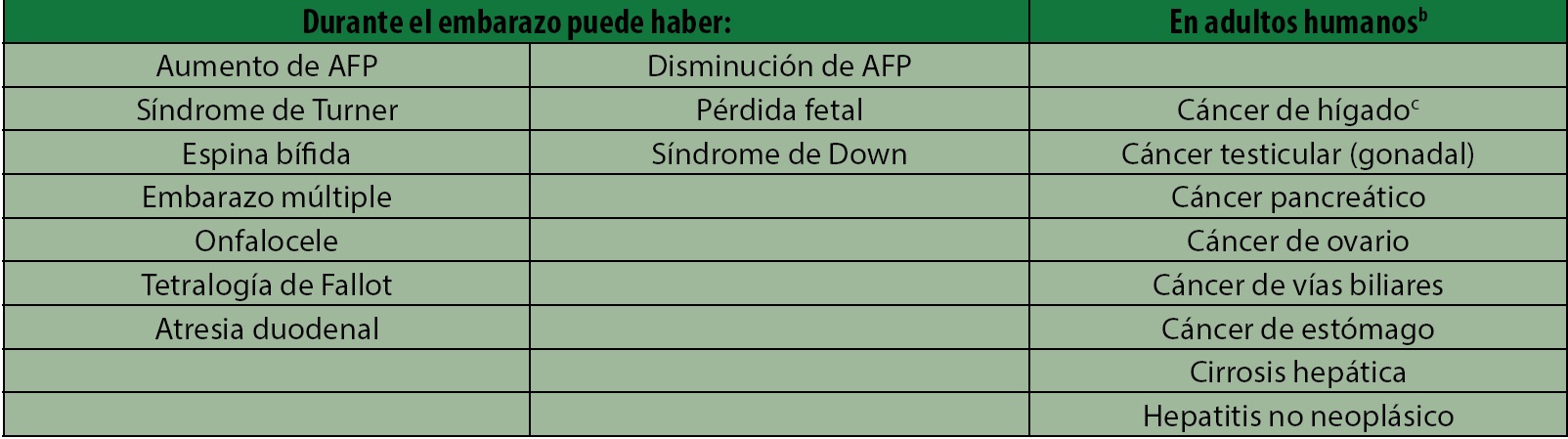
Se ha identificado que la variación en el contenido y en las características estructurales de esta proteína en el recién nacido puede ser de utilidad para la detección de anomalías y malformaciones fetales, incluyendo el síndrome de Down, el síndrome del tubo neural abierto, la espina bífida y los tumores del saco vitelino6. En el adulto, cuando el nivel sérico de la AFP es alto, es un marcador útil para detectar enfermedades neoplásicas, por ejemplo, el carcinoma hepatocelular y el teratoma testicular, entre otros tipos de cáncer7 (tabla 1).
Propiedades de la AFP
El gen de la AFP se localiza en el cromosoma 4 en la región 4q11-q22, es una proteína de 69 a 70 kDa, que consiste de una cadena polipeptídica de 590 residuos de aminoácidos y un contenido de carbohidratos de entre 3.0 a 5.0%. La vida media de esta proteína es de 5 a 7 días. La AFP es miembro de una familia multigénica, de gran homología con la albúmina, incluida la masa molecular similar que varía entre 65 a 70 kDa. Esta familia consiste de 4 miembros que son: la albúmina, la proteína de unión a la vitamina D, la proteína α-albúmina y la AFP; esta familia se caracteriza por presentar residuos de cisteína que se pliegan y unidos por puentes disulfuro, lo que da por resultado 3 dominios, como se muestra en la figura 1.
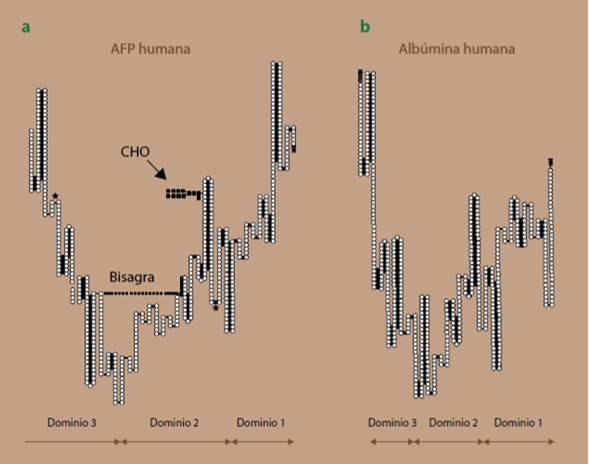
Figura 1 Configuración molecular de la AFP y la albúmina. En la AFP existen 15 puentes disulfuro ( ), que generan una estructura plegable de 3 dominios de repetición y un sitio N-glicosilación (CHO). En comparación con la albúmina humana, hay 39% de conservación de la estructura primaria. En la AFP observamos la bisagra que une al dominio 2 con el dominio 3 (------). La similitud sobresaliente es en el dominio 3 y el más bajo en el dominio 1. Los asteriscos ( *) indican los giros beta de la AFP. La albúmina no contiene carbohidratos. Figura modificada de las referencias 8 y 11. AFP: alfa-fetoproteína; CHO: células de ovario de hámster chino.
Dentro de esta familia, únicamente la AFP y la proteína de unión a la vitamina D están glicosiladas. Aunque la AFP y la albúmina humanas son similares en estructura general, además de contener carbohidratos hay ciertas partes de las moléculas que las diferencian, principalmente en su estructura secundaria, además de que la AFP es una glicoproteína que posee una bisagra que une a los dominios 2 y 3, y que confiere cierta plasticidad y facilita la interacción con otras moléculas. La unión con diversos ligandos depende del bajo grado de dispersión electrónica, ausente en la albúmina y que, a diferencia de esta última, la AFP no posee sulfidrilos libres. De acuerdo a sus características bioquímicas y estructurales, en la tabla 2 se resumen las principales homologías entre las proteínas de la familia albuminoide, de la que la AFP y la albúmina son los principales exponentes8-10.
Tabla 2 Propiedades estructurales y bioquímicas de las proteínas de la familia albuminoide

AFP: alfa-fetoproteína. En humanos, los 4 genes albuminoides se localizan en tándem en el cromosoma 4, en la región 4q11-q228.
Isoformas de la AFP
Recientemente, se ha incrementado el interés por la química, la bioquímica y la biología de carbohidratos, que es el estudio de los glicanos unidos covalentemente a proteínas. El estudio del valor biológico de los glicanos había quedado muy por detrás del estudio de otras moléculas, probablemente debido a su complejidad estructural o a las limitantes para determinar fácilmente su estructura primaria y a que en su biosíntesis participan diversos factores genéticos asociados a la participación de glicosiltransferasas, glicosidasas, isomerasas, etc. Por lo que el desarrollo de nuevas tecnologías, para explorar las estructuras de estas cadenas de azúcar ha abierto una nueva frontera de la biología: la glicobiología, que desde 1980 hasta la fecha ha tenido un gran crecimiento en el campo de las ciencias biomédicas, con relevancia para la investigación básica, biomedicina y biotecnología. La glicosilación de proteínas es la forma más compleja de modificación de biomoléculas que existe; los caminos de la glicosilación ocurren en 3 compartimentos celulares: el citosol, el retículo endoplásmico y el aparato de Golgi14.
Los azúcares no se encuentran en la plantilla del ácido desoxirribonucleico (ADN), pero sí son dependientes del procesamiento de las enzimas que participan en la glicosilación, como son las glicosidasas y las glicosiltransferasas, presentes en el retículo endoplásmico y el aparato de Golgi14. Este procesamiento se efectúa tanto en individuos sanos como cuando hay alguna patología, como el hepatoma, entre otras. Estas enzimas se encuentran en diferentes tejidos, en el caso de la AFP sus isoformas son dependientes de su localización, por ejemplo, la AFP del saco vitelino difiere de la de origen hepático15. Esto sugiere que también hay diferencias cuantitativas y cualitativas en las enzimas de la glicosilación en cada microambiente tumoral que favorecen isoformas (conocidas como glicoformas). Asimismo, las enzimas involucradas en la síntesis y catabolismo de los carbohidratos que se unen a la proteína, como las glicosiltransferasas y las glicosidasas, probablemente se puedan usar también como biomarcadores para el cáncer.
Las glicoformas pueden clasificarse en subconjuntos restringidos de glicoproteínas. Desde los años sesenta se han usado a las lectinas de plantas como valiosas herramientas en la investigación biomédica, ya que son proteínas o glicoproteínas variables y universales de origen no inmune y debido a sus interacciones con el receptor-ligando a glicanos sobre superficies celulares, las lectinas están implicadas en varios procesos biológicos16.
El uso de las lectinas ha permitido dilucidar algunas características estructurales de la porción glicosídica de la AFP. Fue en los años ochenta que se demostró la existencia de las isoformas de la AFP14. De acuerdo a sus características de glicosilación y su reconocimiento por lectinas como la aglutinina de Lens culinaris (LCA), que reconoce α-manosa y es específica por reconocer estructuras N-glicosídicas en la asparagina 232 en el dominio 2 de la AFP (figura 2), se han identificado 3 variantes principales de AFP. Estas 3 glicoformas son denominadas AFP-1, AFP-2 y AFP-3. La AFP-1 no reacciona con LCA. La AFP-2 tiene una afinidad intermedia a LCA, y la AFP-3 es la fracción que se une a LCA. Existen evidencias que sugieren que la expresión de alguna de estas glicoformas está en estrecha relación con el tejido que las sintetiza, tal es el caso de AFP-1, que se presenta en hepatitis crónica, en cirrosis, y constituye una fracción grande en el total de AFP en las enfermedades no malignas del hígado. La AFP-2 deriva de los tumores de saco vitelino y puede detectarse en el suero materno durante el embarazo. La AFP-3 es un marcador tumoral en hepatoma celular y es reconocida por LCA, teniendo un residuo adicional de α1-6 fucosa que se une a N-acetilglucosamina por medio de la enzima fucosiltransferasa 8 (Fut8), que es necesaria para producir el núcleo fucosilado de las AFP. Estas modificaciones parecen ser características de células cancerosas14,16. En estudios realizados en humanos, se encontró que la AFP-3 puede detectarse en el suero de aproximadamente el 35% de los pacientes con hepatoma celular en tumores < 2 cm17. Esto sugiere que la AFP-3 tienen un potencial muy rápido para detectar a distancia el crecimiento y metástasis de los hepatomas.

Figura 2 N-glicanos reconocidos por las lectinas de Concanavalina A (ConA) y Lens culinaris (LCA). a) Se remarca el núcleo trimanosídico reconcido por la lectina de ConA. b) Se muestra (subrayado) las sustituciones lactosamínicas en el núcleo trimanosídico que interfieren con el reconocimiento de la lectina ConA y no afecta la interacción de la lectina de LCA con estas estructuras30.
Además de la LCA, se han usado otras lectinas para demostrar las variantes de las AFP (tabla 3) como son Concanavalina A18 y Pisum savitum19, específicas para D-manosa. También se han hecho estudios con las lectinas Ricinus communis20 y Viscum álbum21, con especificidad para D-galactosa, esta unión se efectúa en la penúltima galactosa de los glicanos de la AFP. Como se identifica en la tabla 3, la ausencia de estructuras glicosiladas de tipo mucina con galactosa y N-acetil-galactosamina, es confirmada por la ausencia de reconocimiento de la lectina de cacahuate (PNA). Estudios hechos por varios autores han demostrado que al trabajar con AFP proveniente de pacientes con diferentes tumores como hepatoma celular, líquido amniótico (columna bífida), cáncer de intestino, entre otros, encontraron que hay cambios en los carbohidratos de la AFP17, es decir la glicosilación se altera.
Tabla 3 Las primeras 3 de las lectinas son las más usadas para demostrar las glicoformas de AFP y poseen en común especificidad para D-manosa

AFP: alfa-fetoproteína
Existen diferentes estudios que apoyan que la AFP es una glicoproteína versátil, ya que participa en: la proliferación de células NIH/3T3, que son de la línea celular de fibroblastos de embrión de ratón, para comprobar esto, incubaron in vitro estas células marcadas con timidina tritiada en presencia de AFP por 24 horas y se identificó incremento de la incorporación de ese marcador radioactivo en las células NIH/3T3, sugiriendo que la AFP favorece la proliferación celular en forma dependiente de la dosis22. Otro grupo uso la línea celular Bel-7402 (hepatoma celular, productora de AFP) y determinaron el incremento de la proliferación celular23. Se ha demostrado también que la AFP tiene capacidad de inducir apoptosis en las células BeI-7402, sin embargo en las células HLE que son de una línea celular de hepatoma, que no producen AFP no hay inducción de apoptosis, sugiriendo con esto que la AFP, también regula señales de muerte celular programada24.
También se ha demostrado que la AFP es capaz de interactuar con los macrófagos e induce que haya disminución de su actividad fagocítica25, de la misma forma regula la expresión de moléculas del complejo principal de histocompatibilidad (Ia en el ratón)26. Además, la AFP inhibe la actividad de las células asesinas naturales (NK)27.
En 2005, mediante ensayos en co-cultivo de células BeI-7402 y Jurkat (línea celular de linfocitos T humanos), se demostró que la AFP puede promover el escape de células de hígado de la vigilancia inmunológica, ya que al bloquear la señal de la caspasa 3 en las células BeI-7402 se impide la fase de ejecución de la apoptosis y no se desencadena la interacción de Fas/Fas L que son moléculas inductoras de la apoptosis28. Hay estudios que sostienen que las células dendríticas tratadas con AFP inducen bajos niveles de IL-12 y TNF-α, un patrón de citocinas que impiden la eficiente respuesta inmune antitumoral29. Estos resultados sugieren que el carcinoma hepatocelular escapa del control inmunológico y además, muestran que la AFP no tiene funciones solamente en el útero y como marcador de alteraciones fetales y de cáncer.
Hepatoma celular (HCC)
Los antígenos oncofetales son moléculas presentes en tejidos embrionarios normales, que dejan de expresarse durante la maduración fetal. En la transformación maligna de diversos tumores, éste tipo de antígenos, como el carcinoembrionario o la AFP, se pueden expresar asociados a la membrana celular de los tumores o pueden ser secretados al torrente circulatorio y ser considerados como marcadores con valor diagnóstico7,31.
El hepatoma celular es la tercera causa de mortalidad por cáncer a nivel mundial, además de uno de los problemas más importantes de salud, en la distribución geográfica se observa una mayor concentración en regiones específicas de Asía y África en donde hay una recurrencia de 150 casos por cada 100,000 habitantes. Hay estudios que muestran que la fracción AFP-3 es la glicoforma que se encuentra en pacientes con HCC y los niveles no dependen del tamaño o número de tumores, metástasis o recurrencia16. Debido al alto número de casos en los que se ha identificado a AFP en este carcinoma, éste marcador puede utilizarse de manera específica para el tratamiento temprano, además de los biomarcadores HSGGT (isoenzima glutaril transferasa) o el factor transformante del crecimiento (TGF-β1), entre otros32.
El organismo responde a la presencia de células tumorales por mecanismos de inmunidad tanto innata como adquirida, considerando que también hay mecanismos de evasión tumoral. La AFP es un antígeno oncofetal con propiedades inmunoreguladoras intrínsecas y, en el caso de HCC, este es un antígeno de tumor33. Se ha sugerido que en algunos tumores tales como hepatoma celular o adenocarcinomas, entre otros, la concentración de AFP se sobre expresa y puede activar e incrementar la expansión de células Treg inducibles (linfocitos T reguladores inducibles [LTr])34.
Dentro de las células que conforman la respuesta inmune, encontramos a los linfocitos T reguladores CD4+ CD25+FOXP3+, que representan del 5 al 10%35 de los linfocitos TCD4+ en humanos sanos, son una subpoblación especializada de linfocitos T que actúa suprimiendo la activación del sistema inmunitario, manteniendo así la homeostasis de este sistema y favoreciendo la tolerancia hacia auto antígenos. Resulta interesante resaltar el efecto favorecedor de la diseminación del cáncer, que estas células T CD4+CD25+FOXP3+ pueden ocasionar al suprimir la respuesta inmune36. Recientemente, diferentes grupos de investigadores han aislado varios péptidos inmunodominantes (epitopos), derivados de AFP y analizado su efecto en cultivos celulares37,38. Mizejewski39 propone que en la célula tumoral hay un receptor para AFP del tipo mucina. Sin embargo, el mecanismo por el cual los LTR se incrementan en presencia de AFP en individuos con hepatoma celular no ha sido bien caracterizado y por lo tanto está sujeto de intensa investigación.
Conclusión
Las evidencias presentadas sugieren que la participación de la AFP como marcador en la detección de cáncer hepático es amplia, como también en los procesos inmunológicos, esto nos hace pensar que existen receptores en los linfocitos T reguladores para alguna de las glicoformas de la AFP cuando esta se sobreexpresa y estimula a la población de los LTr, durante la formación de un tumor. Se considera que el receptor para la AFP en el tumor no es “universal” y el sitio de N-glicosilación es un punto importante. Con el uso de las lectinas, que tienen afinidad por carbohidratos, se pueda aislar el receptor que debe estar en la membrana de los linfocitos LTr, para la AFP y tener una prueba de diagnóstico temprano ya que hay tantos casos de cáncer y como hemos visto anteriormente la AFP es una molécula que participa en varios procesos biológicos.











 nueva página del texto (beta)
nueva página del texto (beta)