Microcosmos y macrocosmos son un antiguo esquema neoplatónico que considera que los mismos patrones se reproducen en todos los niveles del cosmos, desde la escala más pequeña (niveles subatómicos) hasta la escala más grande (el universo). Interesantemente, nuestros sentidos solo nos permiten explorar la parte central de esta escala neoplatónica. Los niveles subatómicos y cosmológicos son inaccesibles para nuestros sentidos.
Desde los griegos y aún antes, los seres humanos nos percatamos de que nuestros sentidos estaban limitados: solo podemos ver cosas muy pequeñas hasta cierto nivel. No es una decisión arbitraria que todas las reglas que usamos para medir tienen como escala menor al milímetro, y por una buena razón. Aun los humanos privilegiados con una excelente visión no pueden ver cosas menores a cientos de micras (la mitad o tercera parte de un milímetro). Esta necesidad de ver más allá de nuestros sentidos nos condujo a la invención del telescopio (primero) y del microscopio (varios años después). Estos instrumentos nos permitieron estudiar y visualizar algunos de los eventos que ocurren más cercanos a los extremos de la escala neoplatónica, pero sin lograr llegar a los extremos de la misma.
La invención del microscopio se le atribuye a Zacharias Janssen, en 1590. Sin embargo, no fue sino hasta mediados del siglo XVII que el científico holandés Antón van Leeuwenhoek, utilizando microscopios simples de fabricación propia (figura 1), describió por primera vez protozoarios, bacterias, espermatozoides y glóbulos rojos. Es por la utilización sistematizada del microscopio, por lo que a Antón se le considera el primer microscopista.

El microscopio original se encuentra resguardado en el Museo Británico, junto con varias de las preparaciones originales del científico holandés Anton van Leeuwenhoek, como polen y glóbulos rojos contenidos en láminas de observación. Estas preparaciones originales estuvieron tan bien hechas, que han sobrevivido el embate de 200 años
Figura 1 Réplica del microscopio de Leeuwenhoek
Sin embargo, aún los microscopios de luz modernos más poderosos tienen limitaciones. Estas limitaciones no son propias del instrumento, sino de un principio de física, el llamado límite de difracción de la luz. Pero ¿qué significa este límite? De manera sencilla, significa que no podemos ver objetos que son menores a la longitud de onda de la luz, misma que utilizamos para iluminarlos. Este límite depende, obviamente, de la longitud de onda que utilicemos para iluminar el objeto deseado, pero en el mejor de los casos, no podemos ver objetos menores a 200 nanómetros, aun utilizando el microscopio de luz más moderno y avanzado. Recordemos que un manómetro equivale a la millonésima parte de un milímetro. Si regresamos al ejemplo inicial de nuestra regla de medir, imaginemos que dividimos un milímetro en un millón de partes y queremos ver algo que se extiende al tamaño de 200 de estas pequeñas divisiones.
Hacia finales del 1800, John William Strutt, tercer barón Rayleigh, sentó las bases matemáticas del límite de difracción de la luz y la resolución espacial en microscopia de luz. Por este trabajo, el barón de Rayleigh recibió el premio Nobel de Física en 1904.
Desde ese entonces, varios físicos, biólogos y matemáticos se dieron a la tarea de intentar rebasar este límite de resolución, con el fin de poder observar cosas más pequeñas: un verdadero intento de inmersión al microcosmos. Por mucho tiempo se pensó que sería imposible rebasar el límite de difracción de la luz. Sin embargo, los científicos no nos rendimos fácilmente y disfrutamos la lucha por vencer los retos que nos impone la naturaleza.
Límite de difracción de la luz
De forma casi simultánea, los 3 científicos ganadores del Premio Nobel de Química 2014 trabajaron arduamente (con aproximaciones un tanto diferentes) para intentar rebasar el límite de difracción de la luz.
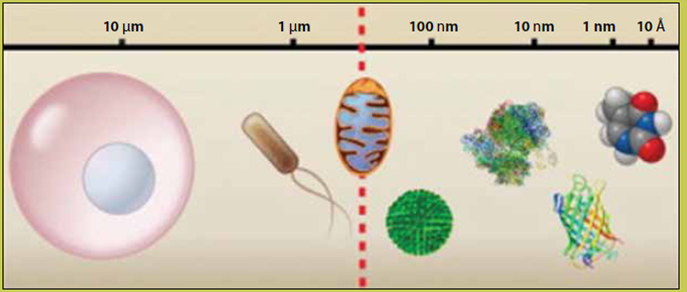
El dibujo muestra desde el tamaño de una célula (a la izquierda), la cual se encuentra en el orden de decenas de micras de diámetro, recorriendo el camino de la escala espacial, pasando por las bacterias (con diámetros de alrededor de 1-2 micras, y la mitocondria (en el centro). La línea roja punteada indica el límite de difracción de la luz. Por debajo de este límite, encontramos complejos macromoleculares de proteínas (en el orden de cientos de nanómetros [nm]) hasta llegar al nivel atómico, en el extremo derecho del dibujo.
Figura 2 La escala microcósmica
Erik Betzig, físico estadounidense, ha dedicado buena parte de su vida científica al desarrollo de herramientas ópticas para el estudio de moléculas y células. En los últimos años, ha trabajado en una idea, que a simple vista, parecería descabellada: encender y apagar de manera rápida moléculas individuales, con el fin de determinar su localización espacio-temporal en una célula o tejido vivo. Esta metodología, conocida como PALM (del inglés, photo-activated localization microscopy), permite rebasar el límite de difracción de la luz, al identificar en 3 dimensiones la localización espacial de moléculas fluorescentes individuales.
La técnica de PALM funciona muy bien, siempre y cuando se utilicen moléculas fluorescentes fotoactivables, es decir moléculas fluorescentes que se pueden encender y apagar con luz. Dado que una molécula es más pequeña que el límite de difracción de la luz (el límite es de 200 nm y las moléculas tienen alrededor de 3 nm de diámetro), mapeando moléculas individuales es factible rebasar el límite de difracción por un orden de 10 o más.
Betzig no estaba solo en esta carrera por desarrollar herramientas que permitan rebasar los límites de resolución de la microscopia de luz. Por otro lado, el físico alemán Stefan Hell siguió un camino diferente para intentar romper este límite de difracción. Hell trabajó en el desarrollo de una técnica nueva denominada STED (del inglés, stimulated emission depletion). Esta técnica consiste en el uso de 2 láseres, uno ilumina la muestra y el segundo agota (reduce la fluorescencia) de alrededor del área iluminada por el primer láser. El efecto final es el aumento en la resolución del microscopio de 200 nm a alrededor de 30 nm. Con el STED también es necesario usar fluoróforos (compuestos fluorescentes) compatibles con esta técnica (al igual que con la técnica de PALM desarrollada por Betzig, la técnica de STED utiliza también fluoróforos compatibles con esa metodología). El grupo de Hell en el instituto Max Planck se ha dedicado a sintetizar compuestos fluorescentes compatibles con la técnica de STED, de los cuales ya existen un par de decenas de ellos.

John William Strutt, tercer baron Rayleigh, premio Nobel de Fisica en 1904. Sento las bases matemáticas del límite de difracción de la luz y la resolución espacial en microscopia de luz.
Finalmente, William Moerner, un químico estadounidense, utilizó una aproximación muy diferente para rebasar el límite de difracción de la luz. Moerner se preguntaba si sería factible, utilizando una cámara de video ultra sensible (muy parecida a la utilizada por astrónomos para captar luz de regiones lejanas del universo), captar la luz emitida por una sola molécula fluorescente. La pregunta no es trivial, ya que una molécula individual emite apenas unos cuantos fotones de luz y captar esta luz y diferenciarla del ruido proveniente del medio ambiente no es una tarea fácil. Después de años de perfeccionamiento de esta metodología de fluorescencia de molécula única, el grupo de Moerner logró visualizar moléculas individuales de ADN (material genético) en movimiento dentro de una célula viva. Sin lugar a dudas, nada se ajusta mejor al famoso dicho de “buscar una aguja en un pajar”, que el detectar la luz emitida por una molécula individual de ADN y separarla del ruido de fondo de autofluorescencia proveniente de una célula.
Estos desarrollos tecnológicos han creado un nuevo campo en microscopia denominado “superresolución”. Pero, ¿detrás de toda esta física y matemática existe alguna utilidad práctica de la superresolución en el campo de la medicina?, ¿para qué nos sirve estudiar el comportamiento de moléculas individuales?
Quizás la siguiente frase es algo en lo que no pensamos con frecuencia (al menos yo no lo pensaba cuando estudiaba Medicina), pero todas las enfermedades hereditarias tienen su origen en el mal funcionamiento de moléculas individuales. Pongamos, por ejemplo, el caso de la fibrosis quística (FQ).
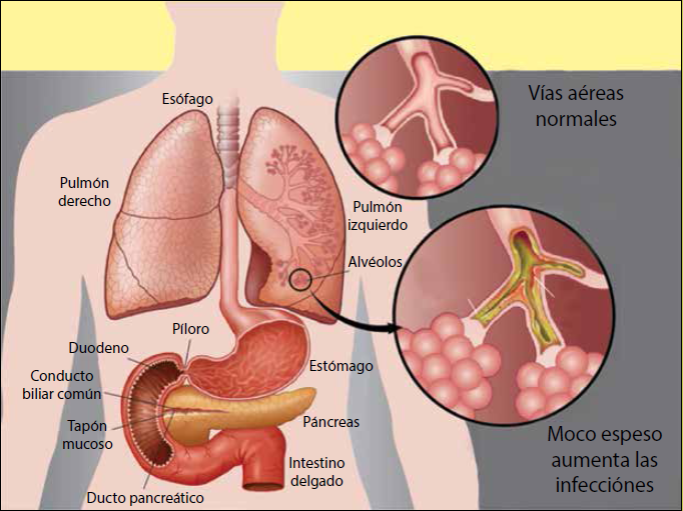
El dibujo muestra como la escasa secreción de iones cloruro, resultan en un aumento en la viscosidad del moco, dando por resultado la acumulación de bacterias y las infecciones respiratorias repetidas. La falta de cloro afecta muchos órganos, entre ellos las vías respiratorias, páncreas y tubo digestivo. El canal iónico afectado en la FQ esta presente en muchos tejidos, incluyendo los mencionados arriba, sin embargo, las principales manifestaciones son respiratorias.
Figura 3 Dibujo que ilustra la patología encontrada en pacientes con fibrosis quística (FQ)
La FQ es una enfermedad hereditaria que afecta a alrededor de 1 de cada 29 estadounidenses de raza blanca. Esta enfermedad se produce por mutaciones en un único gen que codifica (produce) un canal iónico permeable a cloro. Estas mutaciones impiden el funcionamiento adecuado de este canal iónico, y da por resultado una reducción en el contenido de sales en las secreciones del árbol respiratorio, tubo digestivo y en fluidos de otros órganos. La falta de un balance adecuado de sales en estas secreciones incrementa la viscosidad de las mismas, lo que afecta el desalojo de bacterias del árbol respiratorio. Los enfermos de FQ sufren de infecciones respiratorias graves, las cuales culminan con la muerte antes de concluir la adolescencia.
Estudios de moléculas individuales nos han permitido conocer cómo funciona este canal de cloro. Se distribuye a lo largo de todo el tejido epitelial que recubre el tracto respiratorio, y se integra en la membrana plasmática de las células epiteliales. A través del poro de este canal se transporta el cloro, del interior celular hacia la luz del tracto respiratorio. La secreción de este ion está muy regulada, con el fin de mantener una viscosidad óptima en las secreciones respiratorias. La fluidez del moco es esencial para poder desalojar, continuamente, bacterias que lleguen a alojarse en el árbol respiratorio. Las vellosidades del epitelio respiratorio barren continuamente al moco, arrastrando bacterias y partículas que llegan durante la inspiración.
El canal de cloro mencionado arriba se abre y cierra millones de veces por segundo, y permite el paso controlado del cloro, del interior de las células epiteliales, hacia el lumen del tracto respiratorio. Esta secreción de cloro va coordinada con el barrido continuo de las vellosidades del tracto respiratorio, facilitando el desalojo de objetos extraños y patógenos del mismo. De esta forma, la secreción de cloro está finamente regulada por vías de señalización celular. La mayoría de las mutaciones identificadas en pacientes de FQ reducen el paso de cloro por el canal mencionado. Lo anterior lo hemos podido determinar gracias al estudio de canales iónicos individuales, en los cuales se compara el funcionamiento de un canal silvestre (sin mutar) con uno mutado.

El químico estadounidense William Moerner, Premio Nobel de Química 2014, logro visualizar moléculas individuales de ADN en movimiento dentro de una célula viva.
Al estudiar el canal de cloro de la FQ, llamado CFTR (del inglés cystic fibrosis transmembrane regulator) a nivel de molécula individual, se encontró algo realmente interesante. Mientras la mayoría de los canales funcionan como tetrámeros (formados por 4 moléculas idénticas del canal), el CFTR funciona como un monómero, es decir, una sola molécula de CFTR produce un canal de cloro funcional. Así mismo, se pudo determinar que las mutaciones en el gen que codifica para el canal CFTR no alteran estas propiedades de formar monómeros del canal, sino que interrumpen la permeabilidad al ion cloro. Sin el estudio de moléculas individuales, nos hubiera sido extremadamente difícil entender cómo la mutación en pacientes con FQ resulta en infecciones respiratorias graves. Estos estudios nos han permitido establecer la relación entre el mal funcionamiento de una molécula individual y las manifestaciones respiratorias.
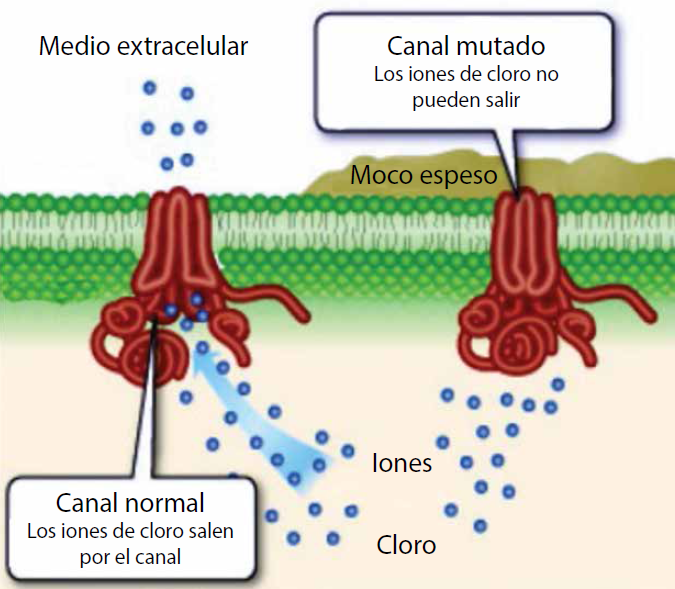
En el esquema se ejemplifica la membrana celular (en verde) en donde se encuentra insertado el canal de la FQ. Este canal conduce iones cloruro, los cuales son esenciales para darle fluidez a las secreciones y formar un moco de consistencia adecuada para facilitar la remoción de bacterias de las vías respiratorias. Mutaciones en este canal (causantes de la FQ) impiden que el canal se abra y deje salir los iones cloruro al medio extracelular. El resultado es un moco muy viscoso y que almacena gran cantidad de bacterias.
Figura 4 Dibujo que ilustra el problema a nivel molecular de la fibrosis quística (FQ)
Como este ejemplo de la FQ, podríamos citar decenas de ejemplos similares, en donde mutaciones en moléculas individuales resultan en problemas hereditarios severos. Tenemos el caso, por ejemplo, de una gran cantidad de arritmias cardiacas, resultado de mutaciones en varios canales de potasio y calcio, los cuales son esenciales para la generación del ritmo cardiaco normal. Es por todas estas posibilidades que derivan del uso de la superresolución, que Erik Betzig, Stefan Hell y William Moerner comparten el premio Nobel de Química 2014.











 nueva página del texto (beta)
nueva página del texto (beta)






