A la memoria de Pepe Mundo, quien se hubiese alegrado de esta y otras medicinas por venir
En esta entrega de “Desde la trinchera” comentaremos el artículo de Kitambi y colaboradores1 que describe una novedosa y promisoria alternativa para el tratamiento del glioblastoma multiforme (GBM), una enfermedad devastadora y prácticamente incurable. El abordaje seguido por los autores es de una impecable y pulcra lógica científica, basada en la suposición de que hay funciones adquiridas por las células tumorales, no necesariamente responsables de su desbocada proliferación celular, que podrían ser blancos terapéuticos novedosos.
Es sabido que el fenotipo canceroso se desarrolla a partir de mutaciones en las células tumorales que les confieren una “ganancia” o una “pérdida” de función. Las primeras generalmente activan proto-oncogenes, mientras que las segundas resultan en la inactivación de genes supresores de tumores. En el caso del GMB estos cambios afectan vías reguladoras de la división celular tan críticas como las mitogénicas (receptores de cinasas de tirosinas acopladas a Ras), las de p53 (mediadores de reparación genómica y/o apoptosis) y las del ciclo celular (controladoras de la proteína Rb, CDKs y ciclinas). El trastorno de estas vías hace que el GBM sea una enfermedad recidivante y refractaria aun a los más agresivos tratamientos. Kitambi y cols. supusieron que además de estas ganancias y pérdidas de función, las células del GBM habrían adquirido otras que les distinguiesen de células vecinas normales y que fueran blanco potencial para atacarlas. De ahí que su primer objetivo fue identificar tal función peculiar. Para ello probaron los 1,364 compuestos químicos presentes en la “biblioteca” llamada NIH, Diversity Set II, los cuales fueron añadidos a cultivos de líneas celulares, las células de glioblastoma (GC), que previamente habían establecido a partir de tumores humanos de GBM (figura 1).

Figura 1 Estrategia que descubrió al vacquinol como agente anti-GMB. Un conjunto de fármacos se probaron mediante un tamizaje fenotípico para encontrar los que afectaran la supervivencia de células de GMB de manera específica. La capacidad antitumoral de la droga encontrada, el Vacquinol-1, se probó en experimentos in vitro e in vivo, como se explica en el texto. (Tomada de Kitambi SS, et al. Cell. 2014;157:313).
De los 234 compuestos que mostraron afectar la morfología de las GC, solo 63 demostraron especificidad contra GC, pues no afectaron a células madre embrionarias de ratón, ni fibroblastos humanos células derivadas de un osteosarcoma. La prueba de irreversibilidad del daño solo la pasaron 12 compuestos, 7 de los cuales no afectaron el desarrollo ni la viabilidad de embriones de pez cebra, demostrando no ser toxicas in vivo para otros tejidos. Finalmente, solo 3 compuestos redujeron el tamaño de tumores generados por la inyección de células GC en los ventrículos cerebrales de embriones de pez cebra, una variante novedosa, eficiente y rápida del ensayo de xenoinjertos que habitualmente se hace en ratones (figura 2). De estos 3 compuestos, se eligió al más potente, el E5, que fue llamado vacquinol-1 por su estructura alcohólica-quinólinica (figura 1). Pruebas posteriores demostraron que el vacquinol afecta específicamente la sobrevida de GC, pero no de células de otros linajes. Igualmente, se demostró que la muerte por vacquinol se debe a macropicnocitosis, la cual no es una causa típica de muerte celular como los son la apoptosis o la autofagia. En células GC, el vacquinol induce la formación de vesículas endocíticas gigantescas que finalmente les lleva a estallar (figura 3). Este efecto parece estar mediado por una proteína cinasa, la MAPKK4, que es activada normalmente en respuesta a estrés o inflamación.

Figura 2 El vacquinol inhibe el crecimiento de las células de glioblastoma (GC) en embriones de pez cebra. Un ingenioso experimento in vivo para probar rápida y eficientemente si el vacquinol inhibía el crecimiento de tumores derivados de GC consistió en cargarlas previamente de un marcador fluorescente rojo y posteriormente trasplantarlas a cerebros de embriones de pez cebra, los cuales continuaron su desarrollo en agua de acuario que contenía vacquinol (E5) o el disolvente control negativo (DMSO). Días después se analizaron los embriones por microscopia de fluorescencia para determinar la presencia de GC. Comparado con el control u otros compuestos, el E5 tuvo un potente efecto en la sobrevida de las células tumorales. (Tomada de Kitambi SS, et al. Cell. 2014;157:313).
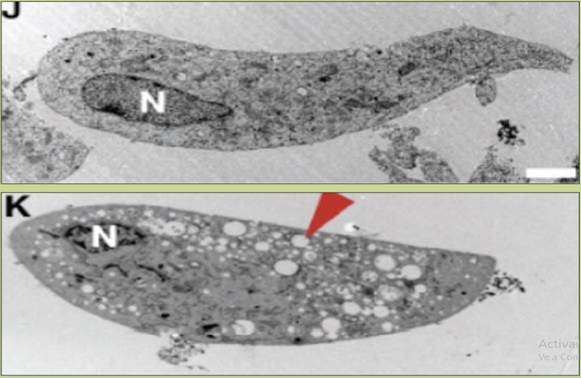
Figura 3 El Vacquinol mata a las células de glioblastoma mediante macropicnocitosis. Células de glioblastoma se trataron con vacquinol (7.5 mM por 6 horas, panel K) y se observaron, junto con células no tratadas (panel J), al microscopio electrónico. La gran cantidad de vacuolas típicamente macropicnocíticas (punta de flecha roja) que se formaron causaron la muerte celular. (Tomada de Kitambi SS, et al. Cell. 2014;157:313).
Aunque no se sabe exactamente la razón, la inhibición de la expresión de MAPKK4 hace que las GC resistan al vacquinol, es decir que las GC requieren de la presencia y actividad de MAPKK4 para poder ser dañadas por el vacquinol. Esto debe ser contrastado con otros papeles que la MAPKK4 tiene en la oncogénesis, pues la evidencia indica, que según el tipo de cáncer, esta cinasa pude ser promotora o antagonista de la tumorigenesis2.
Los estudios farmacocinéticos indicaron la estabilidad y buena distribución tisular del vacquinol, el cual es permeable a la membrana plasmática y a la barrera hematoencefálica, todo lo cual hizo pensar a los autores de su posible uso terapéutico.
La prueba farmacológica inicial para el vacquinol consistió en usarlo para tratar xenoinjertos tumorales en ratones inmunodeficientes, un ensayo clásico de la oncología experimental. Los cerebros de ratones son injertados con células GC. Las cuales 7 semanas después han evolucionado a grandes tumores hemorrágicos y necróticos que tienen el aspecto macroscópico e histológico típico de GBM. Si a la semana 6 se administra vacquinol intracranealmente, en el mismo lugar donde se injertaron la células GC, el tamaño del tumor, una semana después, se reduce significativamente y muestra signos de daño vacuolar. Sin embargo la prueba contundente del beneficio terapéutico del vacquinol quedo demostrado en el experimento de la figura 4 en donde se aprecia que aumenta la sobrevida de ratones xenoinjertados.
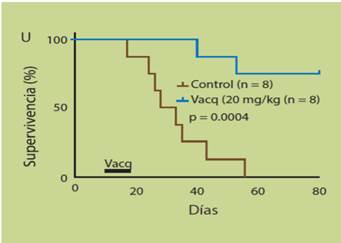
Figura 4 El tratamiento con vacquinol aumenta la sobrevida de ratones xenoinjertados con células de glioblastoma. La efectividad antitumoral de la administración oral del vacquinol se demostró en un experimento clásico de xenoinjertos tumorales en ratones inmunodeficientes. Para ello, a tiempo cero se inocularon en cerebro células GC y 2 semanas después se les suministro vacquinol (20 mg/kg por día, durante 5 días) y se registró la sobrevivencia comparada con un grupo semejante de ratones que solo fueron tratados con el vehículo de la droga. Mientras que la sobrevida media de los ratones control fue de 31.5 días, solo dos ratones tratados con vacquinol murieron en los 80 días que duro el experimento (Tomada de Kitambi SS, et al. Cell. 2014;157:313).
El trabajo de Kitambi y colaboradores ejemplifica una manera elegante, racional y práctica de buscar nueva moléculas antitumorales, usando un abordaje que parte de una interesante premisa, la de atacar propiedades del tumor que no necesariamente sean responsables de la elevada proliferación o invasividad. Pero mejor aun, este trabajo también abre una gran y esperanzadora posibilidad terapéutica para uno de los más devastadores cánceres humanos.











 nova página do texto(beta)
nova página do texto(beta)



