El oxígeno ayuda a aprovechar la energía de los nutrientes, sin embargo, también produce especies reactivas de oxígeno (ERO), que en exceso, reaccionan con las moléculas del organismo y las destruyen. Esto provoca envejecimiento y, eventualmente, la muerte. Las diferentes especies biológicas han evolucionado para regular la formación de las ERO. La alimentación y el estilo de vida ejercen una fuerte influencia sobre la capacidad del organismo para lidiar con las ERO.
Desde su aparición hace 3,500 millones de años, los seres vivos proliferaron y se diversificaron hasta que hace 2,000 millones de años la concentración de oxígeno atmosférico aumentó 100,000 veces, lo que indujo la extinción de alrededor del 80% de las especies biológicas. Este aumento se debió a la actividad de las cianobacterias fotosintéticas cuya actividad metabólica libera oxígeno como subproducto y a la toxicidad de los derivados parcialmente reducidos del oxígeno que se conocen como ERO.
A partir de las especies que sobrevivieron a la oxigenación masiva de la atmósfera se desarrollaron los organismos aerobios. Es decir, células que utilizan al oxígeno como aceptor de electrones, lo que libera grandes cantidades de energía en un proceso conocido como respiración aerobia. La cadena respiratoria aerobia se localiza en la membrana plasmática de las bacterias o en la membrana interna mitocondrial de los eucariontes.
La fosforilación oxidativa mitocondrial resulta del acoplamiento entre 2 procesos (Figura 1). Primero, la cadena respiratoria bombea protones al espacio extramembranal usando la energía del flujo de electrones desde diversos donadores hasta el oxígeno, este proceso genera un “gradiente” de protones, es decir una diferencia de sus concentraciones a cada lado de la membrana. Luego el complejo V o adenosintrifosfato (ATP) sintetasa libera la energía almacenada en el gradiente de protones para la fosforilación, es decir la síntesis de ATP, a partir de una molécula de adenosindifosfato (ADP) y un fosfato. La cadena respiratoria acepta equivalentes reductores de diversos sustratos como el nicotinamida adenindinucleótido reducido (NADH) y el flavín adenin dinucleótido reducido (FADH2). El nicotinamida adenindinucleótido (NAD+) es reducido a NADH por diversas enzimas entre las que se encuentran algunas del ciclo de Krebs, como la piruvato deshidrogenasa, la alfa-ceto glutarato deshidrogenasa y la malato deshidrogenasa; luego el NADH es oxidado en el complejo I (NADH: coenzima Q óxido-reductasa). El FADH2 proviene de la succinato dehidrogenasa o de la glicerol fosfato deshidrogenasa y alimenta al complejo II (FADH2: coenzima Q óxido-reductasa). Los electrones captados en los complejos I y II son cedidos a través de la coenzima Q al complejo III (coenzima Q: citocromo c óxido-reductasa) y luego, a través del citocromo C al complejo IV (citocromo-oxidasa). El complejo IV reduce al oxígeno para producir agua.
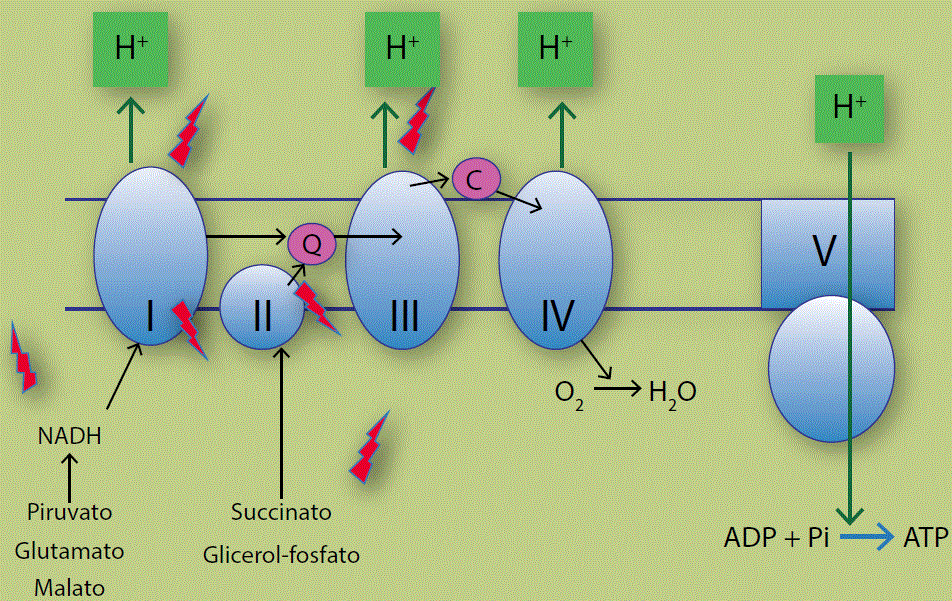
Figura 1 Estructura de la cadena respiratoria mitocondrial de mamíferos donde se muestra el flujo de electrones entre los intermediarios del ciclo de Krebs y la cadena respiratoria (flechas negras) hasta reducir al oxígeno obteniendo agua; el bombeo de protones hacia el espacio intermembranal (arriba) por los complejos I, III y IV y el regreso a la matriz mitocondrial a través del complejo V (complejos en azul) para energizar la síntesis de ATP (flechas verdes). La fuga de radicales libres proviene de diversas fuentes (flechas rojas) como las deshidrogenasas dependientes de NADH, los complejos I, II y III y la glicerol fosfato dehidrogenasa. La coenzima Q y el citocromo c (círculos rosa) transportan electrones entre los complejos de la cadena.
El flujo de electrones es ilustrado con flechas negras (Figura 1). Los electrones arrastran protones y 3 de los complejos respiratorios (I, III y IV) aprovechan la liberación de energía de las óxido-reducciones catalizadas para bombear los protones al espacio intermembranal y así almacenar la energía en forma de un gradiente de protones (Figura 1, flechas y cuadros verdes). Los protones fluyen de regreso al interior mitocondrial a través de la ATP sintetasa o complejo V liberando energía que se usa para sintetizar ATP (Figura 1).
La eficiencia del metabolismo aerobio es unas 15 veces mayor que la del metabolismo anaerobio y por ello, los organismos que generaron un metabolismo aerobio pudieron crecer y llegaron a dominar la Tierra. Sin embargo, esa eficiencia tiene un elevado precio. Durante la respiración se generan radicales libres (especies químicas con electrones desapareados) que pueden reaccionar inespecíficamente con el oxígeno del medio y generar ERO (Figura 1, flechas rojas).
Las ERO, que también son radicales libres, reaccionan rápidamente con los lípidos formando malondialdehido y 4-hidroxinonenal, oxidan las bases del DNA formando 8- hidroxiguanosina, además de carbonilar, nitrar y glutationilar a las proteínas. Estas modificaciones eventualmente conducen a la muerte celular.
Las principales ERO son el ion superóxido (O2.-), el ion hidroperóxido (HOO.-) y el ion hidroxilo (HO.-), además del peróxido de hidrógeno (H2O2) que no es un radical libre pero es muy reactivo. Su génesis por introducción de electrones individuales provenientes de radicales libres se muestra en la Figura 2.
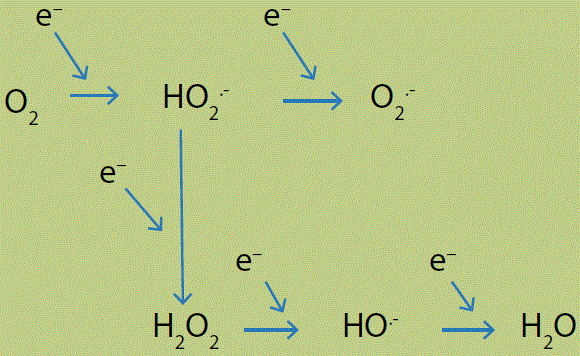
Figura 2 Formación de radicales libres de oxígeno a partir de la reducción parcial de la molécula de oxígeno. Eventualmente, las ERO se detoxifican al reducirse hasta agua. La citocromo oxidasa mitocondrial (complejo IV de la Figura 1) reduce el oxígeno hasta agua directamente, sin pasar por estos intermediarios.
Los organismos, lo mismo una bacteria que un humano, necesitan defenderse de las ERO. Las defensas son de 2 tipos: el primero es la desactivación de las ERO catalizada por enzimas como la superóxido-dismutasa (SOD), la catalasa y el sistema de la glutatión-peroxidasa/reductasa. La SOD convierte al radical superóxido en peróxido de hidrógeno, mientras que la catalasa transforma al peróxido de hidrógeno en agua. Estas 2 reacciones deben estar estrechamente coordinadas. Por ejemplo, en humanos la SOD se codifica en el cromosoma 21; si hay 3 cromosomas 21, en lugar de 2, se expresa un exceso de SOD que produce tanto peróxido de hidrógeno que la catalasa no logra eliminarlo y daña a las células. El sistema de la glutatión peroxidasa/reductasa usa al glutatión, un tripéptido antioxidante que contiene cisteína.
El segundo mecanismo de protección consiste en abatir la formación intracelular de las ERO. La aceleración de la velocidad del paso de electrones por la cadena respiratoria abate la producción de las ERO mediante 2 mecanismos: disminuye la concentración de oxígeno en la célula y elimina rápidamente a los radicales libres, antes de que puedan participar en reacciones inespecíficas.
Las mitocondrias, paradójicamente parecen ser la clave del manejo de las ERO. Si bien la cadena respiratoria mitocondrial produce una gran cantidad de radicales libres, es también gracias a la actividad de la cadena respiratoria mitocondrial que se evita que esos radicales libres se combinen con oxígeno y se produzcan ERO.
En humanos, las ERO tienen un papel relevante en procesos tan variados como el síndrome de Down (trisomía 21), la gangrena, el daño postisquémico, cerebral o miocárdico, el envejecimiento fisiológico de los organismos y las enfermedades neurodegenerativas.
En pacientes con la enfermedad de Parkinson se observó una actividad deficiente del complejo I mitocondrial en la sustancia nigra, mientras que en la enfermedad de Huntington existe una baja actividad del complejo II en el cerebro de pacientes en etapas avanzadas y en la corteza temporal de pacientes con síndrome de Alzheimer se observa deficiencia del complejo III.
Diversos estudios demostraron que el ejercicio regular, físico y muy probablemente intelectual y la ingesta de antioxidantes polifenólicos incrementan la biogénesis y la respiración mitocondrial en tejido nervioso, adiposo y muscular en sujetos obesos, diabéticos y sanos. En modelos animales se observó que la biogénesis y la función mitocondrial neuronal de la descendencia son beneficiadas por la práctica constante de ejercicio. Asimismo, la restricción calórica preserva la función mitocondrial promoviendo la biogénesis mitocondrial y mejorando la eficiencia bioenergética.
El elixir de la juventud es el propio sudor. Conforme acumulamos años, es necesario luchar (en el gimnasio y en la pista de atletismo) por formar biomasa muscular y mantener el metabolismo aerobio funcionando. Así se producirán más mitocondrias y se evitará el daño inducido por las ERO. En este sentido, se ha demostrado que aún cuando un sujeto físicamente activo no necesariamente viva más tiempo, su calidad de vida será muy superior al que es sedentario. Evitar el exceso en la ingesta en alimentos también ayuda a aumentar la población mitocondrial.











 nueva página del texto (beta)
nueva página del texto (beta)



