Introducción
La endocarditis infecciosa (EI) es una enfermedad caracterizada por afección del endocardio en donde se forman vegetaciones infectadas por microorganismos localizadas en las válvulas, las cámaras cardiacas así como en el endotelio de los grandes vasos1. Una clasificación útil para estudiar la EI consiste considerar 4 tipos de la misma: en válvulas nativas, en válvulas prostéticas, por uso de drogas intravenosas y nosocomial o relacionada con procedimientos médicos. Esta clasificación se basa en los factores de riesgo, las condiciones clínicas y las entidades causales más comunes (Tabla 1); esto, a su vez, puede auxiliar en la determinación del esquema de tratamiento2.
Tabla 1 Diferencias en porcentaje de la etiología de microorganismos para los diferentes tipos de endocarditis
Obtenido y modificado a partir de: Murdoch DR, Corey GR, Hoen B, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century. Arch Intern Med. 2009:169:463.
aRegistro hecho a partir de personas con implante de marcapasos y desfibrilador cardioversor implantable.
HACEK: Haemophilus, Actinobacillus, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae.
La incidencia de la EI es de 3.1 a 7.6 casos por cada 100,000 pacientes al año1),(3. Existen numerosos factores de riesgo que pueden asociarse con esta enfermedad, entre ellos figuran: inmunocompromiso, valvulopatías congénitas y adquiridas, recambio valvular, uso continuo de jeringas (especialmente por el empleo de drogas intravasculares) y procedimientos médicos que involucren soluciones de continuidad de la piel y los vasos3),(4.
Las valvulopatías congénitas y las enfermedades reumáticas son los principales factores de riesgo asociados con el padecimiento en válvulas nativa2. Hasta 12% de las personas con EI presentan alguna cardiopatía congénita3. Paralelamente, la válvula aórtica bicúspide (VAB) es la cardiopatía congénita más frecuente, con una incidencia de 0.46 a 1.37% en la población general5. A pesar de esto, solamente el 0.16% de pacientes pediátricos con VAB padecen EI al año2),(6. La incidencia de EI aumenta con la edad2),(6),(7.
Existen importantes complicaciones para la EI, entre las cuales figuran: abscesos cardiacos, insuficiencia cardiaca congestiva, estenosis aórtica, embolismos sistémicos que pueden generar abscesos, infartos sépticos y aneurismas micóticos intracraneales2),(3),(4.
Dado este marco teórico y considerando la importancia de realizar un adecuado abordaje diagnóstico y terapéutico de la endocarditis infecciosa, se presenta el caso clínico así como una breve revisión del tema.
Caso clínico
Paciente masculino de 40 años originario del Distrito Federal con antecedente de diabetes mellitus tipo 2 diagnosticada y controlada desde hace 6 años. Su padecimiento inició con astenia, adinamia, diaforesis, fiebre no cuantificada y escalofríos, sin embargo no buscó atención específica.
Tres meses después, acudió al hospital de zona correspondiente con alteraciones del lenguaje y fluctuaciones del estado de alerta, por lo que se realizó tomografía axial computarizada (TAC) de cráneo, sin lesiones aparentes.
Debido al resultado negativo de la TAC y la falta de mejoría de los síntomas neurológicos, se refirió al Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suárez”. A su llegada, se realizó una nueva TAC de cráneo, la cual documentó una lesión hipodensa (sugerente de un absceso cerebral) en la región occipital izquierda. Se indicó también una punción lumbar, cuyos resultados sugirieron el diagnóstico de encefalitis o ruptura de absceso cerebral.
En busca del posible foco infeccioso extracraneano, se ordenó ecocardiograma transesofágico que reportó la presencia de una válvula aórtica bicúspide (Figura 1), vegetaciones de 0.4 por 0.3 mm en la válvula aórtica y regurgitación excéntrica sugerente de perforación, por lo que fue trasladado al Instituto Nacional de Cardiología “Ignacio Chávez” (INCICh) con tratamiento antibiótico conformado por metronidazol, ceftriaxona y fluconazol.

Foto: cortesía del autor
Figura 1 Eje corto de ecocardiograma transesofágico donde se aprecia la válvula aórtica con la evidencia de aorta bivalva (fusión de válvula coronariana izquierda y derecha).
Al llegar al INCICh, el paciente no presentaba fiebre. Se realizaron 2 hemocultivos centrales, además de uno periférico, todos con resultados negativos. A la inspección general se observó astilleo hemorrágico plano y no doloroso en las plantas de los pies, correspondientes a las lesiones de Janeway, y se notan unos pequeños nódulos en el muslo izquierdo, correspondientes con nódulos de Osler. A la auscultación se percibío un soplo diastólico en decrescendo grado II/VI en el foco aórtico con irradiación al foco pulmonar. Se realizó una segunda TAC, que mostró imagen compatible con evento vascular cerebral (EVC) isquémico parietotemporal izquierdo (Figura 2a) y un nuevo ecocardiograma transesofágico, que reveló crecimiento de las vegetaciones en la válvula aórtica hasta 10 mm, así como pseudoaneurisma en la continuidad mitroaórtica de 14 × 8 mm (Figura 3). Se ajustó esquema antibiótico según recomendación del servicio de infectología.
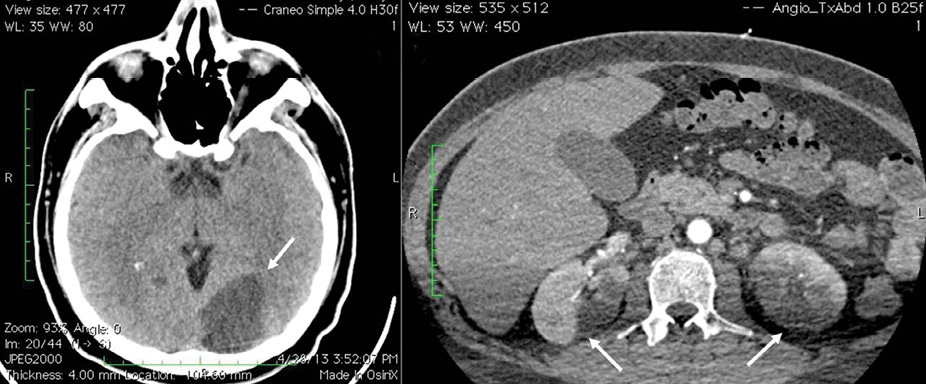
Foto: cortesía del autor
Figura 2 (a) Evento vascular cerebral (EVC) isquémico parietotemporal izquierdo secundario a embolismos sépticos. (b) Infarto renal bilateral igualmente secundario a embolismos sépticos.
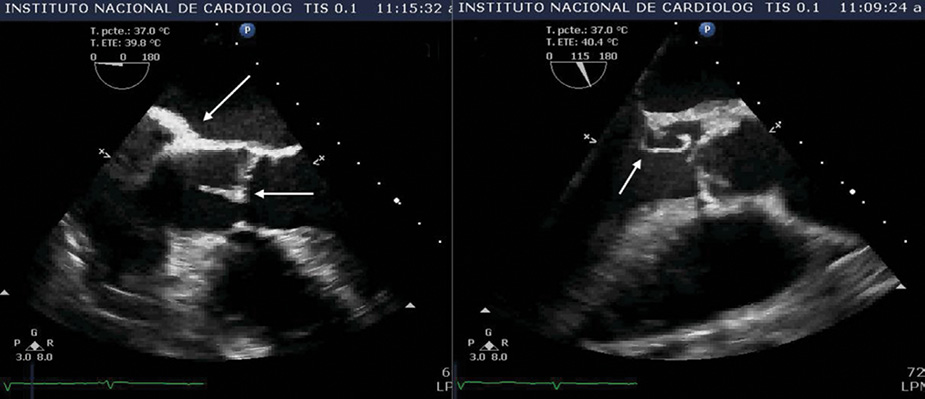
Foto: cortesía del autor
Figura 3 (a) Eje largo donde se aprecia engrosamiento de la unión mitroaórtica, así como una vegetación de 10 mm en la valva no coronariana de la válvula aórtica. (b) Eje largo de ecocardiograma que muestra pseudoaneurisma en la continuidad mitroaórtica (14 × 8 mm) y engrosamiento e hiperefrigencia de la misma.
Siete días después, el paciente presentó un pico febril de 38° C y un bloqueo del nodo AV de primer grado (Figura 4). Los resultados de los hemocultivos fueron nuevamente negativos y se indicó una TAC de cuerpo completo, en la que se reportó un aneurisma micótico en el lóbulo frontal izquierdo e infartos renales bilaterales (Figura 2b) .

Foto: cortesía del autor
Figura 4 Electrocardiograma: ritmo sinusal, frecuencia cardiaca de 90 lpm, p 60 mseg, morfología ± en V1, 1 mV, PR 220 mseg, QRS 80 mseg, QTm 230 mseg, QTc 410 msg, posición horizontal dextrorrotado, aP 60°, a QRS 10°, aT -20°, transición de R V3, sin alteraciones del ST ni inversión de onda T. Bloqueo AV de primer grado.
Debido a la falta de mejoría por el tratamiento antibiótico y aunado al aumento de tamaño de las vegetaciones, se decidió realizar un recambio valvular abierto en el cual se sustituye la válvula aórtica por una válvula protésica metálica (Figura 5) .

Foto: cortesía del autor
Figura 5 Ecocardiograma transtorácico postquirúrgico que muestra prótesis valvular aórtica.
La cirugía no presentó complicaciones y 2 semanas después el paciente fue dado de alta con programación de citas de seguimiento.
Fisiopatología
La EI consiste en un proceso inflamatorio que resulta de la adherencia de microorganismos patógenos a vegetaciones (compuestas por fibrina, eritrocitos y plaquetas), las cuales se encuentran unidas al endocardio, al tejido valvular o a ambos8),(9.
El daño endotelial que da inicio al proceso puede ser causado por flujo turbulento secundario a una cardiopatía congénita (p. ej., la presencia de válvula aórtica bivalva, como en el caso expuesto) o por agresión directa al tejido por parte de dispositivos intracardiacos. La lesión endotelial provoca una reacción inflamatoria local, lo que da lugar a la formación de un trombo compuesto por fibrinógeno, fibronectina, vitronectina, eritrocitos, plaquetas y leucocitos, aunque libre de gérmenes, por lo que se considera aséptico8),(10.
Cuando ingresan microorganismos patógenos a la circulación, se unen a estas estructuras, colonizándolas. Posteriormente, más capas de fibrina y plaquetas los protegen de las defensas del huésped, promoviendo una proliferación rápida y la consecuente formación de vegetaciones8.
Las vegetaciones activas producen descargas continuas de bacterias al torrente sanguíneo, lo que genera un cuadro séptico y una estimulación constante del sistema inmune. Además, la fragmentación de las vegetaciones genera émbolos sépticos que pueden depositarse en distintos sitios blanco en el cuerpo, generando abscesos, o bien obstruir los vasos de pequeño y mediano calibre produciendo infartos en sus territorios vasculares correspondientes. Igualmente, los émbolos sépticos pueden tener como consecuencia una endarteritisi séptica, que adelgaza las paredes de los vasos y condiciona la formación de aneurismas.9
La extensión de la infección a nivel local en el corazón puede ocasionar úlceras, abscesos y daños importantes en el tejido valvular. Esto último se relaciona con sobrecarga del ventrículo, lo que lleva a una insuficiencia cardiaca paulatina. Las perforaciones de los velos valvulares, las rupturas de las cuerdas tendinosas o de los músculos papilares y la dehiscencia de las suturas presentes en las prótesis valvulares, son una posible complicación. Además, si el daño se extiende hacia el pericardio, puede haber una pericarditis purulenta, mientras que si se propaga hacia el septum pueden existir trastornos de la conducción eléctrica, entre los que se encuentran los bloqueos de rama y los bloqueos AV9.
Manifestaciones clínicas
La presentación clínica de la EI es muy variable. Si bien puede tener un curso agudo que se acompaña por progreso rápido, más comúnmente se desarrolla de manera subaguda, con fiebre baja y síntomas inespecíficos que pueden resultar confusos10.
Dentro de las manifestaciones relacionadas con un proceso sistémico grave se encuentran fiebre (manifestación más constante), sudores nocturnos y ataque al estado general con astenia, adinamia, hiporexia, pérdida de peso y palidez9),(11),(12.
Los émbolos sépticos liberados de las vegetaciones pueden ocasionar infartos en diversos órganos, abscesos en el sistema nervioso central, los riñones, el bazo, el corazón, las extremidades y los pulmones o brindar las condiciones propicias para la formación de aneurismas9.
Las manifestaciones inmunológicas son secundarias al depósito de complejos inmunes en diversos tejidos. Suelen presentarse en la forma subaguda de la enfermedad, pues en la variante aguda, la evolución es demasiado rápida10. Dentro de estas manifestaciones se encuentran el síndrome urémicoii, la glomerulonefritis focal de origen embólicoiii, hemorragias petequiales en conjuntivas oculares, paladar, mucosa oral y piel (especialmente en codos y tobillos), hemorragias en astilla en los lechos subungueales, manchas de Roth (hemorragias ovoideas con centro blanco cercanas a la papila ocular), embolia de la arteria central de la retina, manchas de Janeway (lesiones indoloras, hemorrágicas y eritematosas nodulares en las palmas de las manos o las plantas de los pies, con tendencia a ulceración), nódulos de Osler (formaciones nodulares dolorosas que aparecen en los pulpejos de los dedos de las manos y los pies), artralgias, mialgias y dolor, tanto lumbar como sacro9.
Finalmente, el daño valvular se manifiesta en el agravamiento de soplos cardiacos preexistentes o la aparición de nuevos9),(11.
El paciente presentó un síndrome febril, acompañado por adelgazamiento y ataque al estado general. La liberación de émbolos sépticos condicionó la aparición de un absceso cerebral en la región occipital izquierda, un EVC isquémico parietotemporal izquierdo, un aneurisma micótico en la región frontal izquierda e infartos renales bilaterales. Además, el paciente presentó un pseudoaneurisma de 14 × 8 mm en la continuidad mitroaórtica y mostró manchas de Janeway, nódulos de Osler, hemorragias en astilla en los lechos subungueales y artralgias, así como un bloqueo AV de primer grado.
Diagnóstico
Anteriormente, el diagnóstico clásico de EI se realizaba mediante los criterios de Beth Israel (realizados por von Reyn y colegas en 1981). En estos criterios, el diagnóstico definitivo era aquel en el que existía una confirmación patológica procedente de una cirugía o de la autopsia, mientras que el diagnóstico probable era aquel en el que los pacientes presentaban bacteriemia, evidencia de regurgitación valvular o fenómenos vasculares. Hoy en día, el diagnóstico de EI se realiza bajo el cumplimiento de lo establecido en los criterios de Duke (Tabla 2), cuyos valores estadísticos significativos son: especificidadiv de 99% y valor predictivo negativov > 98%, creados por Durack y colegas de la universidad de Duke. Al cumplir 2 criterios mayores, 1 mayor y 3 menores o 5 criterios menores se puede realizar el diagnóstico definitivo de EI13.
Tabla 2 Criterios de Duke para endocarditis infecciosa
| Criterios mayores |
| Hemocultivo positivo (con microorganismos típicos compatibles con EI, mínimo 2) |
| Evidencia de compromiso endocárdico (ecocardiograma positivo [vegetaciones, abscesos o dehiscencia parcial de válvula prostética], nueva regurgitación valvular) |
| Criterios menores |
| Predisposición (cardiopatía, uso de drogas endovenosas) |
| Fiebre (temperatura > 38º) |
| Fenómenos vasculares (embolia arterial mayor, infartos pulmonares sépticos, aneurisma micótico, hemorragia intracraneal, hemorragia conjuntival, lesiones de Janeway) |
| Fenómenos inmunológicos (glomerulonefritis, nódulos de Osler, manchas de Roth, factor reumatoide) |
| Evidencia microbiológica (hemocultivos positivos pero no encontrados como criterio mayor más arriba o evidencia serológica de infección activa con organismos compatibles con EI) |
| Hallazgos ecocardiográficos (compatible con EI pero no encontrado como criterio mayor) |
Obtenido y modificado a partir de: Bayer AS, Bolger AF, Taubert KA, Wilson W, Steckelberg J, Karchmer WA, et al. Diagnosis and Management of Infective Endocarditis and Its Complications. Circulation. 1998;98:2936-8.
EI: endocarditis infecciosa.
Bajo estos parámetros, nuestro paciente fue diagnosticado con EI. Cumplía con un criterio mayor (evidencia ecocardiográfica) y 3 criterios menores (predisposición, fiebre y fenómenos vasculares). En aquellos casos en los que el tratamiento antibiótico empírico se inicia antes de extraer muestras para hemocultivos, es probable que las bacterias en el torrente sean erradicadas y el resultado del cultivo sea negativo. Debido a esto, el paciente únicamente cumplió uno de los criterios mayores y en ninguna ocasión presentó hemocultivos positivos.
Tratamiento
En el tratamiento efectivo en la EI, el objetivo principal es erradicar el microorganismo causal de dicha patología, ya que este es responsable de las afecciones sistémicas que acompañan la enfermedad. Para abordar una EI con cultivos negativos, como en este caso se presenta, se recomienda iniciar tratamiento con vancomicina y rifampicina por 6 semanas así como gentamicina las primeras 2 semanas14. Nuestro paciente fue tratado en un principio con metronidazol, ceftriaxona y fluconazol, tratamiento que fue ajustado después de su arribo al INCICh con vancomicina, ceftriazona y amikacina. El aneurisma micótico intracraneal como el que presenta el paciente, generalmente mejora después de la instauración de la quimioterapia (antibióticos), en caso contrario, se puede someter a una corrección quirúrgica13.
Con el objetivo de erradicar las vegetaciones en la válvula aórtica (procedimiento recomendado en vegetaciones con un tamaño ≥ a 10 mm)14 y corregir la insuficiencia valvular, se llevó a cabo una cirugía en la que se empleó una prótesis metálica para sustituir la válvula aórtica, incluso cuando el uso de esa clase de prótesis representa un riesgo para desarrollar EI posteriormente13.
Pronóstico
La EI puede tener diversas manifestaciones clínicas y complicaciones que varían entre pacientes y cambian con el tiempo. Debemos de tener en cuenta diversos factores como edad, comorbilidades, falla cardiaca, anemia, microorganismos multiresistentes, infección multivalvular, embolismos y abscesos, entre otros15. Para las EI en cavidades izquierdas se espera una mortalidad del 38%, la cual aumenta al 74% si se presentan complicaciones16. Este paciente presentó complicaciones graves, secundarias a embolismos sépticos: absceso cerebral, infarto renal bilateral y aneurisma micótico; este último, por sí solo, tiene una mortalidad promedio de 60%13. A pesar de que el pronóstico del paciente era poco optimista, su evolución fue favorable.
Conclusión
Es importante conocer los signos y síntomas que acompañan un cuadro clásico de EI, ya que esta patología puede tener un desenlace fatal en caso de no ser diagnosticada a tiempo. Al tener muchos signos clínicos en común con otras enfermedades, se debe abordar con base en los criterios de Duke, ya que con el uso de estas pautas es posible hacer un diagnóstico oportuno, reduciendo la morbimortalidad de los pacientes.











 text new page (beta)
text new page (beta)



