La mayor parte de los médicos clínicos definen la fiebre como una temperatura oral mayor a 38° C en cualquier momento del día, aunque la tendencia de la temperatura en el tiempo dice más que una sola lectura. Por ejemplo, se considera que la temperatura normal del cuerpo en un adulto sano es de 37° C, pero eso es variable, ya que la temperatura del cuerpo es más baja en la mañana (alrededor de las 6:00 am) y más alta en la tarde (4:00 pm-6:00 pm). Normalmente, la temperatura del cuerpo también se eleva en respuesta a ciertas condiciones, como la actividad física y el clima cálido.
La temperatura del cuerpo es controlada por el hipotálamo y sus mecanismos reguladores mantienen la del núcleo corporal a un nivel normal, ajustando tanto la producción como la pérdida del calor. Durante la fiebre, el hipotálamo ajusta esos procesos para mantener la temperatura del núcleo corporal en un valor nuevo y más alto, llamado ‘valor de referencia’ (set-point), un valor que es establecido por medio de la frecuencia de generación de potenciales de acción en las neuronas termoreguladoras del hipotálamo1.
El hipotálamo es nuestro termostato biológico y recibe e integra señales homeostáticas para mantener la temperatura dentro de un pequeño intervalo. En términos mecanísticos, la fiebre es una elevación del valor de referencia de la temperatura corporal en respuesta a citocinas pirógenas que actúan sobre el hipotálamo a través de receptores que estimulan cambios en ese valor.
Aunque aparentemente los patógenos externos son la razón última de la fiebre, en realidad son los pirógenos internos o endógenos los que producen directamente el aumento en el ‘valor de referencia’ termoregulador. Esto es, se supone que el organismo mantiene un ‘valor de referencia’ en el hipotálamo y que en respuesta a algún agente activo (bacterias vivas, bacterias muertas con pared celular, endotoxinas, virus) los leucocitos del anfitrión y tal vez otro tipo de células fagocíticas, liberan al líquido extracelular una proteína que actúa como ‘pirógeno interno’. Estos pirógenos internos afectan los sensores de temperatura en el hipotálamo, llevando a una elevación en ese ‘valor de referencia’.
Entonces, el mecanismo de la fiebre puede describirse en la siguiente forma: 1) El primer paso es la detección de lipopolisacáridos (LPS), que son parte de los componentes de la pared de bacterias gramnegativas y a las que se une una proteína inmunológica llamada proteína de unión lipopolisacárido (LBS); 2) en el segundo paso, el complejo LBP-LPS se une al receptor CD14 de un macrófago cercano, lo que resulta en la síntesis y liberación de varios factores citocinéticos, como las interleucinas 1 (IL-1) y 6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α); 3) esos factores citocinéticos son liberados en la circulación general y llegan a los órganos circunventriculares del cerebro, donde la barrera hematoencefálica es reducida; 4) los factores citocinéticos se unen a receptores endoteliales en la pared de los vasos o interactúan con células microgliales locales, activando la vía del ácido araquidónico y la parte de esta vía relacionada con la fiebre que es mediada por las enzimas fosfolipasa A2 (PLA2), ciclooxigenasa-2 (COX-2) y sintetasa PGE (una proteína de membrana involucrada en el metabolismo de los ecosanoides y glutation, también conocida como mPEGs-1), y; 5) finalmente, esas enzimas median la síntesis y liberación de prostaglandina E2 (PGE2).
La PGE2 es el último mediador de la respuesta febril, actuando cerca del área preóptica ventromedial (VMPO) del hipotálamo anterior y la porción parvocelular del núcleo parvoventricular (PVH) y es en estas áreas donde emerge la fiebre. Se supone que la elevación del valor de referencia de la termorregulación es mediada por la VMPO, mientras los efectos neuroendócrinos de la fiebre son mediados por la PVH, la glándula hipófisis y varios órganos endócrinos. Otros mecanismos efectores de la fiebre son mediados por el tallo cerebral y la activación simpática medular premotora al sistema nervioso autónomo, lo que finalmente lleva a la activación de tejido adiposo café. Entonces, el cuerpo puede inducir escalofríos o elevar la presión sanguínea a través de un mecanismo de vasoconstricción; sin embargo, el valor de referencia de la temperatura del cuerpo permanece elevado hasta que no haya PGE2 presente, lo que probablemente ocurre después de la desaparición del patógeno externo.
En resumen, cuando organismos como bactérias y virus entran al cuerpo, las células fagocíticas reaccionan tratando de destruirlas y, conforme lo hacen, producen pirógenos que estimulan las células del cerebro para liberar pequeñas proteínas llamadas citocinas. Estas moléculas son las responsables de las respuestas hematopoiéticas, inmunes e inflamatorias del cuerpo y cuando entran a la circulación, se sintetiza la prostaglandina E2, haciendo que el tálamo eleve el valor de referencia de la temperatura del núcleo corporal.
Regulación y control de la temperatura corporal
En un individuo sano, la temperatura corporal es mantenida dentro de un intervalo pequeño a pesar de las grandes diferencias en la temperatura del medio ambiente y la actividad física, ya que una regulación perfecta de la temperatura corporal es necesaria para el desarrollo óptimo de las reacciones enzimáticas que ocurren en todos los animales endotérmicos, lo que no se aplica a animales ectotérmicos. Durante los cambios más grandes en el humano, la temperatura corporal puede aumentar y la fiebre es una reacción natural a varias enfermedades. Sin embargo, en varios casos, la ausencia de esta reacción natural es un signo más alarmante que la presencia misma de fiebre, que normalmente se acompaña de diferentes síntomas generales como sudoración, frío y otras sensaciones subjetivas.
La principal producción de calor ocurre por la termogénesis debida al efecto de hormonas tiroideas, que estimulan la Na+K+ATPasa de las membranas celulares y aumentan los procesos metabólicos en los que se libera energía en forma de calor. Para esto es de mayor importancia la división de un mol de ATP, que libera 54 kJ, siendo los mayores productores de calor los músculos esqueléticos, el hígado, los órganos esplácnicos y el cerebro. Sin embargo, debido a su peso, los músculos son especialmente importantes para la produción de calor, por lo que la actividad física la incrementa mucho. También durante la digestión hay un aumento en la producción de calor en el tracto gastrointestinal.
La temperatura corporal constante se debe a una regulación perfecta, ya que el sistema nervioso mantiene una intensidad óptima de metabolismo y al mismo tiempo regula la cantidad de pérdidas de calor; sin embargo, durante el desarrollo postnatal inicial, la termorregulación no es adecuada debido a que el sistema nervioso central (SNC) es inmaduro.
Patogénesis de la fiebre
Si la temperatura del cuerpo es superior a 37.2° C y está asociada con sudoración, hiperventilación y vasodilatación en la piel, hablamos de fiebre. En su inicio se observa un incremento gradual en la temperatura del cuerpo asociado con contracciones musculares, vasoconstricción en la piel y piloerección, aunque el aumento en la temperatura corporal se produce bajando las pérdidas de calor y por vasoconstricción en la piel y el tejido subcutáneo, lo que es la razón del color pálido de la piel y su resequedad, por lo que la persona tiene la sensación de frío. Al mismo tiempo que aumenta la producción de calor en el organismo, el tono muscular también aumenta y hay espasmos musculares, que ocurren principalmente en niños. La sensación de calor y aparición del sudor ocurre cuando se inicia la vasodilatación en la piel.
La fiebre puede ser provocada por numerosos estímulos y frecuentemente se debe a la presencia de bacterias y sus endotoxinas, pero también por virus, levaduras, espiroquetas, protozoarios, reacciones inmunes, varias hormonas, medicamentos y polinucleótidos sintéticos, compuestos que comúnmente se denominan pirógenos exógenos. Las células pueden ser estimuladas por la formación de pirógenos exógenos para producir citocinas llamadas pirógenos endógenos, que afectan la termosensibilidad de las neuronas en el área preóptica del hipotálamo, aumentado la producción de calor y disminuyendo sus pérdidas, hasta que la temperatura corporal llega al valor de referencia. Esta información es transferida por la temperatura de la sangre que fluye alrededor del hipotálamo. La disminución de la temperatura es controlada por la activación de mecanismos que regulan el aumento en la pérdida de calor y, en casos favorables, esto continúa hasta que se alcanza un nuevo equilibrio.
Los pirógenos endógenos más importantes son las interleucinas IL-1, IL-6 y la caquectina, también llamada factor de necrosis tumoral alfa (TNF-α). Estas moléculas son glicoproteínas que también tienen otros efectos importantes, ya que son producidas especialmente por monocitos y macrófagos, pero también por células endoteliales y astrocitos. También los interferones α, β y γ muestran actividad pirogénica.
Después de la administración experimental de alguna endotoxina el nivel de TNF-α plasmático, aumenta y aparece la fiebre. La producción de esta citocina es regulada por un mecanismo de retroalimentación positivo, pero los macrófagos activados por TFN-γ pueden aumentar la producción primaria de IL-1 y TNF-α inducida por otros estímulos. Por otro lado, los glucocorticoides y prostaglandinas del grupo E pueden mostrar efectos inhibitorios sobre la producción de IL-1 y TNF-α, pero cuando se liberan son transportadas por la sangre afectando células blanco en la vecindad o en sitios distantes y que tienen receptores específicos para IL-1 y TNF-α. En el hipotálamo y a partir del ácido araquidónico de las membranas citoplásmicas de las células blanco, IL-1 y TNF-α inician la síntesis de prostaglandinas del grupo E; sin embargo, el mecanismo preciso por el que la prostaglándina PGE reestablece el termostato central es desconocido. La aspirina y antiinflamatorios no esteroideos muestran actividad antipirética inhibiendo la ciclo-oxigenasa, una enzima responsable de la síntesis de PGE2 (estos antipiréticos no inhiben la producción de TNF-α o IL-1). Los glucocorticoides tienen un efecto antipirético inhibiendo la producción de IL-1 y TNF-α, así como los procesos metabólicos del ácido araquidónico.
IL-1 y TNF-α tienen un papel central en el proceso de la fiebre, ya que interfieren con muchos mecanismos en un organismo y algunos de sus efectos son llevados a cabo con la participación de metabolitos del ácido araquidónico. Así, IL-1 y TNF-α afectan la mielopoiesis, liberan neutrófilos y mejoran sus funciones; producen vasodilatación y aumentan la adhesividad de las células; aumentan la producción de PAF y trombomodulina de las células endoteliales, proteolisis y glicogenolisis en los músculos; mobilizan lípidos de los adipocitos; producen proteosíntesis y glicogenólisis en el hígado; inducen la proliferación de fibroblastos; activan osteoclastos y la liberación de colagenasa de los condrocitos; inducen actividad de ondas lentas en el cerebro durante el sueño; liberan hormona adenocorticotropa (ACTH), beta endorfinas, hormona del crecimiento y vasopresina, insulina, cortisol y catecolaminas. Además, en las operaciones de larga duración el TNF-α y parcialmente también IL-1, pueden producir caquexia principalmente por disminución del apetito, que es lo que ocurre durante las infecciones crónicas y los procesos inflamatorios y neoplásicos.
TNF-α y IL-1 también aumentan en forma significativa durante la respuesta inmmune, activando células-T y estimulando la producción de IL-2. IL-1 también aumenta la proliferación de células-B y como estos procesos tienen una temperatura óptima de 39.5° C, se supone que la fiebre es un factor positivo. La fiebre y los efectos específicos de IL-1 y TNF-α juntos forman procesos muy integrados que están involucrados en la respuesta a la infección y en casos inflamatorios agudos.
Los interferones, particularmente IFN-γ (formado por linfocitos T y células NK) pueden mejorar esas respuestas, aunque varias partes tienen consecuencias protectoras y otras perjudiciales. Por ejemplo, una respuesta de sobrepaso del organismo es la septicemia o choque séptico y en esta complicada reacción no es fácil decidir si la fiebre debe ser tratada con antipiréticos o no. Los síntomas de la fiebre pueden ser eliminados con antipiréticos, pero no es claro si los efectos positivos de la fiebre y todo lo que está conectado con ellos también deben ser suprimidos, ya que la fiebre mobiliza no solamente el sistema inmune, sino tabién procesos que mejoran la nutrición de las células y tienen importancia protectora sobre su actividad.
En la mayoría de las enfermedades, la fiebre es producida por pirógenos. Sin embargo, hay situaciones en las que la fiebre puede ser producida directamente por cambios en el centro de la termoregulación sin la participación de pirógenos exógenos o endógenos y esto es lo que ocurre en casos de tumores, sangrado intracraneal y trombosis.
Causas de la fiebre
Es posible que la fiebre se inicie debido a la producción de pirógenos endógenos, originados a partir de condiciones que pueden dividirse en varios grupos: 1) Infecciones producidas por bacterias, ricketsias, virus y parásitos; 2) reacciones inmunes, incluyendo los defectos en la colágena, anormalidades inmunológicas e inmunodeficiencia adqurida; 3) destrucción de tejidos, como durante traumas, necrosis local (infartos) y reacciones inflamatorias en tejidos y vasos (flebitis, arteritis), infartos pulmonares, cerebrales y miocárdicos y rabdomiolisis; 4) inflamaciones específicas (sarcoidosis, hepatitis granulomatosa); 5) procesos neoplásicos con la participación del sistema linfoendotelial y hematopoiético; tumores sólidos (tumor de Grawitz del riñón, carcinoma del páncreas, tumores pulmonares y esqueléticos, hepatoma). También hay fiebre durante las complicaciones de los tumores sólidos, generalmente durante las metástasis que están asociadas con necrosis del tumor, obstrucción de ductos o infección; 6) fallas metabólicas agudas, como la artritis úrica, porfiria, crisis de Addison, crisis tirotóxica y feocromocitoma; 7) administración de algunas drogas; 8) deshidratación o administración de sales (esta es la razón por la que la fiebre aparece junto con diarrea) y; 9) administración de proteínas foráneas (fracción globulina antitetánica de suero de caballo).
Enfermedades tratadas con fiebre
Sífilis
En 1883, el psiquiatra Julius Wagner von Jaureg (1857-1940) notó que después de contraer erisipela, uno de sus pacientes se recuperaba de una enfermedad mental grave debida a la neurosífilis2. Por lo tanto, en esa época preantibióticos, Wagner-Jaureg empezó a tratar pacientes que sufrían de neurosífilis con microbios benignos que podían ser controlados con las drogas de aquella época. Obtuvo los mejores resultados cuando la infección producía fiebre y esto lo llevó a enfocarse en la malaria, que induce múltiples episodios febriles que pueden ser controlados con quinina1.
Aunque la inducción de fiebre proporcionó beneficios clínicos en el caso de la neurosífilis, varios estudios posteriores mostraron que bloquear la fiebre con drogas antipiréticas resulta en un empeoramiento del pronóstico clínico; esto es, esos resultados no han proporcionado una evidencia definitiva del beneficio de la fiebre debido a sus actividades no-termoreguladoras. En cambio, voluntarios humanos infectados con rhinovirus y a los que se les administró aspirina, acetaminophen o ibuprofen, suprimieron la respuesta de anticuerpos en el suero y la duración de la infección viral y el edema nasal se prolongaron, en comparación con controles infectados, pero no medicalizados2. En otro estudio, los pacientes fueron infectados con influenza A, Shigella sonnei o Rickettsia rickettsii3 y en el caso de la influenza o Shigella (pero no con la Rickettsia), los sujetos que tomaron aspirina o acetaminophen mantuvieron los síntomas más de tres días, en comparación con los sujetos no tratados4.
Otros ejemplos más son los siguientes. En un estudio con placebos para la varicela adquirida en forma natural, el tratamiento con acetaminophen prolongó significativamente la enfermedad4. Un estudio prospectivo hecho al azar a pacientes con traumas y tratados con acetaminophen, fue detenido después de obtener 82 voluntarios, ya que la tasa de mortalidad en el grupo con el tratamiento ‘agresivo’ (acetaminophen y cobijas para enfriamiento administradas cuando la temperatura subía más de 38.5 y 39.5° C respectivamente) era seis veces mayor que en aquellos que recibían tratamientos menos agresivos (acetaminophen y cobijas que no eran usadas hasta que la temperatura excedía los 40° C)5.
Sin embargo, a pesar de las evidencias clímicas y de laboratorio sobre el beneficio de una fiebre moderada, la práctica prevaleciente entre los médicos es bloquear la fiebre, usualmente por medio de compuestos antipiréticos6. Aunque normalmente los pacientes febriles se sienten mejor después de tomar esas drogas, esto se debe a su efecto analgésico y no a la disminución de la fiebre, ya que la asociación de percepción de fiebre con dolor, refuerza la creencia común de que la fiebre es una anormalidad, más que una respuesta regulada de defensa del cuerpo. Se ha indicado que especialmente en la población pediátrica, prescribir analgésicos (que generalmente también son antipiréticos) es beneficial debido al mejoramiento en la actividad y alimentación, lo que puede ayudar a una ingesta adecuada de fluidos para mantener la hidratación y a monitorear los signos de una enfermedad seria (7) .
Cáncer
Así como Wagner-Jauregg obtuvo mejorías produciendo fiebres altas a pacientes con neurosífilis, los médicos alemanes Busch8, Fehleisen9 y Richter10 buscaron esa misma mejoría en pacientes con cáncer, a los que inyectaron en forma sucutánea la toxina de la erisipela. Este tratamiento se basó en la observación de que pacientes con cáncer que tenían un periodo de fiebre después de cirugía, sobrevivían un tiempo significativamente más largo que los pacientes que no lo tenían11.
Estos resultados llevaron a William B. Coley (1862-1936), un médico del Memorial Sloan-Kettering Cancer Center, en Nueva York, a desarrollar un coctel con un lisado de las bacterias Serratia marcescens y Streptococcus pyogenes, que utilizó principalmente para tratar sarcomas inoperables en tres subgrupos de pacientes con cáncer de ovario, cáncer de mama y enfermedad regional postmenopáusica, en los que obtuvo una curación mayor al 10%12), (13), (14), (15), (16. Desde entonces, numerosos investigadores han usado diferentes productos bacterianos para intentar producir una respuesta inmune inespecífica, con la esperanza de estimular actividades celulares antitumorales.
Ya a mediados del siglo XX, Issels17 continuó tratando con una mezcla de vacuas bacterianas (MBV) a pacientes con cáncer y en los años ochenta Hager y Abel18 estimularon la investigación clínica y el uso terapeútico de la hipertermia activa con vacunas bacterianas y radiación infraroja. Se ha sugerido que un prerrequisito importante para el éxito de una respuesta imunológica e inducción de citotoxicidad en el tumor, es la preactivación del anfitrión19 y en la época de Coley eso era la preexposición de numerosas personas al bacilo Calmette-Guerin (BCG), pero en 1975 se detectó TNF en un ratón pretratado con BCG20.
Se ha demostrado que la epidemiología de la incidencia de cáncer y de las infecciones febriles tienen una correlación inversa, y frecuentemente se ha informado que las remisiones espontáneas están asociadas con infecciones febriles20.
Enfermedades producidas por fiebre: ¿Autismo?
El autismo es un problema del desarrollo del sistema nervioso que está aumentando en la población pediátrica. Por ejemplo, aunque en 1966 su prevalencia en EUA era de 4.5 casos/10,000 nacimientos, estudios recientes muestran una incidencia de 34 casos/10,000 nacimientos.
En 194321 se describió al autismo como un problema del desarrollo nervioso, con limitaciones sociales, intereses restringidos y anormalidades en el comportamiento verbal y no verbal. Actualmente, todavía se sabe poco sobre su etiología y el diagnóstico se hace por criterios conductuales, ya que no se han encontrado marcadores biológicos; sin embargo, se ha propuesto que hay un fuerte componente familiar y etiologías basadas en infecciones, autoinmunidad y factores citocinéticos.
Se ha descrito que 43% de madres con hijos autísticos tuvieron infecciones del tracto respiratorio, periodos como influencia o infecciones vaginales o urinarias, comparado con sólo el 20% de las madres control2. Otros estudios muestran que en las ratas la exposición materna a infecciones altera en forma profunda los niveles de citocinas proinflamatorias en el medio ambiente fetal, incluyendo el cerebro, y también se ha propuesto que estos cambios pueden tener un impacto significativo sobre el cerebro en desarrollo23), (24. Todos estos datos sugieren que al menos algunos casos el autismo pueden ser una secuela de infecciones patógenas, especialmente las de origen viral25), (26), (27), (28.
Sin embargo, como en el autismo no hay lesiones patológicas, las anormalidades sutiles encontradas en el cerebelo, regiones CA1-CA4 del hipocampo, corteza entorhinal, amígdala, diferencias conductuales o imbalance en las citocinas y factores de desarrollo cerebral, sugieren que un componente importante de la patogénesis podría deberse a un desarrollo cerebral anormal29), (30), (31.
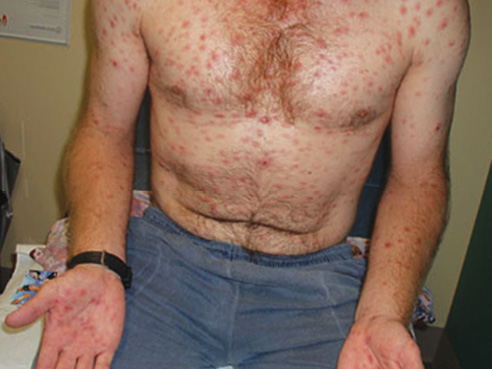
Es frecuente que las infecciones, incluyendo las vacunaciones, resulten en fiebre. Por ejemplo, después de la vacunación contra sarampión, paperas y rubeola, del 50 al 60% de niños pequeños desarrollan fiebre que sólo en raras ocasiones es dañina, aunque fiebres extremas de 42.2° C pueden causar daño cerebral. Sin embargo, fiebres de 41° C deben ser atendidas inmediatamente para examinar al paciente sobre la posibilidad de una infección grave.
Hay dos vías nerviosas relacionadas con la fiebre. Una de ellas se puede demostrar con la inyección intraperitoneal de polisacáridos (LPS), un potente pirógeno, que resulta en la producción de varias citocinas provenientes de órganos viscerales. Estos compuestos son polipéptidos involucrados en la inflamación, activación inmune, diferenciación y muerte celular que incluyen interleucinas, interferones, factores de necrosis tumoral, quimocinas y factores de crecimiento. Generalmente en los tejidos saludables tienen pocas o ninguna función, pero pueden ser inducidos rápidamente en respuesta a lesión, inflamación o infección. Se cree que una señal de la IL-1b inicia la información aferente que viaja por el nervio vago al hipotálamo para aumentar la IL-1b hipotalámica que, a su vez, produce un aumento en la IL-6 hipotalámica que eleva el valor de referencia termoregulador. Esta vía es mediada por prostaglandinas y puede ser bloqueada por inhibidores de la ciclooxigenasa (antipiréticos). Estas dos citocinas también son importantes en la inflamación y comúnmente se denominan citocinas proinflamatorias.

Fotos: otorgada por el autor
Arreglo experimental para proporcionar un área de calor a la iguana. Recuadro. Gráfica de sobrevivencia a lo largo del tiempo con las iguanas a diferentes temperaturas después de ser infectadas con la bacteria Aeromonas hydrophila. Entre paréntesis se encuentra el número de iguanas usado.
La segunda vía de la fiebre también se inicia en el hipotálamo por señales aferentes del nervio vago y es mediada por una quimocina, la proteína-1 inflamatoria de los macrófagos (MIP-1), que es producida localmente. Parece que la MIP-1 actúa directamente sobre el hipotálamo anterior vía un mecanismo que no involucra la prostaglandina y tampoco es bloqueado por antipiréticos32.
La fiebre es metabólicamente cara, ya que cada 1° C de elevación de la temperatura aumenta la tasa metabólica aproximadamente 10%. Por lo tanto, parece razonable que un mecanismo de defensa que ha evolucionado durante más de 10 millones de años y es tan costoso en términos de energía, debe ser importante. Numerosos estudios han mostrado que la fiebre mejora la respuesta inmune, aumenta la mobilidad y actividad de los leucocitos, estimula la producción de interferones, produce la activación de los linfocitos-T e, indirectamente, y reduce la concentración de hierro en el plasma.
Las propiedades antivirales y antibacteriales de interferones también aumentan durante las temperaturas febriles33), (34 y en una variedad de infecciones, la fiebre se ha asociado con una disminución en la tasa de morbilidad y mortalidad. Animales recién nacidos infectados con una variedad de virus tienen una tasa de sobrevivencia mayor cuando están febriles35 y el uso de antipiréticos para suprimir la fiebre resulta en un aumento en la tasa de mortalidad en conejos infectados con bacterias36 y en un aumento en la producción del virus de la influenza en ferretes37.
La eliminación de la fiebre durante el embarazo puede tener efectos sobre el feto. Goetzl et al38 mostraron que el tratamiento de la fiebre epidural con acetaminophen disminuye en forma significativa los niveles de IL-6 en el suero materno y fetal al momento del nacimiento, lo que puede ser significativo porque parece que el feto es incapaz de producir IL-6 al nacimiento y depende del IL-6 materno39. Aunque la expresión de citocinas en el SNC es muy baja, en ciertas condiciones las neuronas pueden producir citocinas específicas, así como receptores a las citosinas24. Por ejemplo, tanto la IL-6 como su receptor inespecífico (IL-6R) son expresados por neuronas y células gliales, incluyendo astrocitos y hay evidencias de que IL-6 es importante en el desarrollo, diferenciación, regeneración y degeneración de neuronas en el SNC40. Se sabe que IL-6 promueve la diferenciación de células precursoras de los astrocitos y también funciones como el factor de diferenciación para neuronas del SNC y SNP.
Estas y otras evidencias41), (42), (43 sugieren que la etiología del autismo involucra infecciones de la madre embarazada o del infante. La mayor parte de las infecciones resulta en una fiebre que en forma rutinaria es controlada con antipiréticos como el acetaminofén; sin embargo, el bloqueo de la fiebre inhibe un proceso que durante millones de años de desarrollo ha protegido contra las infecciones bacterianas y los mecanismos inmunes en el SNC son parte de este proceso protector. Por lo tanto, se ha propuesto que el bloqueo de la fiebre con antipiréticos interfiere con el desarrollo inmunológico normal en el cerebro, lo que lleva a problemas de su desarrollo y a autismo en algunos individuos genética e inmunológicamente predispuestos. Este efecto puede ocurrir en el útero o una edad muy temprana cuando el sistema inmunológico está en desarrollo. Por lo tanto, es aconsejable dejar el uso de antipiréticos sólo para cuando se desarrollen fiebres graves44.
Beneficios de la fiebre
Se dice que como la fiebre es producida por nuestras propias citosinas, debería ser más beneficial que dañina, de lo contrario la evolución la hubiera eliminado. Aunque esto es una visión simplista del problema, aun así podemos hacer una lista de sus posibles beneficios, ya que la fiebre podría: 1) Dañar directamente los patógenos extraños al cuerpo; 2) inducir apoptosis de las células infectadas y las neoplásicas; 3) inducir la formación de proteínas de choque de calor en el anfitrión para proteger sus propias células; 4) inducir proteínas de choque de calor en los patógenos para activar respuestas inmunes como ‘señales de peligro’; 5) aumentar la eficacia de las respuestas inmunes, ya que estas trabajan mejor a temperaturas elevadas, y; 6) disminuir la respuesta inmune produciendo apoptosis de neutrófilos y linfocitos.
La razones 1 y 2 son las que se ofrecen más comúnmente, con el argumento de que la fiebre puede ser considerada como un estresor de calor45, un argumento que se basa en que como los patógenos lo son porque crecen y se multiplican rápidamente, se hacen relativamente más vulnerables que las células del anfitrión. Además, los patógenos ya están sujetos a estresores en el sitio de la infección.
Hay tres citocinas endógenas que actúan sobre los receptores de las células endoteliales en los núcleos dorsomedial y paraventricular del hipotálamo, las interleucinas 1b (IL-1b), el factor de necrosis tumoral (TNF) y la interleucina 6 (IL-6). Además, se ha demostrado que el liposacárido bacteriano exógeno (LPS o endotoxina) también estimula el hipotálamo vía los receptores ‘toll-like’ e induce cambios similares a los que se observan con citocinas pirogénicas46.
El hipotálamo responde a esas señales químicas produciendo prostaglandina E2 (PGE2) y esto eleva el valor de referencia47 lo que, a su vez, indica al sistema nervioso central y periférico a convertir su energía en calor, por medio de cambios endócrinos, autónomos y conductuales48. Por ello sentimos frío conforme el cuerpo intenta igualar el valor de referencia más elevado y hasta que la fiebre ‘rompe’, frecuentemente hay oscilaciones en la temperatura alrededor de ese valor que explican la experiencia de frío durante la fiebre; dependiendo del agente, los antipiréticos trabajan bloqueando la síntesis de PGE2 en varios niveles.
La fiebre es un proceso muy regulado y es una característica muy primitiva que se encuentra en animales vertebrados endotérmicos y ectotérmicos, así como en invertebrados49. Evidencias claras de que este proceso puede ayudar al anfitrión a luchar contra los patógenos invasores fueron proporcionadas durante un estudio en iguanas del desierto (Dipsosaurus dorsalis), a las que se les indujeron infecciones bacterianas50. Como las iguanas son animales ectotermos sólo tienen un mecanismo conductual de termorregulación y en este estudio todas las iguanas afectadas que elevaron su temperatura moviéndose a una zona cálida, sobrevivieron la infección; en cambio, a las que se les impidió moverse se hicieron débiles y murieron. Estos mismos resultados han sido observados en otros animales ectotermos.
La elevación de la temperatura en un anfitrión es en detrimento del crecimiento e incluso letal para muchas bacterias y virus51), (52. Sin embargo, una elevación de la temperatura del cuerpo puede restaurar las condiciones membranales óptimas en las células afectadas por la infección, facilitando la respuesta inmune53 ya que los niveles de hierro en el plasma declinan (cambian a ferritina) durante la fase mediada por citocinas, suprimiendo en esta forma la reproducción bacteriana54), (55.
Durante el ejercicio, un aumento en la producción de calor metabólico produce un aumento en la temperatura del núcleo del cuerpo, que excede la temperatura de referencia termoregulatoria. En respuesta a esa desigualdad entre la temperatura actual y el valor de referencia, se inician mecanismos efectores para la disipación de calor, como el sudor y la vasodilatación cutánea. En cambio, durante la hipertermia el enfriamiento de la piel por convección o aplicación de agua fría, ayuda a eliminar el exceso de calor, llevando la temperatura corporal a valores cercanos al de referencia, reduciendo el error y por lo tanto proporcionando una sensación de bienestar.
Los resultados obtenidos por Kluger y colaboradores, han sido tomados como evidencia de que la fiebre es un mecanismo que ayuda al cuerpo a luchar contra los microbios invasores y que, por lo tanto, no debe tratarse a menos que se eleve a valores peligrosos para el individuo. Actualmente, se piensa que esta es la forma como los organismos han luchado contra las infecciones desde tiempos ancestrales y esta información constituye un ejemplo claro de la conveniencia de enfocar problemas clínicos a través de un punto de vista evolutivo.
LOS ANTIPIRÉTICOS
La Aspirina ®
La historia de la Aspirina® tiene miles de años y se remonta al uso de preparaciones de plantas que contienen salicilato, ya que alrededor de 1876 Maclagan56 usó el amargo principio activo del sauce blanco, salicin, para reducir la fiebre, el dolor y la inflamación de la fiebre reumática. Ese mismo año, Kolbe y sus colegas formaron la Heyden Chemical Company y sintetizaron el ácido salicílico. Este éxito estimuló a Frederick Bayer a buscar un derivado comparable, y Arthur Eichengrün, el jefe de los laboratorios de investigación de Bayer, en 1895 asignó ese trabajo al químico Felix Hoffman, quien acetiló el grupo hidróxilo del anillo benzénico del ácido salicílico y probó su efectividad dándole la droga a su padre, quien padecía de artritis.
El nombre de Aspirina® le fue puesto a la droga por Heinrich Dresser57, posiblemente en honor a St. Aspirinius, un antiguo Obispo napolitano que era el santo patrón contra los dolores de cabeza. Sin embargo, otros indican que la palabra deriva de Spiraea, el nombre Lineano del género de la planta a la que pertenece el sauce. Ya en 1971, el farmacólogo británico John Robert Vane58 mostró que la Aspirina® suprimía la producción de prostaglandinas y tromboxanos, trabajo por el que ganó el Premio Nobel en Fisiología y Medicina de 1982.
La Aspirina® también es conocida como ácido acetilsalicílico y es una de las drogas más usadas en el mundo.
Es un analgésico, antiinflamatorio, antipirético e inhibidor de la agregación de plaquetas. Además, inhibe la ciclooxigenasa de los ácidos grasos acetilando el sitio activo de la enzima y sus efectos farmacológicos se deben a que inhibe la formación de productos ciclooxigenados, incluyendo prostaglandinas, tromboxanos y prostaciclinas.
Actúa como un inhibidor ireversible de la prostaglandin-sintetasa, también conocida como ciclooxigenasa, que es una enzima clave en el metabolismo de los eicosanoides (‘eico’ es un prefijo que indica 20). Estos son un tipo de lípidos que actúan sobre hormonas llamadas ‘locales’ porque tienen efectos cerca del sitio donde se forman y que incluye a las prostaglandinas, prostaciclinas, tromboxanos y leucotrienos. Los lípidos eicosanoides derivan del ácido araquidónico, un ácido graso poliinsaturado de 20 carbonos.
El araquidonato se sintetiza en el hígado a partir del ácido linoleico (un ácido graso esencial) y se incorpora a los fosfolípidos o diglicéridos, que son transportados con las lipoproteínas a tejidos fuera del hígado, donde los fosfolípidos se incorporan a las membranas celulares. El araquidonato en los fosfolípidos de la membrana es liberado por la fosfolipasa A2 y puede seguir una de dos vías: 1) la lineal, (vía de la lipooxigenasa) que produce leucotrienes, y; 2) la cíclica, (sintetasa PG o ciclooxigenasa), que produce prostaglandinas, prostaciclinas y tromboxanos. La prostaglandina sintetasa cataliza el paso en la vía cíclica y tiene dos actividades, como una ciclooxigenasa popularmente conocida como COX y como una peroxidasa. La sintetasa prostaglandina convierte el araquidonato en prostaglandina H2.
Hay 3 tipos de prostaglandina sintetasa o isoenzimas COX: 1) COX-1 constitutiva (prostaglandina-endoperóxido sintetasa 1, codificada en el cromosoma 9); 2) COX-2 inducible (prostaglandina-endoperóxido sintetasa 2, codificada en el cromosoma 1) y; 3) COX-3, una enzima descubierta por medio de análisis Northern en corteza cerebral de perro usando ácido desoxiribonucléico complementario (ADNc) COX-1 como punta de prueba y que es el blanco de la droga acetaminophen54. COX-1 se encuentra en la mayor parte de las células de mamíferos, mientras COX-2 es inducible en macrófagos y otras células como respuesta a la inflamación (algunas drogas como aspirina inhiben ambos tipos de ciclooxigenasas, mientras otras drogas son inhibidores específicos de COX-2). COX-3 se encuentra en gran abundancia en la corteza cerebral de humanos, aunque su papel en el dolor, fiebre e inflamación no es claro todavía.
La actividad de la Aspirina® sobre la prostaglandina sintetasa se basa en la transferencia de un grupo acetil de la Aspirina® (recordar que la Aspirina® es un ácido acetil salicílico) a un grupo hidroxilo de un aminoácido en el sitio activo de la enzima. Esta es una reacción de esterificación, de manera que la unión que se forma es covalente y esto significa que la inhibición es irreversible.
Aunque COX-2 es el blanco terapéutico de la Aspirina®, es su interacción con COX-1 en el tracto gastrointestinal lo que produce los efectos colaterales indeseables de la droga, ya que COX-1 es necesaria para mantener la gruesa cubierta del estómago. Como la Aspirina® descompone la enzima COX-1, su uso regular puede llevar al adelgazamiento de la mucosa que protege las células de los jugos gástricos.
Se ha demostrado que la Aspirina® también tiene tres modos de acción adicionales. Al difundir desde el espacio de la membrana interna como un portador de protones y de regreso a la matriz mitocondrial, se ioniza de nuevo para liberar protones, desacoplando la fosforilación oxidativa en mitocondrias cartilaginosas y hepáticas; esto es, la Aspirina® amortigua y transporta los protones.
Las dosis altas de Aspirina® pueden producir fiebre debido al calor liberado por la cadena de transporte de electrones, lo contrario a su actividad antipirética a dosis bajas. Además, la Aspirina® induce la formación de radicales NO en el cuerpo, que se ha demostrado que tienen un mecanismo independiente de reducir la inflamación en ratones. Esta reducción en la adhesión de leucocitos es también un paso importante en la respuesta inmune a la infección, aunque no hay suficientes evidencias para mostrar que la Aspirina® ayuda a combatir una infección.
Datos más recientes sugieren que el ácido salicílico modula la inflamación a través de señalización con NF-kB, un factor de transcripción que tiene un papel en muchos procesos biológicos. Por ejemplo, la Aspirina® reduce los efectos de la vasopresina y aumenta los de la naloxona sobre la secresión de ACTH y cortisol por el eje hipotálamo-hipófisis-adrenal. Se dice que esto ocurre a través de una interacción con las prostaglándinas endógenas y su papel en la regulación del eje HHA.
El Tylenol ®
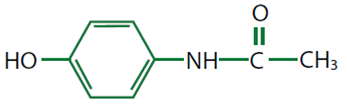
Hay un grupo de compuestos que tienen efectos similares a los de la Aspirina® y que frecuentemente están relacionados químicamente. Uno de ellos es el acetaminofén (Tylenol®), un antipirético y analgésico, pero sólo débilmente antiinflamatorio.
Al bloquear la formación y liberación de prostaglandinas, el acetaminofén inhibe la actividad de agentes productores de fiebre en los centros cerebrales reguladores. Sin embargo, a diferencia de la Aspirina®, no tiene efectos significativos sobre las prostaglandinas involucradas en otros procesos y normalmente es metabolizado en el hígado y riñón por enzimas P450.
Actualmente, se sabe poco sobre la regulación temporal de COX-3, pero parece ser inhibido en forma selectiva por acetaminophen, así como por otros analgésicos y antipiréticos sintéticos. Más aún, a diferencia de otras drogas, acetaminofén puede cruzar la barrera hematoencefálica, permitiéndole alcanzar concentraciones suficientes para inhibir COX-3, lo que explica en forma parcial por qué es más eficaz que otras drogas contra el dolor de cabeza y la fiebre. Sin embargo, es claro que se necesita mucha más información sobre su modo de acción en el cerebro.
Aunque se supone que el acetaminofén tiene menos efectos colaterales que la Aspirina®, una sobredósis aguda puede producir daños graves al hígado. Sin embargo, esta droga produce menos problemas gástricos y acúfenos (ruidos), por lo que es un sustituto razonable de la Aspirina®, particularmente en pacientes que no la toleran, lo que incluye aquellos con úlceras y enfermedades gástricas o aquellos en los que la actividad anticoagulante es indeseable.
En ocasiones, el acetaminofen se combina con la Aspirina® en una sola tableta para mejorar la artritis y otras condiciones dolorosas y también es posible añadirle cafeína, antihistamínicos, agentes descongestionantes y sedativos.











 nueva página del texto (beta)
nueva página del texto (beta)