En esta entrega de “Desde la trinchera de las ciencias básicas” comentaremos los trabajos de Randy W. Schekman (nacido en Estados Unidos, 1948), James E. Rothman (Estados Unidos, 1950) y Thomas C. Südhof (Alemania, 1955), que les han hecho merecedores del Premio Nobel en Medicina o Fisiología del 2013. Trabajos, aparentemente muy distantes entre sí, de genética microbiana, bioquímica y biología molecular que han convergido para explicar, entre otras muchas funciones celulares, la liberación de los neurotransmisores en la sinapsis neuronal, sin la cual nuestro sistema nervioso dejaría de funcionar.
A finales de los años setenta, el grupo de Schekman generó y caracterizó un tipo de mutantes de Saccharomyces cerevisiae que eran deficientes en la secreción de enzimas al exterior celular. El aspecto al microscopio electrónico de estas mutantes (Figura 1) revelaba una acumulación de vesículas intracelulares repletas de enzimas que normalmente se liberan al exterior de la célula y que en la mutante quedaban atascadas en las vesículas. Este fenotipo de deficiencia en la secreción, les ganó el nombre de mutantes sec, de las cuales el grupo de Schekman caracterizó e identificó a los genes responsables de un buen número de ellas.

Figura 1 Mutante sec 1 en Saccharomyces cerevisiae. Foto tomada con microscopio electrónico de la mutante sec 1 a 37o C, temperatura a la cual manifiesta el fenotipo de acumulación de vesículas secretorias (Ve). (Tomada de: Novick P, Schekman R, 19792).
Al mismo tiempo, el grupo de Rothman, se encontraba estudiando el “tráfico vesicular en el Golgi”, es decir, los movimientos de maduración de las vesículas que componen a este organelo intracelular. Con ese propósito, Rothman montó un ingenioso ensayo bioquímico que le permitió purificar las proteínas responsables de este proceso en células mamíferas.
Rothman y sus colaboradores descubrieron que muchas de estas proteínas eran equivalentes a las proteínas SEC identificadas por Schekman en la levadura y que además incluían algunas previamente encontradas en vesículas presinápticas. Las aportaciones de Südhof en la bioquímica y la fisiología de la sinapsis vinieron a poner todos estos hallazgos en un importantísimo contexto fisiológico, pues una de las proteínas descubiertas en su laboratorio, la sinaptotagmina, resultó ser el regulador clave de una de las maquinarias de secreción vesicular: la encargada de la liberación de neurotransmisores.
Por cierto, es importante resaltar que Südhof es un médico que hizo su entrenamiento posdoctoral en el grupo de Michael S. Brown y Joseph L. Goldstein, también médicos y también ganadores del Nobel de Medicina (1985).
Las proteínas que descubrieron Schekman, Rothman y Südhof son las responsables de un proceso celular fundamental: la fusión de membranas, clave para la migración de vesículas por el interior celular, desde su generación en el retículo endoplásmico, hasta el compartimiento celular que sea su destino final. Como se podrá imaginar, este proceso es crucial para el buen funcionamiento de la célula, pues debe tener una direccionalidad precisa en tiempo y espacio. Esto ocurre de manera espectacularmente brillante durante la liberación de los neurotransmisores desde las vesículas presinápticas (Figura 2).
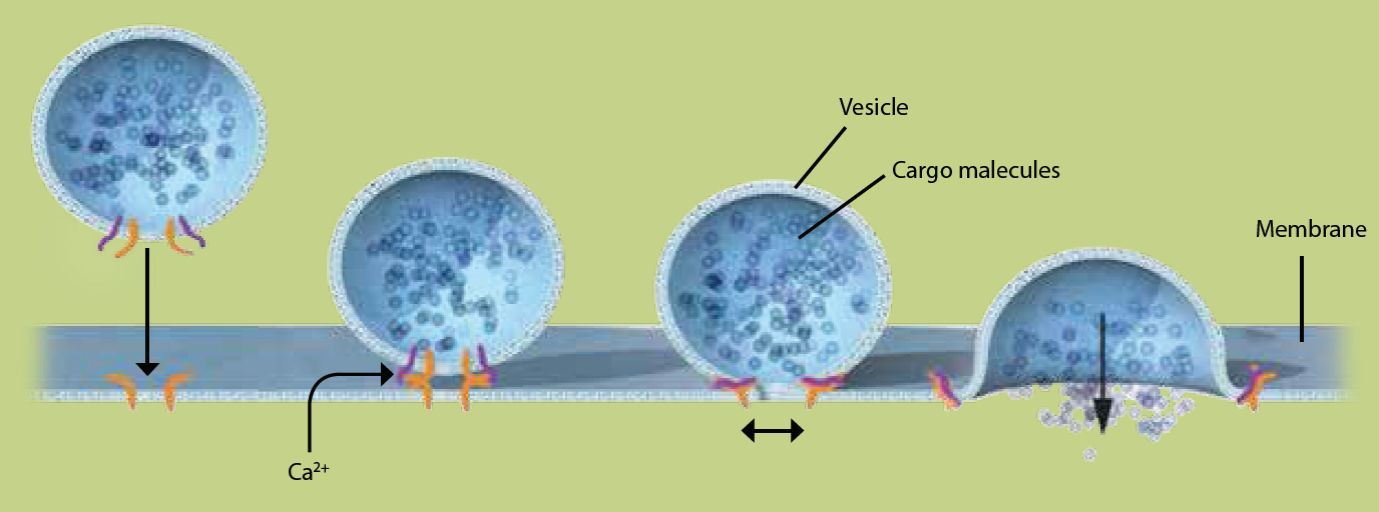
Figura 2 Liberación de neurotransmisores al espacio intersináptico. La vesícula presináptica (esfera a la izquierda del esquema) cargada de neurotransmisores, se localiza en la vecindad de la membrana plasmática, lista para secretar su carga al recibir un impulso nervioso. Este último es transmitido por una despolarización axonal que, al llegar al botón sináptico, ocasiona una rápida entrada de iones de calcio (Ca++). Esto, a su vez, ocasiona la fusión de las bicapas lipídicas que componen a la vesícula y la membrana plasmática, liberando la carga de neurotransmisores. Las proteínas mediadoras de este proceso se ilustran en anaranjado y púrpura y se describen más detalladamente en el texto y en las Figuras 3 y 4. (Tomada de: http://www.nobelprize.org/nobel_prizes/medicine/).
La maquinaria proteica que opera el “tráfico vesicular” está compuesta por diversas proteínas que se pueden clasificar como SNARE y SM. Este tema ha sido revisado recientemente por Südhof y Rothman en un excelente y recomendable artículo1. Las SNARE son proteínas insertadas en la bicapa lipídica de la vesícula o en la bicapa de la membrana blanco con la cual la vesícula deba fusionarse (V-SNARE y T-SNARE, respectivamente, Figura 3). Los extremos amino de las SNARE se asocian formando complejos que acercan a las bicapas de la vesícula y su membrana de destino. Esta asociación está mediada por regiones alfa-hélices en sus partes extramembranales que se trenzan entre sí.
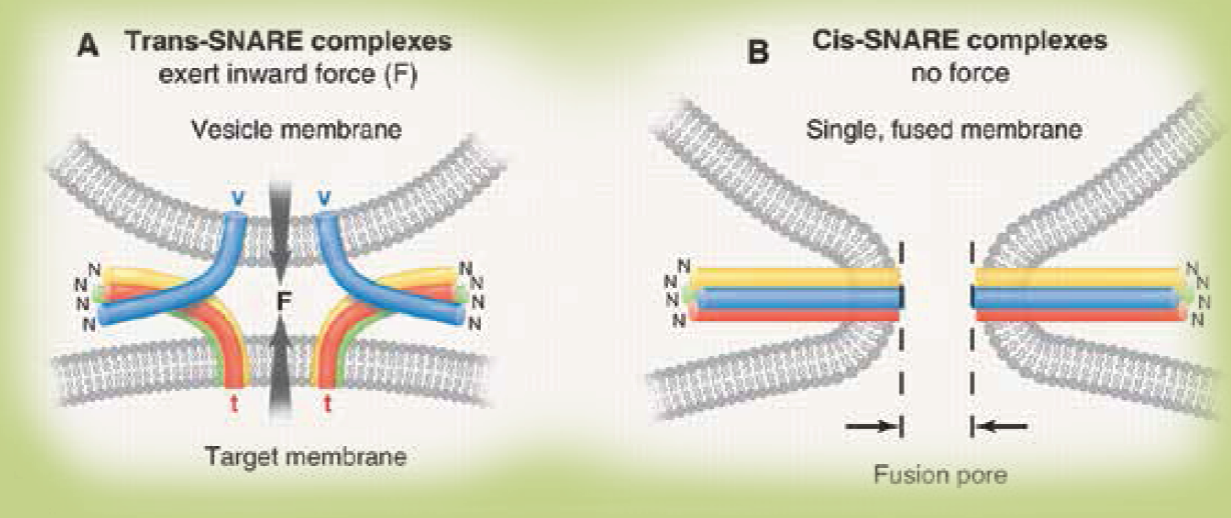
Figura 3 Modelo del “zipper” para la fusión de membranas catalizada por proteínas tipo SNARE. Las SNARE son proteínas insertadas en la bicapa lipídica de la vesícula (V-SNARE, cilindro azul) o de la membrana blanco con la cual la vesícula deba fusionarse (T-SNARE, cilindros rojo, amarillo y verde). Las SNARE forman complejos mediadores de la fusión de las membranas en que estén insertadas. El modelo del “zipper” propuesto para este proceso predice que es un evento espontáneo que en las células vivas debería ser necesariamente regulado. Es fácil imaginar que un interruptor que mantenga al complejo trans-SNARE (panel A) preparado para convertirse en un complejo cis-SNARE (panel B) sería una manera práctica de efectuar tal regulación. (Tomada de la Figura 2 de la referencia 1: Science. 2009;323:474-7).
El panel A de la Figura 3 ilustra un complejo trans-SNARE, en el que esta interacción ha iniciado y, que a menos de que otras proteínas interfieran, desembocará en el “cierre del zipper”; es decir, la completa reunión de las cuatro SNARE, catalizando la fusión membranal (panel B, complejo Cis-SNARE, Figura 3). Es importante destacar que esta interacción molecular es termodinámica favorable y genera una fuerza que tiende a fusionar las bicapas de manera espontánea. De ahí que su regulación fisiológica se puede alcanzar si se usan proteínas que frenen el “cerrado del zipper”, dejando a la vesícula en un estado previo a la fusión, en espera de un estímulo que libere el freno y la concluya. Este es el caso de la sinaptotagmina, una proteína descubierta por Südhof, mediadora del acoplamiento entre impulso nervioso y la liberación de los neurotransmisores en la sinapsis neuronal.
La Figura 4 ilustra las estructuras tridimensionales de las proteínas que participan en la fusión de membranas, dando una idea de cómo llevan a cabo sus funciones. En el panel A se ilustra la “trenza” de alfa-hélices que reúne a 4 SNARE en un complejo tipo cis. Las proteínas SM (panel B) son proteínas citoplasmáticas que no están insertadas en la bicapa membranal, pero que se unen específicamente a las SNARE. El nombre SNARE, “SNAP receptor” se originó del hecho de que una SM, llamada SNAP, se asociaba con estas proteínas transmembranales de una manera análoga en la que una hormona polipeptídica, como la insulina, lo hace con su receptor. Estas asociaciones SNARE-SM permitieron a Rothman purificar SNARE usando como cebo a sus correspondientes SM. Las proteínas SM son de muchos tipos y tienen varias funciones. Por ejemplo, pueden poner un freno a la espontaneidad de la fusión o pueden separar los componentes de los complejos Cis-SNARE, permitiendo su reutilización en múltiples ciclos de fusión vesicular. La importancia de las proteínas SM queda de manifiesto por el hecho de que muchas mutantes sec son ocasionadas por la pérdida de función de diversas SM.

Figura 4 Estructuras tridimensionales de las proteínas que participan en la fusión de membranas. Nótese que los esquemas derivados de las respectivas estructuras cristalográficas de estas proteínas, están hechos a una escala aproximada a su tamaño verdadero con respecto a las bicapa lipídica. Panel A: la “trenza” de alfa-hélices que reúne a 4 SNARE, en un estable complejo tipo cis. Panel B: ejemplo de proteínas SM que no están insertadas en la bicapa membranal, pero que se unen específicamente a las SNARE. Panel C: La complexina, asociada con la trenza de SNARE. Panel D: La sinaptotagmina une iones Ca++ en sus dominios C. (Tomada de la Figura 1 de la referencia 1: Science. 2009;323:474-7).
Algunas otras proteínas pueden asociarse con los complejos SNARE y con ello regular fisiológicamente algún evento de fusión vesicular. Esto se ejemplifica en la liberación sináptica de neurotransmisores, regulada por la complexina y la sinaptotagmina (panel C y D respectivamente, Figura 4). La complexina, que también adopta una estructura alfa-hélice, se asocia con la trenza de SNARE e impide el cierre completo del zipper. Esto mantiene a las SNARE en un complejo trans que está a un sólo paso de completar la fusión de la vesícula presináptica a la membrana plasmática.
La sinaptotagmina es una proteína membranal capaz de unir Ca++ en sus dominios C que están expuestos al citoplasma celular. Al unir iones Ca++ generados por la llegada de un impulso nervioso, la sinaptotagmina altera su conformación y actúa sobre la complexina, separándola de las SNARE, lo que permite una rapidísima fusión vesicular y la consecuente liberación de neurotransmisores justo en el momento fisiológico requerido.
Los trabajos de Schekman, Rothman y Südhof (Figura 5), han dado luz sobre muchos fenómenos fisiológicos relevantes. Los mecanismos que operan y regulan la secreción y el tráfico vesicular han quedado delineados por el modelo del zipper, el cual es válido para muchos procesos celulares. El caso particular de la liberación de neurotransmisores en la sinapsis neuronal atestigua sobre la relevancia de estos descubrimientos. De hecho, vale la pena mencionar que las toxinas del tétanos y del botulismo son proteasas, que degradan específicamente a las SNARE sinápticas, bloqueando la fusión de vesículas sinápticas y explicando muy bien sus efectos patológicos. Sin duda la ciencia médica está en deuda con estos 3 combatientes de nuestra trinchera.

Figura 5 Los galardonados: James E. Rothman, Randy W. Schekman y Thomas C. Südhof. (Tomada de: http://www.nobelprize.org/nobel_prizes/medicine/)











 nueva página del texto (beta)
nueva página del texto (beta)


