Introducción
El bazo es un órgano wwclave en la inmunoregulación por su capacidad para vincular la inmunidad innata y adaptativa. El hipoesplenismo se define como el deterioro adquirido en la función del bazo causada por varias enfermedades de etiología hematológica, autoinmune, infecciosa y oncológica. La asplenia es un término que refiere la ausencia del bazo, condición que rara vez es congénita y obedece principalmente a causas de índole quirúrgica, sobre todo la relacionada con el trauma1.
El hipoesplenismo y la asplenia confieren un elevado riesgo de adquirir infecciones, particularmente con microrganismos encapsulados que se asocian a una mortalidad superior al 80%. Debido a la elevada morbimortalidad, la evolución fulminante y la refractariedad al tratamiento habitual de las infecciones causadas por bacterias encapsuladas, la prevención a través de la información, educación, vacunación y profilaxis con antibióticos resulta una prioridad para reducir el riesgo de morbilidad y mortalidad en este grupo de pacientes2.
El objetivo de este trabajo es revisar los conceptos actuales del síndrome de sepsis postesplenectomía (SSPE), (OPSI syndrome, por sus siglas en inglés, overwhelming postsplenectomy infecction syndrome) y enfatizar en la prioridad y necesidad de implementar un programa nacional y multiinstitucional relacionado al manejo y seguimiento de estos pacientes.
Caso clínico
Paciente mujer de 27 años con antecedente de púrpura trombocitopénica idiopática en 2001 que se manejó con esteroides y esplenectomía. Sin antecedente de vacunación ni seguimiento. Diez años después de la esplenectomía inició con cuadro de presentación súbita caracterizado por fiebre de 39° C y ataque al estado general. En las 24 h previas al ingreso hospitalario se agregó desorientación y disnea. A su ingreso a la Unidad de Terapia Intensiva (UTI) presentaba presión arterial de 80/40 mmHg, frecuencia cardiaca de 120 lpm, frecuencia respiratoria de 26 rpm, temperatura axilar de 39° C, acrocianosis, SpO2 al aire ambiente del 70% que corrigió al 80% con mascarilla facial más bolsa reservorio. En gasometría arterial con acidosis láctica e hipoxémia que requirió de intubación y ventilación mecánica.
De los estudios de laboratorio presentó hemoglobina de 10 g/dL (13.0-17.0); hematocrito de 32% (39.0-51.0); plaquetas, 70 × 103/μL (150-450); leu-cocitos totales, 34 × 103/μL (4.5-11.0); neutrófilos absolutos, 30.9 × 103/μL (1.8-7.0); linfocitos absolutos, 0.3 × 103/μL (1.2-4.9); bandas, 1 × 103/μL (0.0-0.7); tiempo de protrombina (TP), 15.6” (9.0-12.0); INR, 1.41 (0.5-1.9); tiempo tromboplastina parcial activado (TTPa), 45.2” (24.4-31.8); dímero D de 104,000 ng/mL (0-199); glucosa, 70 mg/dL (72-100); creatinina, 3.57 mg/dL (0.44-1.03); BUN, 36 mg/dL (8.0-20.0); ácido úrico, 6.2 mg/dL (2.6-8.0); lactato, 9 mmol/L (<1); BNP de tipo B, 1,229 pg/mL (<100); albumina, 3.0 g/dL (3.5-4.8); bilirrubina total, 0.97 mg/dL (0.40-1.50); bilirrubina directa, 0.32, mg/dL (0.0-0.30); aspartato aminotransferasa, 144 U/L (14-54); alanino aminotransferasa, 60 U/L (15-41); fosfatasa alcalina, 122 U/L (32-91); gammaglutamina aminotransferasa, 22 U/L (7-50); deshidrogenasa láctica, 380 U/L (98-192); amonio sérico, 100 μg/dL; proteína C reactiva, 323 mg/L; procalcitonina, 32 ng/mL (0.0-0.05).
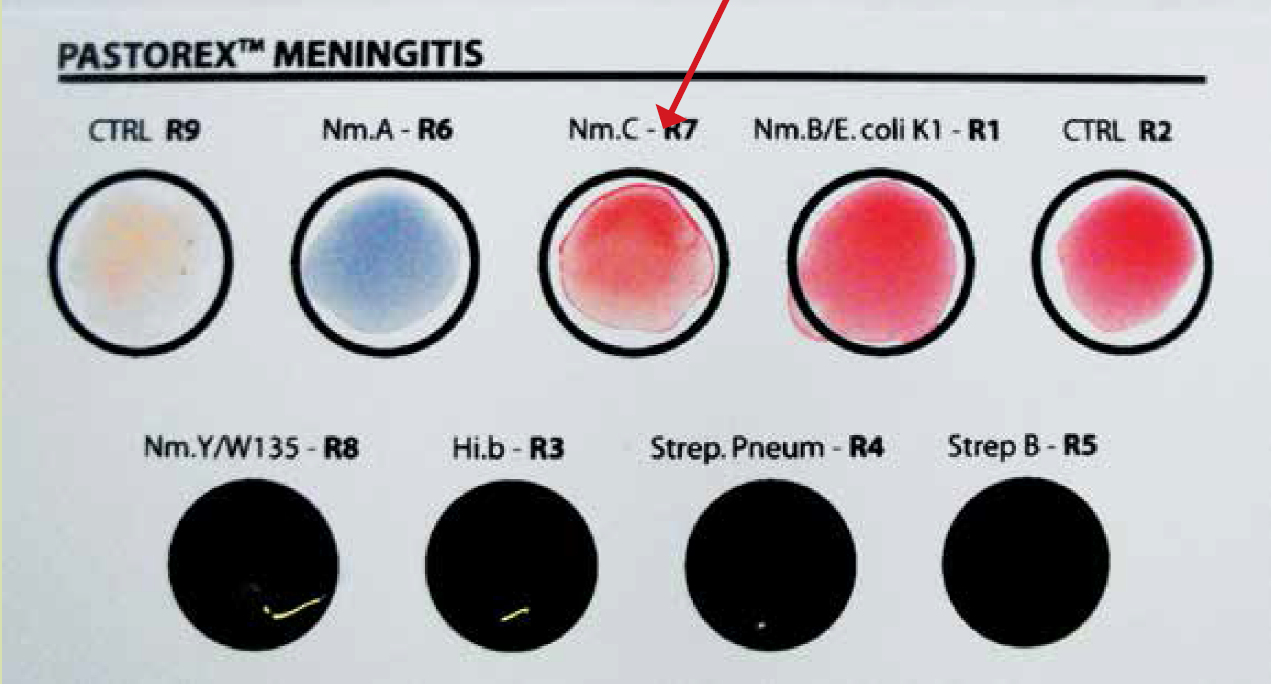
En el frotis de sangre periférica se observaron neutrófilos con vacuolización degenerativa, anisocitosis, macrocitos, microcitos, hipocromía, poiquilocitos, ovalocitos, eliptocitos, acantocitos y crenocitos (Figura 1). Se llegó al diagnóstico de sepsis grave, choque séptico, disfunción orgánica múltiple, hipoglucemia, coagulación intravascular diseminada y SSPE. Se implementó manejo por paquetes y guiado por metas con base en las recomendaciones de la Campaña para Incrementar la Sobrevida en Sepsis3, soporte con fármacos vasopresores en base a norepinefrina y terlipresina e inotrópico con levosimendan, infusión endovenosa de cristaloides y coloides así como concentrados eritrocitarios. Se inició un esquema de antimicrobianos en la primera hora tras su ingreso a la UTI con amoxicilina 2 g vía endovenosa cada 8 h y linezolid 600 mg vía endovenosa cada 12 h ante sospecha de proceso infeccioso secundario a microorganismos encapsulados. En hemocultivo se reportó desarrollo de diplococos gramnegativos y en el frotis de sangre periférica presencia de diplococos gramnegativos intracelulares en neutrófilos (Figura 2). Las pruebas de coaglutinación resultaron positivas para Neisseria meningitidis serogrupo C R7 (Figura 3), por lo que se agregó al manejo ceftriaxona 2 gramos vía endovenosa cada 12 h. La paciente cursó con evolución clínica tórpida con desarrollo de anisocoria por midriasis derecha. En la tomografía axial computarizada (TAC) simple de cráneo se ubicó la presencia de imagen hiperdensa en región temporal derecha secundaria a evento vascular de tipo hemorrágico intraparenquimatoso con desplazamiento de la línea media > 5 mm, compresión de ventrículo lateral derecho, edema perilesional. Presentó deterioro rostrocaudal pese al manejo implementando, lo que culminó con la muerte de la paciente a las 72 h de haber ingresado a la UTI.
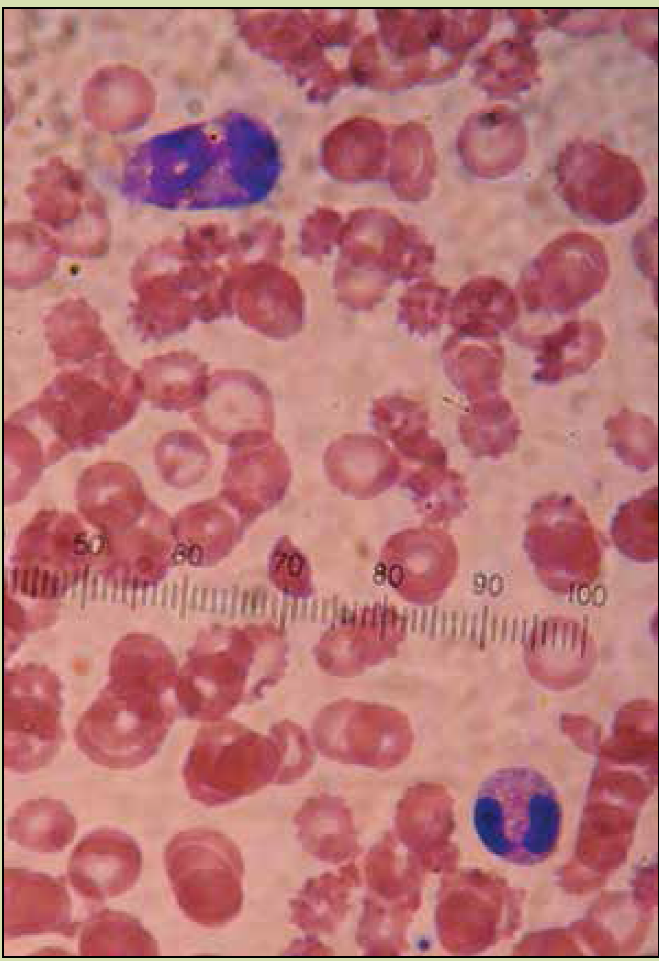
Figura 1 Frotis de sangre periférica en el que se observan formas anormales eritrocitarias en relación a microangiopatía (100×).
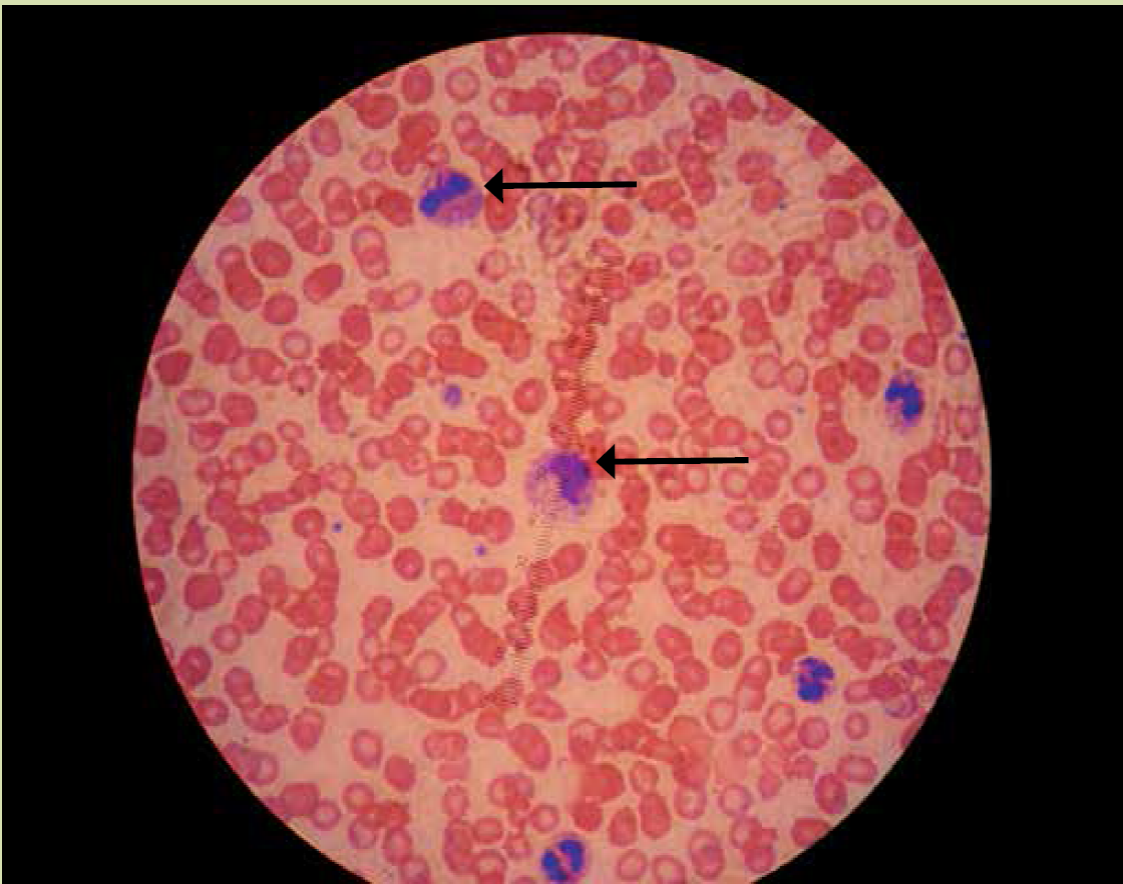
Figura 2 Frotis de sangre periférica en donde se observa la presencia de diplococos gramnegativos dentro de polimorfonucleares (flecha).
Discusión
El bazo es el principal órgano linfoide en el cuerpo humano y contiene más de la mitad del total de linfocitos B productores de inmunoglobulinas. Los sinusoides del bazo semejan a un “peine de dientes finos” que filtra la sangre que circula por una serie de capilares de diámetro menor a 1 micra que secuestra eritrocitos senescentes y rígidos de la circulación sanguínea. Las células mononucleares que se encuentran dentro de esta red capilar fagocitan a las bacterias circulantes, en particular los microorganismos no opsonizados4. Fuera de la circulación esplénica, los antígenos polisacáridos son poco inmunogénicos en comparación con los antígenos proteicos. Esto contribuye a que la cobertura de polisacáridos de las bacterias pueda evadir la respuesta inmune y su fagocitosis posterior5. Los pacientes asplénicos pueden desarrollar sepsis con cualquier tipo de microorganismo ya sea bacteria, virus, hongos y protozoarios. Sin embargo, el desarrollo de sepsis en pacientes asplénicos está principalmente relacionada con microorganismos encapsulados como Streptococcus pneumoniae, que resiste a la fagocitosis pero que puede ser rápidamente superado en presencia de pequeñas cantidades de anticuerpos de tipo específico6.
En la asplenia o el hipoesplenismo la producción de anticuerpos ante un nuevo antígeno está deteriorada y las bacterias proliferan rápidamente. El riesgo de desarrollar infección grave y sepsis por Streptococcus pneumoniae, Haemophilus influenzae tipo B y Neisseria meningitidis en pacientes esplenectomizados o hipoesplénicos es 12 a 25 veces mayor en relación a la población en general7-9.
Morris y Bullock10, en 1919 describieron que la esplenectomía se asociaba a un mayor riesgo de adquirir infecciones, por lo que recomendaron el evitar la remoción indiscriminada de este órgano. O’Donnell11 en 1929 reportó el primer caso de infección asociada a esplenectomía. En 1952, King y Shumacker12 centran la atención sobre el tema al reportar la muerte por infección grave de 5 niños menores a 1 año de edad esplenectomizados por esferocitosis hereditaria.
La esplenectomía es la causa más común de asplenia y dentro de las principales indicaciones para realizar ésta se encuentran las secundarias a trauma (40%), enfermedades hematológicas y neoplasias malignas (35%), trauma esplénico accidental durante cirugía intraabdominal por otra causa (24%) y trombocitopenia asociado a infección con virus de la hepatitis C13. Demeshek14, en 1955, acuñó el término de hipoesplenismo para referir la hipofunción adquirida del bazo asociada con alguna otra enfermedad ya sea de índole autoinmune, infecciosa, hematooncológica o congénita15,16 (Tabla 1).
Tabla 1 Enfermedades asociadas a hipoesplenismo o atrofia esplénica.

Adaptado de: Di Sabatino A, Carsetti, Corazza GR. Post-splenectomy and hyposplenic states. Lancet. 2011;378:86-97(16).
El síndrome de SSPE define a todo cuadro de sepsis, sepsis grave, neumonía grave y meningitis secundario a bacterias encapsuladas en pacientes con antecedente de asplenia o hipoesplenismo. Los procesos infecciosos y la sepsis en este grupo de pacientes tienen una mortalidad superior al 70%, y se presenta en las primeras 24 h de iniciado el cuadro. La incidencia de este síndrome es mayor en pacientes esplenectomizados durante la infancia por antecedente de talasemia, anemia de células falciformes, linfoma de Hodgkin y esferocitosis, y en aquellos con hipoesplenismo secundario a quimioterapia y radioterapia17. La incidencia de SSPE en niños ha sido estimada aproximadamente en 1 por cada 175 pacientes/año y en adultos de 1 por cada 400 a 500 pacientes/año5,13. Sin embargo, Kyaw18 reportó una tasa de 1 por cada 14 pacientes/año. El mayor riesgo para desarrollar SSPE se produce durante los primeros 2 años posteriores a la esplenectomía, pero éste se puede presentar de manera tardía hasta 40 años después. Por lo tanto, se considera que el riesgo de presentar sepsis grave en estos pacientes es permanente19-22.
En un estudio de cohorte de base poblacional se demostró que el riesgo de presentar infecciones que requirieron hospitalización en pacientes esplenectomizados fue mayor dentro de los primeros 90 días, y el 10% ameritó manejo intrahospitalario en comparación al 0.6% de la población general (odds ratio [OR] de 18.1, intervalo de confianza [IC] de 95%, 14.8 - 22.1). El riesgo de infección fue 4.6 veces mayor en los 91-365 días posteriores a la esplenectomía y superior a 2.5 veces a más de 365 días después de la esplenectomía en comparación con la población general21. Cullingford23 reportó una incidencia de sepsis en 0.42 casos/100 personas al año, y Holdsworth24 de 4.4% en niños menores a 16 años de edad y 0.9% de los adultos esplenectomizados.
La presentación clínica del SSPE es variada y poco específica. Puede simular un resfriado común en la fase temprana de evolución o un cuadro de sepsis sin foco evidente, de pródromo corto progresando a sepsis grave y choque séptico con coagulación intravascular diseminada, evento asociado a elevada mortalidad a pocas horas de iniciado el cuadro clínico25. Algunos casos llegan a desarrollar Síndrome de Waterhouse-Friderichsen. A pesar del manejo y soporte médico multiorgánico en la UTI, la mortalidad en estos pacientes resulta aún muy elevada5. En casos aislados, se ha identificado que, de acudir a recibir tratamiento de manera oportuna, se puede lograr reducir la mortalidad a menos de 10%, por ello la importancia de alertar al equipo de salud sobre el diagnóstico temprano y oportuno25.
En el estado de hipoesplenismo no se han identificado factores de riesgo específicos para el desarrollo de SSPE. Sin embargo, el escrutinio de la hipofunción del bazo es poco estudiada a pesar de tener identificadas algunas de las enfermedades en las cuales se presenta ya sea como consecuencia de la misma enfermedad o por efecto de las intervenciones farmacológicas o no farmacológicas destacando a la radioterapia, desarrollo hipoesplenismo o atrofia del bazo(15-17).
Los métodos diagnósticos para evaluar la disfunción del bazo se basan en la determinación de la capacidad de filtrado del bazo a través de radioisótopos y métodos que cuantifican la presencia de alteraciones morfológicas eritrocitarias. Los métodos radioisotópicos como la gammagrafía con tecnecio 99 (Tc99), permiten evaluar de manera morfofuncional al bazo a través de la inyección, la captación y eliminación de sustancias o partículas radiomarcadas. Los métodos que detectan las alteraciones morfológicas de los eritrocitos resultan más adecuados para su empleo clínico cotidiano, ya que estas pruebas son de fácil acceso, no son costosas, y son menos invasivas en relación al marcaje con radioisótopos27. Por este motivo la búsqueda intencionada de los cuerpos de Howell-Jolly en el frotis de sangre periférica, que son pequeños remanentes del núcleo eritrocitario original, resulta un método de escrutinio de fácil acceso y capaz de poder ser realizado en cualquier ámbito hospitalario. El incremento en número de los cuerpos de Howell-Jolly en un frotis de sangre periférica, aunque no es un parámetro de alta sensibilidad, puede identificar a pacientes con algún grado de hipoesplenismo, lo que representa un riesgo para el desarrollo de SSPE28-30.
Pese a que el riesgo de infecciones y sepsis en el paciente esplenectomizado o hipoesplénico es reconocido desde hace más de 50 años, se estima que más del 80% de los pacientes esplenectomizados o con hipoesplenismo desconocen los riesgos que conlleva esta condición médica, principalmente el de adquirir infecciones graves y potencialmente mortales5. Las estrategias recomendadas para disminuir el riesgo de desarrollar SSPE son: 1) inmunización, la profilaxis con antibióticos, 3) información y educación del paciente, 4) programas de monitoreo y seguimiento a corto y largo plazo31,32.
1) Inmunización
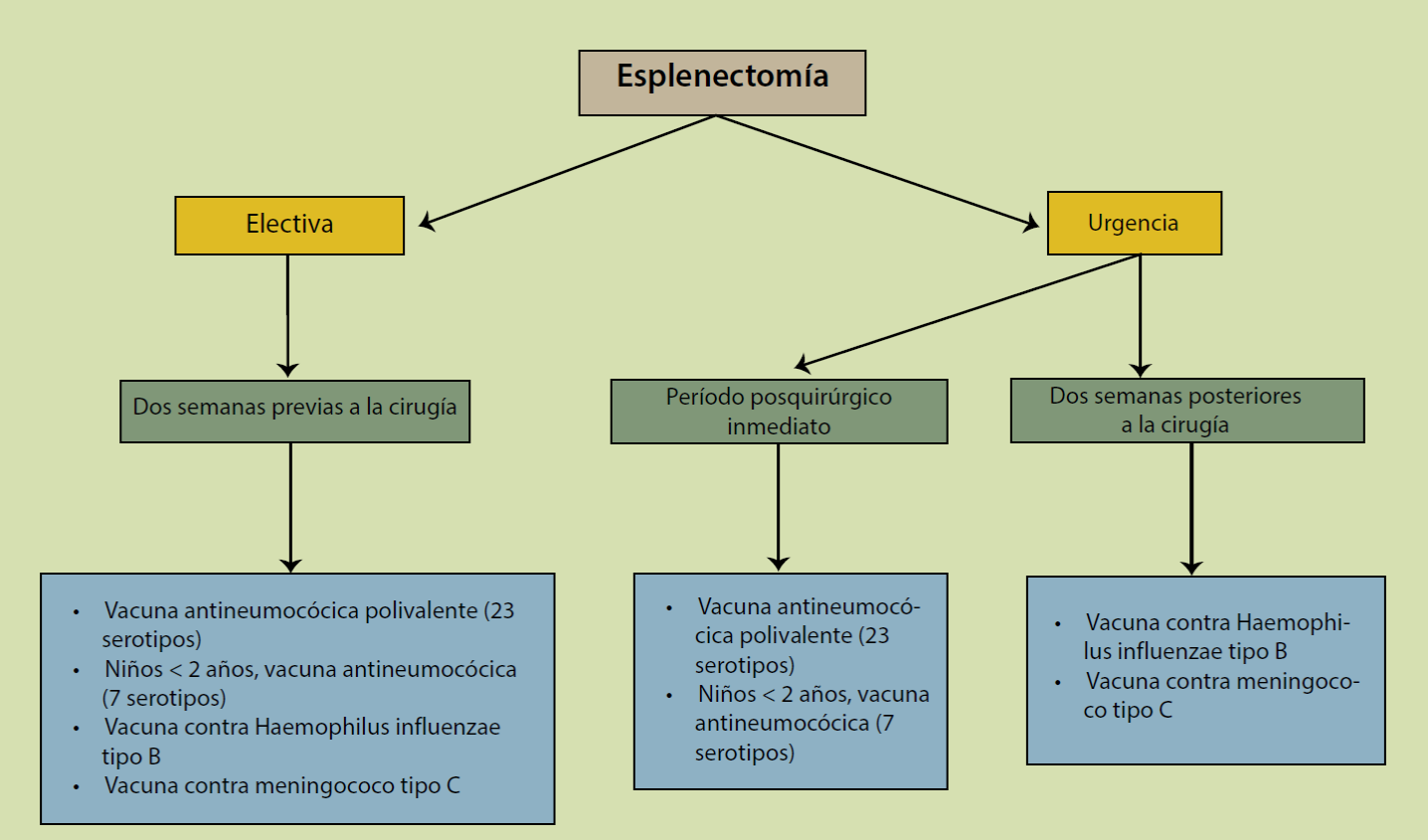
La vacunación es fundamental en la profilaxis de los procesos infecciosos secundarios en pacientes esplenectomizados o con hipoesplenia. Las recomendaciones actuales son las siguientes (Figura 4):
Streptococcus pneumoniae
La inmunización antipneumocócica con la vacuna polivalente de polisacáridos capsulares contra 23 serotipos (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F) debe ser aplicada a todo aquel paciente que ha sido o será esplenectomizado y en aquellos que por alguna enfermedad o intervención terapéutica cursen con hipoesplenia33. La inmunización que confiere la vacuna polivalente de 23 serotipos, abarca más del 90% de los serotipos condicionantes de infección invasiva por Streptococcus pneumoniae34,35. En esplenectomía electiva (programada), la vacuna polivalente debe ser aplicada 2 semanas previas al evento quirúrgico, esto garantiza una adecuada respuesta en la producción de anticuerpos. En el caso de esplenectomía urgente se recomienda aplicar la vacuna en el postoperatorio inmediato. En niños menores a 2 años de edad, la inmunización deberá realizarse con la vacuna polivalente de 7 serotipos y bajo las mismas circunstancias que en el adulto ya sea en esplenectomía electiva o urgente. En niños mayores a los 2 años de edad se aplica la vacuna polivalente de 23 serotipos con un amplio margen de seguridad e inmunogenicidad36,37.
En relación a la aplicación de la vacuna antipneumocócica, algunos pacientes presentan falla para producir una respuesta inmunogénica con elevación de anticuerpos que puede estar genéticamente determinada, siendo este patrón de respuesta inmunogénica predominante en pacientes mayores y en aquellos esplenectomizados por neoplasias malignas hematológicas. El hecho de no presentar un incremento en el título de anticuerpos antineumocócico postvacunación permite identificar a los pacientes no respondedores a la vacunación y que están en alto riesgo de presentar enfermedad neumocócica invasiva.
Por estas circunstancias es que la evidencia científica apoya el realizar de manera rutinaria la medición de la respuesta sérica inmunológica tras la aplicación de la vacuna antineumocócica. La Organización Mundial de la Salud (OMS) cataloga como respondedores a la vacuna antineumocócica, a los niños pequeños que presentan niveles de IgG de serotipo específico >0.35 μg/mL postvacunación. La relevancia de este umbral para los adultos, especialmente los mayores, no está validada y valores más altos pueden resultar más apropiados. El identificar a los pacientes no respondedores a la inmunización con vacuna antineumocócica permite adecuar las medidas de protección y reducir el riesgo de SSPE, ya que bajo estas circunstancias, estos pacientes resultan beneficiados con esquemas profilácticos de antibiótico38-40.
Haemophilus influenzae tipo B
En relación a la vacunación contra Haemophilus influenzae tipo B se cuenta con la suficiente evidencia de que es inmunogénica en pacientes con asplenia y es por ello que se recomienda su aplicación. Debe ser administrada en todo paciente asplénico o con hipoesplenismo y que no haya sido previamente inmunizado. Es recomendable aplicar la vacuna con polisacáridos de tipo b, 2 semanas previas al evento quirúrgico de tratarse de procedimiento electivo, o 2 semanas posteriores en caso de esplenectomía urgente. Una vez inmunizado el paciente, no requiere de aplicación subsecuente39-43.
Neisseria meningitidis
La vacuna de proteína conjugada contra meningococo serogrupo C confiere inmunidad permanente. Se recomienda su aplicación 2 semanas previas a esplenectomía electiva o 2 semanas posteriores en caso de esplenectomía urgente. En caso de viajes a lugares con alta prevalencia de los serogrupos A, C, Y y W135 es recomendado aplicar la vacuna tetravalente42,44-46.
2) Profilaxis con antibióticos
La evidencia científica respalda el mantener profilaxis con antibióticos en pacientes asplénicos o con hipoesplenismo bajo las siguientes circunstancias: niños menores de 16 años, adultos de edad mayor a los 50 años, pacientes no que no responden a la vacuna antipneumocócica o con infección invasiva previa documentada, durante el período perioperatorio en pacientes con esplenectomía por trauma y en pacientes con enfermedad hematológica en radioterapia selectiva a bazo o enfermedad crónica de injerto contra huésped. Los esquemas de antibióticos recomendados son con base en penicilina oral o amoxicilina y en caso de alergia a la penicilina, se recomienda que sea con base en cotrimoxazol o fluoroquinolona oral40,48,49.
En los pacientes en profilaxis con antibióticos que desarrollan síndrome febril agudo se debe adecuar la cobertura antimicrobiana agregando un esquema de antibióticos apropiado y evitar mecanismos de resistencia cruzada y presión de selección tendiendo en cuenta la epidemiologia microbiológica local50-52.
3) Educación e información
Es esencial educar e informar a los pacientes con esplenectomía o hipoesplenismo sobre el elevado riesgo que tienen de adquirir infecciones potencialmente letales, en la importancia de no menospreciar cualquier signo o síntoma de infección, el acudir a valoración médica temprana y oportuna ante cualquier signo de alarma y el seguir el esquema de vacunación. Es recomendable que utilicen un brazalete de alerta o su equivalente, llevar consigo en todo momento una tarjeta con información sobre su condición de inmunodeficiencia conferida por asplenia o hipoesplenia, datos clínicos relevantes en relación al tratamiento con antibióticos como profilaxis, inmunosupresores, enfermedades asociadas de tipo autoinmune, hematológico, oncológico y números telefónicos de contacto. En caso de emergencia esta información puede salvar vidas53,54.
La educación del personal médico y de los pacientes sobre el riesgo de sepsis que confiere la ausencia o disfunción del bazo debe ser una prioridad. Más del 80% de estos pacientes no reciben información apropiada, es mínimo el seguimiento y monitoreo de inmunizaciones y esquemas de antibióticos profilácticos. Debe destacarse la importancia y compromiso de los médicos cirujanos, hematólogos, oncólogos, gastroenterólogos, reumatólogos, internistas y el resto del equipo médico involucrados en el seguimiento de estos pacientes53-55.
El establecer un sistema de registro intrahos-pitalario, interinstitucional o más aún contar con una de red nacional de monitoreo, puede ofrecer beneficios de índole clínico y de costos en atención en este grupo de pacientes53-55.
Los pacientes y sus familiares deben estar conscientes de que, a pesar de los esquemas de inmunización y los antibióticos profilácticos, las infecciones con bacterias encapsuladas pueden llegar a ocurrir, por lo tanto, ante el menor indicio de enfermedad febril aguda, deben acudir de inmediato a valoración médica. El identificar y adecuar el tratamiento de manera oportuna en estos pacientes reduce significativamente la mortalidad53-55.
Conclusión
La esplenectomía es un procedimiento quirúrgico frecuente en nuestro país. El caso que presentamos es claro reflejo de la desinformación y falta de apego al seguimiento que todo paciente con asplenia e hipoesplenia debe tener.
Es menester desarrollar un programa nacional de registro, información, educación, monitoreo y prevención de todos los pacientes con esplenectomía e hipoesplenismo para reducir el riesgo de esta grave complicación, ya que como se ha enfatizado en este trabajo, la mortalidad resulta inaceptablemente elevada, para una condición prevenible y tratable cuando se diagnostica de manera temprana y oportuna.
Por lo anterior es recomendable que la autoridad sanitaria convoque a expertos para desarrollar e implementar una Norma Oficial Mexicana que unifique a nivel nacional los criterios de profilaxis, manejo y seguimiento de los pacientes esplenectomizados o portadores de hipoesplenia.











 nueva página del texto (beta)
nueva página del texto (beta)