Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Medicina (México)
On-line version ISSN 2448-4865Print version ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.56 n.3 Ciudad de México May./Jun. 2013
Artículos de revisión
Desarrollo de los ritmos biológicos en el recién nacido. Cátedra Especial "Dr. Ignacio Chávez"
Development of biological rhythms in the newborn child
Manuel Ángeles-Castellanosa, Samuel Vázquez Ruizb, Madahi Palmaa, Laura Ubaldoa, Gabriela Cervantesa, Adelina Rojas-Granadosa, Carolina Escobara
a Departamento de Anatomía. Facultad de Medicina. Universidad Nacional Autónoma de México. México, DF.
b Servicio de Pediatría. Hospital General Regional. San Pedro Pochutla Oaxaca. México.
Correo electrónico: atatu3@hotmail.com
Teléfono: 5255-5623-2422
Correspondencia:
Manuel Ángeles Castellanos,
Departamento de Anatomía
Edificio B, 4° piso
Facultad de Medicina, UNAM
México. DF. 04510
Resumen
Los ritmos circadianos se generan de forma endógena con un período de aproximadamente 24 h. Estudios realizados durante la última década indican que el sistema circadiano se desarrolla antes del nacimiento y que el núcleo supraquiasmático, estructura que se considera el reloj circadiano del mamífero, está presente en los primates desde la mitad de la gestación. Evidencias recientes muestran que el sistema circadiano de los infantes es sensible a la luz desde etapas muy tempranas del desarrollo; también se ha propuesto que la iluminación de baja intensidad puede regular el reloj en desarrollo. Después del nacimiento se presenta una maduración progresiva de las salidas del sistema circadiano con marcados ritmos en los fenómenos de sueño-vigilia y secreción de hormonas. Estos hechos expresan la importancia de la regulación fótica circadiana en los lactantes. Así, la exposición de los bebés prematuros a ciclos de luz/oscuridad tiene como resultado un rápido establecimiento de patrones de actividad/reposo, los que se encuentran en el ciclo luz-oscuridad. Con el continuo estudio del desarrollo del sistema circadiano y la influencia sobre la fisiología humana y la enfermedad, se prevé que la aplicación de la biología circadiana se convertirá en un componente cada vez más importante en la atención neonatal.
Palabras clave: Ritmos circadianos, lactantes, núcleos humanos, supraquiasmático.
Abstract
Circadian rhythms are endogenously generated with a period length of approximately 24 hours. Studies performed during the past decade indicate that the circadian timing system develops prenatally and the suprachias-matic nucleus, considered the site of the circadian clock, is present by midgestation in primates. Recent evidence also shows that the circadian system of primate infants is responsive to light since very early stages of development and that low-intensity lighting can regulate the developing clock. After birth, there is progressive maturation of the circadian system outputs, with pronounced rhythms on sleep-wake phenomena and hormone secretion; showing the importance of photic regulation on infants. Thus, exposure of premature infants to light/dark cycles results in the fast establishment of rest-activity patterns, which are in phase with the light-dark cycle. The continual study of circadian system development and its influence on human physiology and illness, it is foreseen that the application of circadian biology will become increasingly important for neonatal care.
Keywords: circadian rhythms, infant, human, suprachiasmatic nuclei.

DESARROLLO DEL SISTEMA CIRCADIANO
Se denomina recién nacido (RN) o neonato, a todo niño con edad gestacional de 25 semanas o más, que ha sido separado del organismo de la madre y aún no ha cumplido 28 días de vida extrauterina. Se clasifican como recién nacidos pretérmino, a los niños que nacen antes de 37 semanas de gestación, como recién nacidos a término a los que nacen de 37 a 42 semanas de gestación y recién nacidos postérmino a los que nacen después de las 42 semanas de gestación1.
Durante los primeros 28 días de vida extrauterina se llevan a cabo una serie de procesos adaptativos entre los cuales existen modificaciones de valores en variables fisiológicas indispensables para la supervivencia en un medio externo hostil para el pequeño individuo; por ejemplo el infante necesita tener la capacidad de regular su temperatura corporal, así como mantener los niveles sanguíneos de metabólicos energéticos (p. ej., glucosa) dentro de valores similares a los que llegaban al útero cuando eran regulados por la madre. También debe estar en posibilidades de enfrentarse y adaptarse a variaciones cíclicas ambientales, como son las variaciones en la temperatura y los ciclos de luz-oscuridad (L-D). Para ello, el neonato cuenta con un sistema circadiano que en el recién nacido a término se encuentra totalmente desarrollado2. Algunos investigadores consideran que, para la maduración adecuada del sistema circadiano, es necesario que el infante se exponga a señales ambientales cíclicas, tales como el ciclo luz-oscuridad3.
El sistema circadiano en el humano, al igual que en todos los mamíferos, está compuesto por múltiples estructuras en el cerebro y órganos periféricos que oscilan de manera acoplada. Este sistema multioscilatorio cuenta con vías de sincronización encargadas de llevar la señal de temporalidad de los estímulos externos al reloj. Entre estas vías de sincronización la de mayor relevancia es la vía fótica o retiniana que lleva la información luminosa a lo largo del tracto retino hipotalámico y hasta el reloj circadiano localizado en el núcleo supraquiasmático del hipotálamo (NSQ). El NSQ sincroniza los demás osciladores del organismo a través de múltiples vías que pueden ser neurales o humorales4'5. Se considera también una pieza fundamental en el sistema circadiano, ya que su ausencia genera condiciones de arritmia y desacoplamiento entre los osciladores periféricos y los efectores del ritmo6.

El desarrollo y la maduración de los componentes del sistema circadiano se dan de manera gradual y por separado. Así, tenemos que aunque la retina comienza su desarrollo desde la semana 20 de gestación, es hasta los 5 años de edad que se considera totalmente madura2. Lo anterior no descarta que desde el nacimiento del sujeto esta estructura participe ya como una de las vías principales de sincronización. Por otro lado, el NSQ se forma a la mitad de la gestación, entre las 16 y 20 semanas7. Para proporcionar información sobre el desarrollo del sistema circadiano en el humano, se han utilizado estudios anatómico funcionales realizados en primates no humanos. A partir de estos estudios, se sabe que el NSQ está presente desde el final del segundo trimestre de la gestación.
También se ha podido determinar que el NSQ comienza a presentar oscilaciones diarias asociadas con el ciclo día-noche in-útero7. La función del sistema circadiano se hace también evidente con otros sistemas ya que se han observado cambios en los ritmos circadianos de frecuencia cardiaca y actividad pulmonar, así como en la esteroidogénesis adrenal en fetos8,9. También se sabe que el NSQ es sensible a la luz desde etapas muy tempranas de desarrollo equivalentes en el humano a las 25 semanas de gestación10, lo que sugiere que desde esta edad la conectividad de la vía retino-hipotalámica hacia el NSQ se encuentra íntegra. A pesar de ello la sincronización del sistema circadiano dentro del útero es guiada por la influencia circadiana de la madre11.
Por otro lado, en un estudio morfológico del NSQ humano realizado en los primeros meses de vida, mediante técnicas de tinción inmunohistoquímica con anticuerpos contra la vasopresina (AVP), se pudo observar que en el momento del nacimiento el número de células que contiene AVP en el NSQ es mínimo, posteriormente el número de estas células aumenta considerablemente. Este aumento celular coincide con el período en el cual la ritmicidad circadiana es evidente para la mayoría de funciones del organismo y conducta del infante12.
INFLUENCIA MATERNA EN EL DESARROLLO DE LOS RITMOS CIRCADIANOS
Durante el embarazo el feto funciona como un oscilador periférico más, sólo que en el interior del útero la madre utiliza señales humorales que pasan a través de la placenta para mantenerlo acoplado (figura 1). Estas señales son consideradas como una variedad de estímulos no fóticos, incluyen modificaciones nutricionales y hormonales, capaces de atravesar la placenta8.
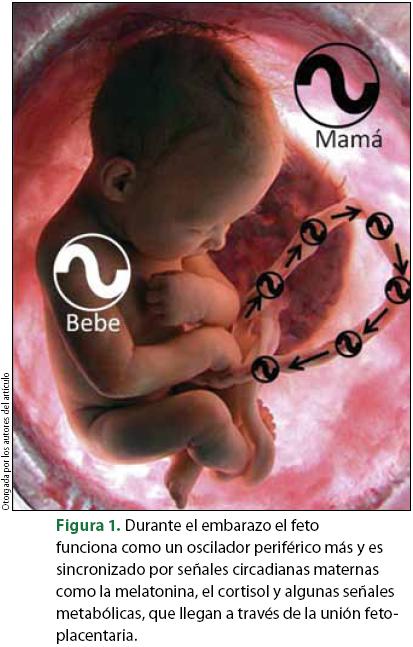
Se ha descrito que en la placenta y en el útero se expresan oscilaciones circadianas de genes reloj especialmente del gen perl, lo que ha puesto de manifiesto que el útero y la decidua placentaria mantienen oscilaciones circadianas estables durante la gestación, lo que sugiere la posibilidad de que a través de estas estructuras se provea al feto de otra vía de información circadiana13.
En un sistema ideal, donde la madre provee de nutrientes al producto y forma parte del medio ambiente en que el feto se desenvuelve, es lógico pensar que cualquier circunstancia que afecte directamente al estado materno puede alterar el organismo in útero14. Es necesario hacer énfasis en la alimentación y el tipo de nutrientes a los que esté expuesta la madre, ya que la exposición in útero que se detecta cuando hay una dieta alta en grasa altera la expresión fetal de los genes reloj en tejidos periféricos como el hígado15. Estudios experimentales han demostrado que la programación de los horarios fijos de alimentación en ratas gestantes mantiene los ritmos circadianos en fetos incluso en el caso de que la madre tuviera lesión de NSQ11,16,17. Por lo tanto, resulta muy importante considerar las diversas condiciones maternas que influyen sobre el desarrollo fetal.
Acerca de la influencia materna sobre el recién nacido, la mayor parte de los estudios coinciden en el efecto negativo que tienen algunos problemas clínicos durante la gestación lo que incluye alteraciones metabólicas, genéticas, vasculares, autoinmunes e infecciones, las cuales afectan el crecimiento fetal y suelen repercutir en el peso del niño al nacimiento. También se ha reportado la influencia que ejercen las alteraciones del ciclo de sueño/vigilia y el estrés crónico de la madre, los cuales traen como consecuencia que el hijo muestre alteraciones en el ritmo circadiano de hormonas como la melatonina y el cortisol18.
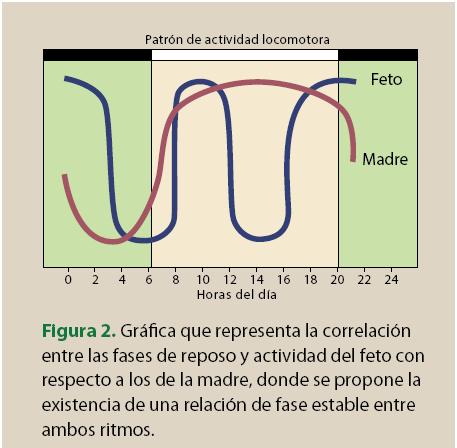
Se sabe que un feto sano de 16 a 20 semanas de gestación presenta ritmos de la actividad locomotora, y de la frecuencia cardiaca, con una relación de fase estable y acoplados con el ritmo de actividad/ reposo de la madre (figura 2). Por otra parte, la ausencia de una ritmicidad clara entre las semanas 20 a 24 de la gestación indica retraso en el desarrollo y crecimiento19.
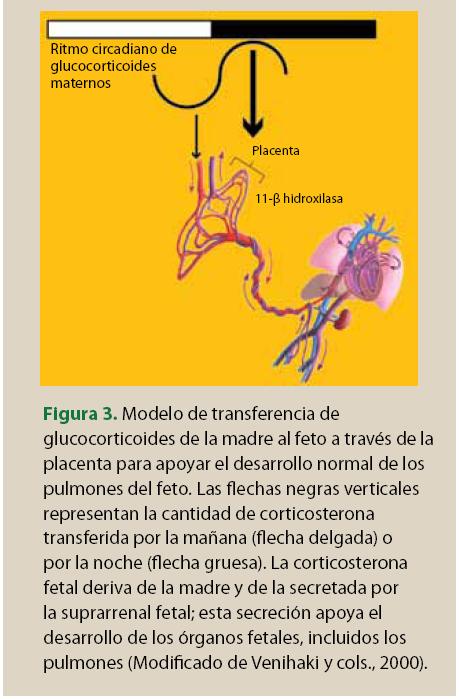
Por otro lado, el eje hipotálamo-hipofisario-adrenal es uno de los primeros sistemas endocrinos que se desarrolla durante la vida fetal; la secreción de glucocorticoides es necesaria para la maduración de órganos esenciales como los pulmones y el intestino. Durante la noche aumentan los niveles sanguíneos de glucocorticoides maternos, los cuales atraviesan la placenta gracias a la saturación de la enzima 11-β hidroxilasa. Esta señal hormonal materna es de suma importancia ya que los glucocorticoides en la circulación fetal contribuyen también a la adecuada maduración pulmonar (figura 3). Por lo tanto, se considera que la regulación cronobiológica del eje hipotálamo-hipofisiario-adrenal puede ser un mecanismo esencial para la regulación adecuada del crecimiento fetal20.
RITMOS CIRCADIANOS EN EL RECIÉN NACIDO
La ritmicidad en los parámetros fisiológicos así como en los ritmos conductuales en los recién nacidos, se ha estudiado desde principios de los años cincuenta. Uno de los primeros estudios es el realizado por Kleitman y Engelmann en 1953, quienes describen el desarrollo y maduración del ciclo sueño/vigilia en el recién nacido. Lo interesante de este estudio es que en él se describe una asociación directa de la ritmicidad del ciclo sueño/vigila con la demanda de alimentación de los bebés. La observación directa de infantes durante los primeros seis meses de vida mostró un cambio de patrones ultradianos a ciclos en oscilación libre con periodos de alrededor de 25 h durante las primeras 8 semanas de edad. Se pudo observar un patrón sincronizado a 24 h en el ciclo sueño/vigilia, alrededor de las 16 semanas de edad21. También se han evaluado patrones de actividad/ reposo, frecuencia cardiaca, temperatura, y sueño9 en recién nacidos. A pesar de que la caracterización de los ritmos circadianos ha sido muy complicada, algunos estudios han revelado la presencia de ritmos ultradianos a temprana edad22,23.
La expresión de ritmos circadianos en recién nacidos estudiados en la actualidad no ha sido del todo clara. La razón más probable es que el alimento y el contacto físico influyen en la periodicidad de diversas variables, y enmascaran la detección de ritmos circadianos. Debido a ello existe la disyuntiva de exploración cronobiológica neonatal, ya que parece ser que al momento del nacimiento no hay ritmos circadianos presentes en las cualquiera de las funciones que se midan, por ejemplo, la frecuencia cardíaca, el ritmo sueño/vigilia, la temperatura, la resistencia eléctrica de la piel y la función renal. Este concepto de la falta de ritmicidad al nacimiento y el desarrollo gradual de los ritmos circadianos ha sido consistente en estudios clásicos de los recién nacidos. Gracias a la utilización de sistemas más sofisticados de análisis de datos, se ha evidenciado tanto en el feto como en el recién nacido, la presencia de ritmos circadianos de funciones cardiovasculares y pulmonares más aún, se permite utilizar el funcionamiento de los ritmos en el recién nacido como un índice de valoración que expresa si el niño está o no está sano.
Algunos hallazgos recientes han ayudado a aclarar algunas ideas acerca del desarrollo de los ritmos circadianos en los recién nacidos, por ejemplo: 1) Las diferentes funciones desarrollan su ritmicidad circadiana de forma independiente una de otra, 2) el ritmo circadiano de cada función se manifiesta en distintos momentos después del nacimiento y 3) durante el desarrollo, la periodicidad circadiana muestra un aumento en los valores de oscilación y esto se produce en todas las funciones21,24.
Se ha observado que en niños recién nacidos a término y sanos, las condiciones ambientales a las que se exponen inmediatamente después del nacimiento pueden retardar o al menos, mostrar una rápida y adecuada respuesta a los ciclos del medio externo. Un ejemplo claro de la relevancia de las condiciones ambientales fue reportado en un estudio en el que se muestra que la programación de los horarios de alimentación en recién nacidos, reduce el tiempo requerido para la adaptación a un horario diurno de actividad-reposo. Este estudio fue realizado en 2 hermanos gemelos: donde a uno de ellos (el primogénito), se le suspendió la alimentación nocturna a partir de la quinta semana de nacido, y sólo tuvo acceso al alimento durante el día, lo que favoreció la aparición de un patrón circadiano de actividad/reposo estable en 9 semanas; por el contrario, en el hermano al que se le permitió la alimentación nocturna hasta por lo menos la semana 13 posparto, se retardó la aparición de una organización circadiana del ciclo sueño-vigilia, la que se consolidó finalmente, hasta después de la semana 27 de nacido. Se concluyó que en este atraso influyeron la manipulación de los horarios de alimentación, junto con el ciclo luz/oscuridad, es primordial en los sistemas circadianos en el infante25.
La alternancia de la luz-oscuridad es una potente e importante señal temporal para los recién nacidos. En un estudio realizado en recién nacidos sanos quienes fueron mantenidos en condiciones de luz constante durante los primeros diez días posnatales se observó que después del egreso hospitalario tardaron aproximadamente 25 días en mostrar una organización rítmica de tipo circadiana en la conducta de actividad/reposo. Comparados con el grupo de recién nacidos a quienes se les colocó bajo un ciclo de luz-oscuridad (12 horas de luz/12 horas de oscuridad), durante los primeros diez días posnatales, se mostró que estos últimos tuvieron una organización circadiana del ritmo actividad-reposo inmediatamente después del egreso hospitalario26.
De estos estudios se concluye que el sistema circadiano después del nacimiento es totalmente funcional y tiene la capacidad de responder y, sobre todo, de sincronizarse a fenómenos ambientales temporalmente regulares y predecibles, como en el ejemplo del alimento y la luz. En este sentido, la luz tiene efectos potenciales para la salud y el desarrollo. Debe hacerse notar, sin embargo, que la luz constante ha sido relacionada con la aparición de estrés en los infantes, el que suele expresarse en un incremento en los niveles de actividad locomotora, disminución en las horas de sueño, ausencia de ritmicidad y bradicardia27. Estos hallazgos se han replicado experimentalmente en roedores nocturnos, en los que se ha comprobado que la presencia de luz constante induce la pérdida gradual de diversos ritmos circadianos, y en algunos casos la aparición de ritmos de mayor frecuencia o ultradianos28. En nuestro laboratorio hemos comprobado, que la exposición de ratones a la luz constante desde su nacimiento induce una degeneración en la retina así como trastornos circadianos conductuales. (Datos no publicados).
ADAPTACIÓN DE LOS RECIÉN NACIDOS PRETÉRMINO A PROCESOS CRONOSTÁTICOS
Con los hallazgos mencionados previamente, se deduce que la adaptación fisiológica posnatal se ve comprometida por factores maternos y factores propios del desarrollo, por lo que es de suponer que la adaptación de los infantes con bajo crecimiento intrauterino, por ejemplo, los bebés que nacen antes de terminar su periodo de gestación es inadecuada, y el sujeto tarda mayor tiempo en ajustar su horario29.
Estudios realizados con recién nacidos prematuros indican que estos niños muestran un retraso en el desarrollo de los ritmos circadianos en comparación con los recién nacidos a término7. A este atraso hay que sumar el efecto que ejercen las condiciones ambientales a las que estos niños suelen quedar expuestos durante el periodo neonatal, ya que en la mayoría de los servicios de perinatología los recién nacidos pretérmino son hospitalizados por periodos prolongados bajo condiciones de iluminación (luz constante o luz tenue constante), lo que implica que no existe una alternancia significativa en las intensidades de iluminación entre una fase de luz y una de oscuridad.

Como ya se mencionó es muy importante exponer a los recién nacidos a procesos cíclicos externos para favorecer y estimular el desarrollo del sistema circadiano, sin embargo, es difícil establecer la alternancia adecuada de luz-oscuridad en las unidades de cuidados intensivos neonatales.
Recientemente se han llevado a cabo algunos estudios donde se han examinado los efectos de la sincronización fótica en los bebés recién nacidos pretérmino.
En uno de estos estudios se examinó el desarrollo del ritmo circadiano de actividad/reposo en recién nacidos pretérmino, de tal forma que diez días antes de ser dado de alta un grupo de bebés fue expuesto a condiciones de luz continua y otro grupo a ciclos regulados luz/oscuridad. En los recién nacidos previamente expuestos a ciclo/luz oscuridad se observó una sincronización más rápida con el medio exterior, así como la aparición de ritmos circadianos en el ciclo sueño/vigilia30. Con la misma maniobra de imponer ciclos de luz/oscuridad a recién nacidos pretérmino durante su estancia intrahospitalaria se obtuvo como resultado una mejor ganancia de peso, así como mayor duración de los periodos de sueño durante las 24 h del día, a diferencia de los infantes que se mantuvieron en condiciones constantes de iluminación. En éstos, suelen presentarse patrones caóticos en el ciclo de actividad/reposo y menor ganancia de peso corporal31.
Debido a lo anterior, recientemente se ha sugerido que la exposición de los infantes a ciclos de luz/oscuridad favorece el incremento de peso y el crecimiento intrahospitalario32. De éstos y otros hallazgos similares, puede inferirse que existe cierta dificultad en detectar y registrar la ritmicidad circadiana en recién nacidos pretérmino ya que los mecanismos por los que la luz puede influir en el crecimiento de niños prematuros no están claros7, y la ritmicidad no es aparente en niños nacidos pretérmino, sino hasta 6 semanas después del nacimiento. Estas conclusiones se basan, en el análisis de registros continuos durante 24 a 48 h, o en registros continuos de temperatura rectal23,27,33. Por otro lado hay quien afirma que se pueden evidenciar ritmos circadianos en recién nacidos pretérmino. Así lo indican observaciones en las que se han utilizado actímetros conectados a un monitor que registra los patrones de reposo/actividad34 en niños expuestos a ciclos luz/oscuridad desde el momento del nacimiento.
Por otro lado, también se ha documentado que un ambiente de luz constante puede contribuir a enfermedades de los ojos en infantes prematuros35. Un ambiente de luz constante produce degeneración retiniana, y como ya se comentó, la retina es la vía principal de entrada de la señal de sincronización para el sistema circadiano, por lo que si se encuentra bajo luz constante además de sufrir los efectos directos de ésta, las neuronas del núcleo supraquiasmático serán estimuladas de manera continua. En relación con este punto, se sabe con base en la experimentación que la luz constante genera un fenómeno de desincronización interna (arritmia) por lo que algunos investigadores proponen un programa asistencial del desarrollo de cuidados neonatales individualizados, donde se sugiere que, dado que el útero es oscuro, los infantes deben desarrollarse mejor en un ambiente de oscuridad que en uno de luz constante36.
Sin embargo, hay quienes se contraponen a esta idea y postulan que, prenatalmente, el infante está expuesto a los ritmos de la madre que se encuentran sincronizados al ciclo luz/oscuridad, e indirectamente el recién nacido se sincroniza a esta señal16. Esto sugiere que la utilización de ciclos de luz/oscuridad inmediatamente después del nacimiento puede ser benéfica para el producto. Faltan aún más estudios clínicos y experimentales sobre este tema ya que hay una falta de consenso sobre la utilización o no de ciclos de luz/oscuridad como una medida de rutina en las unidades de cuidados intensivos neonatales (UCIN).
Por otro lado, el uso de condiciones de luz constante en la mayoría de los servicios de hospitalización en todo el mundo no tiene una base científica solida3. Tomando en cuenta que el sistema circadiano es un sistema fundamentalmente homeostático-temporal, es decir "cronostático", que influye potentemente sobre el desarrollo humano y que después del nacimiento requiere una progresiva maduración, la implementación de unidades que refuercen la biología circadiana llegará a ser un importante componente de los cuidados neonatales.
Por nuestra parte, convencidos por la hipótesis de que "mantener en ciclos luz/oscuridad a los bebés nacidos prematuramente que se encuentran en la UCIN, ayuda a mejorar su evolución y a establecer patrones rítmicos fisiológicos y conductuales", realizamos un estudio clínico-experimental con bebés recién nacidos pretérmino sanos, dividiéndolos en 2 grupos: uno, el grupo control que se mantuvo en condiciones de iluminación constante habitual en la UCIN (250 lux en promedio) durante las 24 h del día, y un grupo experimental al que se le impuso un ciclo de luz/oscuridad (12 horas de luz/12 horas de oscuridad), utilizando para producir la fase de oscuridad, cascos de acrílico cubiertos con tela tal y como se muestra en la figura (figura 4).

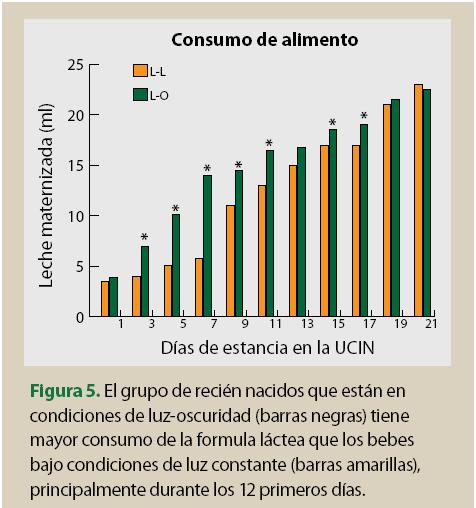
Esta simple medida permitió establecer una diferencia significativa en la intensidad de iluminación durante el ciclo de 24 h: 250 lux durante el día y 27 lux durante la noche. Se realizaron evaluaciones de signos vitales, así como consumo de fórmula láctea y ganancia de peso corporal. Estas variables fueron monitoreadas diariamente desde el día del nacimiento hasta su egreso de la UCIN. Cabe mencionar que tal como se esperaba en estos bebés no fue posible identificar claramente un ritmo circadiano en ninguno de los parámetros fisiológicos evaluados, hecho que coincide con lo ya mencionado acerca de que durante los primeros días de nacidos los niños sólo presentan algunos ritmos ultradianos. Sin embargo, en este estudio también encontramos que al establecer un ciclo de luz/oscuridad los bebés mostraron una mejor tolerancia a la fórmula láctea, es decir disminuyó el número de vómitos y de evacuaciones diarreicas, comparado con el de los bebés que están en condiciones de luz constante.
Lo anterior tuvo como resultado que los bebés no sólo no perdieran peso sino que su ganancia de peso corporal fuera más rápida y constante (figura 5). En consecuencia fueron dados de alta hospitalaria con mucha anticipación: en promedio egresaron 20 días antes que los bebés que estuvieron bajo luz constante, lo que representa una gran ventaja porque se reduce el riesgo de adquirir enfermedades nosocomiales, además que existe un ahorro económico tanto para la familia como para los servicios hospitalarios.
Por otra parte, en todas las mediciones se pudo observar que, a partir del cuarto día bajo condiciones de luz/oscuridad, los bebés mostraron mejoras notables. Por ejemplo: la frecuencia cardiaca tuvo una rápida estabilidad, la perfusión periférica de oxígeno, medida por pulsooximetría, produjo mejor oxigenación comparada con la de los bebés en condiciones de iluminación constante (figura 6).

Estos resultados muestran algunas de las ventajas que ofrece la aplicación de ciclos de luz/oscuridad durante los primero días después del nacimiento, por lo que proponemos que debe revalorarse en todos las UCIN las normas internas que sugieren mantener a los bebés en condiciones de iluminación constante y valorar las ventajas y desventajas que tiene este programa sobre la salud.
Finalmente podemos comentar en un sentido más amplio que la utilización de los conocimientos adquiridos por estudios cronobiológicos al incidir en la predisposición a determinadas enfermedades o en la exploración del momento más adecuado para la administración de un tratamiento es una excelente herramienta que no se ha explotado adecuadamente. Sin embargo, los estudios para confirmar y explorar esta zona aún desconocida se deben diseñar y llevar a cabo con cuidado y con rigurosa atención, a fin de que los resultados de dichos estudios permitan convencer a las comunidades científica y médica que aún permanecen escépticas con respecto a la importancia que tienen los estudios cronobiológicos.
AGRADECIMIENTOS
Realizado con el apoyo de los Proyectos PAPITT-UNAM IN20580, IN209712; IN224911; CONACYT 82462.
REFERENCIAS BIBLIOGRÁFICAS
1. Cloherty JP, Eichenwald EC, Stark AR. Manual de Neonatologia. 6a Edicion. Wolters Kluwer; Lippincort Williams & Wilkins; 2009. [ Links ]
2. Seron-Ferre M, Torres-Farfan C, Forcelledo ML, Valenzuela GJ. The development of circadian rhythms in the fetus and neonate. Semin Perinatol. 2001;25:363-9. [ Links ]
3. Ariagno RL, Mirmiran M. Shedding light on the very low birth weight infant. J Pediatr. 2001;139:476-7. [ Links ]
4. Buijs RM, la Fleur SE, Wortel J, Van Heyningen C, Zuiddam L, Mettenleiter TC. The suprachiasmatic nucleus balances sympathetic and parasympathetic output to peripheral organs through separate preautonomic neurons. J Comp Neurol. 2003;464(1):36-48. [ Links ]
5. Hastings M, O'Neill JS, Maywood ES. Circadian clocks: regulators of endocrine and metabolic rhythms. J Endo-crinol. 2007;195:187-98. [ Links ]
6. Weaver DR. The suprachiasmatic nucleus: a 25-year retrospective. J Biol Rhythms. 1998;13:100-12. [ Links ]
7. Rivkees SA, Hao H. Developing circadian rhythmicity. Semin Perinatol. 24(4):232-42. [ Links ]
8. Seron-Ferre M, Valenzuela GJ, Torres-Farfan C. Circadian clocks during embryonic and fetal development. Birth Defects Res C Embryo Today. 2007;81(3):204-14. [ Links ]
9. Rivkees SA, Hofman PL, Fortman J. Newborn primate infants are entrained by low intensity lighting. Proc Natl Acad Sci U S A. 1997;94:292-7. [ Links ]
10. Hao H, Rivkees SA. The biological clock ofvery premature primate infants is responsive to light. Proc Natl Acad Sci U S A. 1999;96:2426-9. [ Links ]
11. Ohta H, Xu S, Moriya T, Ligo M, Watanabe T, Nakahata N, et al. Maternal feeding controls fetal biological clock. PLoS One. 2008;3(7):e2601. [ Links ]
12. Swaab DF, Fliers E, Portiman TS. The suprachiasmatic nucleus of the humans brain in relation to sex, age, and dementia. Brain Res. 1985;342:37-44. [ Links ]
13. Akiyama S, Ohta H, Watanabe S, Moriya T, Hariu A, Nakahata N, et al. The uterus sustains stable biological clock during pregnancy. Tohoku J Exp Med. 2010;221(4):287-98. [ Links ]
14. Aagaard-Tillery KM, Grove K, Bishop J, Ke X, Fu Q, McKnight R, Lane R. Developmental origins of disease and determinants of chromatin structure: maternal diet modifies the primate fetal epigenome. J Mol Endocrinol. 2008;41(2):91-102. [ Links ]
15. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, et al. Epigenomics: maternal high-fat diet exposure in utero disrupts peripheral circadian gene expression in nonhuman primates. FASEB J., 2011;25(2):714-26. [ Links ]
16. Reppert SM, Weaver DR, Rivkees SA. Maternal communication of circadian phase to the developing mammal. Psychoneuroendocrinology. 1988;13(1-2):63-78. [ Links ]
17. Nováková M, Sladek M, Sumova A. Exposure of pregnant rats to restricted feeding schedule synchronizes the SCN clocks of their fetuses under constant light but not under a light-dark regime. J Biol Rhythms. 2010;25(5):350-60. [ Links ]
18. El-Hennamy R, Mateju K, Bendova Z, Sosniyenko S, Sumova A. Maternal control of the fetal and neonatal rat suprachiasmatic nucleus. J Biol Rhythms. 2008;23(5):435-44. [ Links ]
19. Kintraia PI, Zarnadze MG, Kintraia NP, Kashakashvili IG. Development of daily rhythmicity in heart rate and locomotor activity in the human fetus. J Circadian Rhythms. 2005;3(1):5. [ Links ]
20. Kivlighan KT, DiPietro JA, Costigan KA, Laudenslager ML. Diurnal rhythm of cortisol during late pregnancy: associations with maternal psychological well-being and fetal growth. Psychoneuroendocrinology. 2008;33(9):1225-35. [ Links ]
21. Henderson JM, France KG, Owens JL, Blampied NM. Sleeping through the night: the consolidation of self-regulated sleep across the first year of life. Pediatrics. 2010;126(5):e1081-7. [ Links ]
22. Anders TF, Keener M. Developmental course of nighttime sleep-wake patterns in full-term and premature infants during the first year of life. I. Sleep. 1985;8(3):173-92. [ Links ]
23. Glotzbach SF, Edgar DM, Ariagno RL. Biological rhythmicity in preterm infants prior to discharge from neonatal intensive care. Pediatrics. 1995;95:231-7. [ Links ]
24. Rivkees SA. Emergence and influences of circadian rhythmicity in infants. Clin Perinatol. 2004;31(2):217-28. [ Links ]
25. Lörh B, R Siegmund. Ultradian and circadian rhythms behavior during early infancy of sleep-wake and food-intake Chronobiology International. 1999;16(2):129-148. [ Links ]
26. Rivkees SA, Gross I, Mayes L. Influence of cycled lighting on the development of rest-activity patterns in premature infants. Pediatr Res. 2002;51:375. [ Links ]
27. Mirmiran M, Ariagno RL. Influence of light in the NICU on the development of circadian rhythms in preterm infants. Semin Perinatol. 2000;24:247-57. [ Links ]
28. Deprés-Brummer P, Levi F, Metzger G, Touitou Y. Lightinduced suppression of the rat circadian system. Am J Physiol. 1995;268(5 Pt 2):R1111-R1116. [ Links ]
29. Jackson JA, Wailoo MP, Thompson JR, Petersen SA. Early physiological development of infants with intrauterine growth retardation. Arch Dis Child Fetal Neonatal Ed. 2004;89(1):F46-F50. [ Links ]
30. Rivkees SA, Gross I, Mayes L. Influence of cycled lighting on the development of rest-activity patterns in premature infants [abstract]. Pediatr. 2002;Re; 51:375. [ Links ]
31. Mann NP, Haddow R, Stokes L, Goodley S, Rutter N; Effect of night and day on preterm infants in a newborn nursery: randomised trial. Br Med J (Clin Res Ed). 1986;293:1265-7. [ Links ]
32. Brandon DH, Holditch-Davis D, Belyea M. Preterm infants born at less than 31 weeks' gestation have improved growth in cycled light compared with continuous near darkness. J Pediatr. 2002;140:192-9. [ Links ]
33. McGraw K, Hoffmann R, Harker C, Herman JH. The development of circadian rhythms in a human infant. Sleep. 1999;22:303-10. [ Links ]
34. Rivkees SA. Developing circadian rhythmicity in infants. Pediatrics. 2003;112(2):373-81. [ Links ]
35. Glass P, Avery GB, Subramanian KN, Keys MP, Sostek AM, Friendly DS. Effect of bright light in the hospital nursery on the incidence of retinopathy of prematurity. N Engl J Med. 1985;313:401-4. [ Links ]
36. Als H, Lawhon G, Duffy FH, McAnulty GB, Gibes-Grossman R, Blickman JG. Individualized developmental care for the very low-birth weight preterm infant. Medical and neurofunctional effects. JAMA. 1994;272:853-8. [ Links ]














