Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina (México)
versión On-line ISSN 2448-4865versión impresa ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.55 no.2 Ciudad de México mar./abr. 2012
Artículo de revisión
Diagnóstico de laboratorio del parvovirus B19
Parvovirus B19: Laboratory diagnosis
Rafael García Gonzáleza, David Basilio Hernándezb, Aurora Hernández Ramírezb
a Coordinación de Enseñanza del Departamento de Microbiología y Parasitología. Facultad de Medicina. UNAM. México, DF. Correo electrónico: rafagargon@hotmail.com
b Departamento de Microbiología y Parasitología. Facultad de Medicina. UNAM. México, DF.
Recibido: 04-03-11
Aceptado: 13-09-11
Resumen
Parvovirus B19, es el único patógeno humano conocido de los parvovirus. El espectro de enfermedad al cual se encuentra asociado el B19 incluye un amplio rango de enfermedades: eritema infeccioso, síntomas de trombopenia o granulocitopenia, crisis aplástica, o anemia hemolítica en pacientes inmuno comprometidos. El diagnóstico de laboratorio de infección por parvovirus B19 es confirmado principalmente por la detección de anticuerpos antivirales del tipo de IgM por medio de la técnica de ELISA, la cual se encuentra dirigida tanto a epítopes conformacionales como lineales de proteínas de cápside VP1 y VP2. Cuando la respuesta a IgM declina, la presencia de IgG se hace cada vez más evidente en contra de VP1 y VP2, pudiendo ser detectada por inmunofluorescencia, ELISA y Western blot. El empleo de la reacción en cadena de la polimerasa se usa en la actualidad de manera rutinaria como complemento o alternativa de la serología.
Palabras clave: Parvovirus humano B19, diagnóstico, IgM, IgG, ELISA, PCR.
Abstract
Parvovirus B19 (B19) is the only known human pathogenic parvovirus. The spectrum of illness to which B19 is associated includes a wide range of diseases: erythema infectiosum, thrombocytopenia or granulocytopenia, aplastic crisis or hemolytic anemia in immunocompromised patients. The laboratory diagnosis of Parvovirus B19 infection is primarily confirmed by the detection of IgM antiviral antibodies using the ELISA technique, which is directed against both conformational and linear epitopes of VP1 and VP2 capsid. When IgM response declines, an IgG immune-response against structural proteins VP1 and VP2 becomes prominent and can detected by immunofluorescence, ELISA and Western blot. Polymerase chain reaction is now used as a routine analysis as well as complement or alternative to serology.
Key words: Human parvovirus B19, diagnosis, IgM, IgG, ELISA, PCR.
INTRODUCCIÓN
El parvovirus B19, fue descubierto accidentalmente por Yvonne Cossat y cols. en 1974, durante el examen practicado a sueros de donadores de sangre, en la búsqueda del antígeno de superficie del virus de hepatitis B (HbsAg). Debe su nombre al suero número 19 del panel B, que resultó positivo a través de contrainmunoelectroforesis (CIE) y negativo por otros procedimientos.1 Al ser observada la línea de precipitación de la CIE por microscopía electrónica se visualizaron partículas de 23 nm de diámetro con características de parvovirus. El parvovirus humano B19, es el primer parvovirus y el único que ha demostrado ser patógeno en humanos, y aunque existen otros asociados a adenovirus y se han visualizado partículas parecidas a parvovirus, no existen evidencias de que se encuentren asociados a estos últimos en cuadros clínicos en humanos.1-3
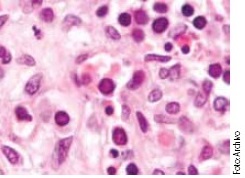
A partir de 1981 Pattison JR lo asoció con crisis de anemia aplásica en pacientes con enfermedad de células falciformes y Anderson MJ demostró en 1983, que es el agente causal de eritema infeccioso (quinta enfermedad exantemática).
En la actualidad se le conoce como la causa primaria de crisis transitorias de aplasia en pacientes con anemia hemolítica crónica, anemia crónica en pacientes con inmunodeficiencia, así como hidropesía fetal y muerte fetal. También es causa de artritis y artralgias especialmente en mujeres jóvenes y de otros cuadros clínicos.4-7
AGENTE ETIOLÓGICO
El parvovirus B19 pertenece a la familia Parvoviridae, que se encuentra dividida en dos subfamilias: Parvovirinae y Densovirinae, por su capacidad para infectar vertebrados e invertebrados respectivamente. La subfamilia Parvovirinae se subdivide en 3 géneros, de acuerdo con su capacidad para replicarse autónomamente como sucede con el parvovirus, con ayuda de un virus en el caso de dependovirus, y por su capacidad eficiente y de manera preferente en células eritroides como es el caso de eritrovirus, al cual pertenece al parvovirus B19.8
El parvovirus B19 es un virus relativamente uniforme, sin envoltura, presenta simetría icosaédrica, de 20 a 25 nm de diámetro, con ADN de cadena única de 5,596 nucleótidos de longitud, que es empaquetado como cadena positiva o negativa en igual proporción. Esto es consecuencia de su peculiar forma de replicación, que origina un intermediario replicativo (ADN de doble cadena) gracias a la existencia de terminales 3' palindrómicas de 383 nucleótidos, que son empleadas como iniciadores para la síntesis de una cadena de ADN positiva, a partir de la que se origina la cadena negativa en la que emplea ADN polimerasa celular. Formando en un principio un concatámero, que será replicado para producir un tetrámero, que por acción de una endonucleasa, se producirán 2 cadenas positivas y 2 negativas.9

El parvovirus se replica únicamente en células en división, y tanto la replicación como la trascripción, se efectúan en el núcleo de la célula infectada, en donde se acumulan proteínas no estructurales y se realiza el ensamblaje del virión.3,8
El parvovirus B19 codifica para 2 proteínas estructurales; VP1 (5%) y VP2 (95%), así como una proteína principal no estructural (NS1). VP1 tiene un peso molecular de 84 kDa, codificada por la secuencia que va del nucleótido 2444 al 4786. VP2 con un peso molecular de 58 kDa codificada por la secuencia de nucleótidos que va de 3125 al 4786. La proteína no estructural NS1 tiene un peso molecular de 77 kDa cuya función no está completamente caracterizada. 9, 10
Tomando en cuenta las variaciones en las proteínas NS1 y VP1, Servant y cols. propusieron en el 2006, agrupar al parvovirus B19, en 3 genotipos; genotipo 1 (cepa de referencia B19, prototipo Pvaua), genotipo 2 (prototipo Lali y A6) y genotipo 3 (cepa prototipo V6), reportándose una variación en las proteínas estructurales que va de 8 al 14% dependiendo del genotipo.11 Se desconoce la prevalencia y el significado clínico de estas variantes, y Cohen BJ les refiere un significado temporal y geográfico.12 la infección por parvovirus B19 es común en el humano. La única célula que se conoce que es permisiva para parvovirus B19, es el pronormoblasto (célula progenitora eritroide), sobre la que tiene un efecto lítico.4,13 La infección de la célula se realiza a través del antígeno P (globósido Gb4), receptor expresado en las células eritroides y en otras, entre las que se incluyen células del endotelio, plaquetas sinoviocitos, células del músculo liso y miocitos fetales.
Aún cuando se ha demostrado la necesidad del Ag P para que el virus se una a la célula, se sugiere de la necesidad de un coreceptor (α5β1) para que la infección sea exitosa, y que actúe como integrina. Esto puede explicar la alta especificad por las células eritroides, ya que expresan en gran cantidad ambas moléculas en su superficie.13
Histológicamente en médula ósea, Portillo-Carrillo y cols. han observado pronormoblastos con cambios megaloblásticos, con inclusiones eosinófilas y marginación de la cromatina nuclear.4 Por otra parte, a través de la microscopía electrónica, se observan arreglos cristalinos en el núcleo y por hibridación in situ usando ADN clonado se demuestra la presencia del genoma de parvovirus B19, tanto en infecciones crónicas como agudas.7,8
La mayoría de las infecciones por B19, son asintomáticas o cursan con cuadros ligeros.3-5,14 Sin embargo, cuando la infección se encuentra asociada a desordenes clínicos y es influenciada por la edad, por el estado inmunológico y hematológico, en algunos casos, ponen en peligro la vida del paciente al presentar una amplia variedad de manifestaciones clínicas.
EPIDEMIOLOGÍA
Desde el punto de vista epidemiológico, debido a su ubicuidad, la infección por parvovirus B19 es común (40 a 60% de la población mundial), y su máxima incidencia se encuentra en la edad escolar.8 En adultos jóvenes, existen evidencias en el 50-60%, y en personas mayores de 50 años más del 80% tienen evidencias serológicas de infección pasada. Su incidencia se incrementa en invierno y primavera, en zonas con clima templado, aunque la infección puede ocurrir en cualquier época del año.

Haga clic para agrandar imagen
Su transmisión se realiza principalmente, a través de secreciones respiratorias, y se disemina de persona a persona (contacto directo), posiblemente por fomites y transfusión sanguínea. Parvovirus B19 ha sido detectado en secreciones respiratorias, orina, sangre y derivados de ésta, así como en una variedad de tejidos.14,15
PATOGÉNESIS
La infección por parvovirus B19 tiene un período de incubación de 6 a 18 días y la enfermedad tarda en manifestarse entre 1 y 2 semanas. En el caso de la quinta enfermedad, el lapso se prolonga de 2 a 4 semanas.
A partir del cuarto día postinfección se inicia la viremia por parvovirus B19, y alcanza su punto máximo entre el día 6 y 10, también puede ser localizado en el aparato respiratorio.
Entre las principales enfermedades producidas por parvovirus B19, se encuentra la quinta enfermedad, también llamada eritema infeccioso, en niños de 4 y 11 años de edad, artropatía sobre todo en mujeres adultas de edad media, crisis aplásica transitoria en pacientes con eritropoyesis activa (esferocitosis hereditaria y enfermedad de células falciformes), hidropesía fetal, aborto y muerte fetal, también ha sido asociado con glomerulonefritis, vasculitis, neuropatía periférica, miocarditis, falla hepática fulminante y síndrome de Nezelof. Puede afectar a pacientes infectados con el virus de inmunodeficiencia adquirida, pacientes bajo tratamiento con quimioterapia citotóxica y en receptores de transplante de órganos. El parvovirus B19 puede persistir y conducir a anemia crónica, aplasia de células rojas y en menor grado trombocitopenia, neutropenia y pancitopenia en pacientes inmunocomprometidos.4,5,16,17
La respuesta inmune humoral, se manifiesta entre el día 10 y 14 con la presencia de IgM e IgG respectivamente.8,18 Los valores normales de reticulocitos, leucocitos y hemoglobina descienden a partir del sexto, séptimo y décimo día posinfección respectivamente. Volviendo a su normalidad entre el día 20, 16 y 26 respectivamente. En personas con anormalidades hematológicas, se produce un cuadro de anemia seria y crisis de aplasia que puede ser transitoria. Aquellos pacientes que no pueden controlar la infección, desarrollan una deplesión crónica en la producción de células rojas.3,14

Peterlana y cols. sugieren que la persistencia del virus puede ser responsable de inducir autoinmunidad a través de mecanismos de mimetización molecular, y que su posible participación se encuentra en el tejido del paciente con esclerodermia, lo que les sugirió que el tejido esclerodérmico dañado es consecuencia directa de la citotoxicidad viral, que eventualmente conduce a una agresión por autoinmunidad sobre todo en individuos predispuestos.19
Como cuadros clínicos sugestivos de infección por parvovirus B19, se consideran a nivel articular, dermatológicos, hematológicos, hepáticos e infecciosos (tabla 1).

DIAGNÓSTICO
La manera de diagnosticar desde el punto de vista etiológico infección por parvovirus B19, relacionando las manifestaciones clínicas, es a través del laboratorio.1,2 El tipo de muestras empleadas pueden ser: suero, saliva y tejidos. Sin embargo, el suero y el plasma son las principales muestras utilizadas en su diagnóstico, ya que son estables para la detección del anticuerpo en contra del virus en los casos de crisis de aplasia, infección persistente en pacientes inmunodeprimidos y en infección fetal.
En la búsqueda del agente causal se utilizan diferentes estrategias diagnósticas. En la actualidad no se cuenta con el empleo de un sistema de cultivo práctico, y hasta la fecha se tien un uso limitado.
La detección de antígeno de parvovirus B19, puede ser realizada a través de radio inmunoensayo o por inmunoensayo enzimático. Para esta detección del antígeno en suero en casos de crisis de aplasia transitoria, se sugiere que el muestreo se realice cuando el cuadro clínico coincida con el pico máximo de la viremia ocasionada por este agente.
La detección directa del antígeno viral puede ser de las células infectadas por medio de inmunofluorescencia o tinción inmunoenzimática con el empleo de anticuerpos monoclonales o policlonales.5,19,20
Los ácidos nucléicos del parvovirus B19 pueden ser localizados a través de pruebas de hibridación con el empleo de sondas marcadas con material no radiactivo, lo que ha demostrado ser un método de detección directo, sensible y adecuado, con una detección de 103 a 105 copias del genoma viral con sondas de ADN o ARN.2 Se ha observado que la metodología mencionada tiene mayor sensibilidad durante la fase virémica temprana en infecciones agudas, y eleva la sensibilidad con el empleo de quimioluminiscencia.
A finales de la década de los años ochenta, la aplicación de la reacción en cadena de la polimerasa (PCR) en el diagnóstico microbiológico permitió la detección de microorganismos de difícil desarrollo, como es el caso de Mycoplasma, Chlamydia y virus. Esto dio al laboratorio de investigación inicialmente y al clínico más tarde, una herramienta de trabajo en la resolución de problemas que de otra manera no eran fácilmente resueltos.6,12
El PCR es el método más sensible del que se dispone para la búsqueda de ADN. Por este procedimiento, pueden ser detectadas entre 1.6 x 103 unidades internacionales por mililitro (Ul/ml) de ADN de parvovirus B19, en la que 1 UI de ADN de parvovirus B19 equivale a 0.65 genomas, usando electroforesis y tinción con bromuro de etidio, para visualizar el producto amplificado. El resultado puede ser incrementado de 10 a 100 veces cuando se acompaña de técnicas de hibridación y del uso de sondas con alta especificidad.
Cuando la determinación de IgM es dudosa como en el caso del paciente inmunocomprometido, o cuando las muestras de sangre o derivados son sometidos a un monitoreo para determinar la presencia de parvovirus B19, y en aquellos casos en que se realiza la vigilancia del pacientes bajo tratamiento, la PCR proporciona resultados satisfactorios en el 49% de los pacientes y el 70% de positividad en estudios realizados en bancos de sangre, en contra del 17% para IgM en pacientes y el 32% de bancos de sangre,8,12 sobre todo en los casos en que ha sido rebasado el pico máximo de detección de IgM (30 días de aparición de detección). La detección de IgM/PCR positivo se da en una relación de 1:10.
De acuerdo a estos estudios, la PCR ha servido para demostrar la infección por parvovirus B19 en donadores de sangre asintomáticos, en pacientes inmunocompetentes y en inmunodeprimidos virémicos que requieren tratamiento inmediato a partir de inmunoglobulinas, en el diagnóstico diferencial en pacientes con enfermedades exantemáticas, durante crisis de anemia aplásica, en infección persistente, etc.15
El estudio histopatológico de tejidos por microscopio óptico y la microscopía electrónica, constituyen otras herramientas de gran utilidad en el diagnóstico de infecciones por parvovirus B19, como lo demuestra la observación de eritroblastos gigantes en muestras que contienen células progenitoras eritroides, sugestivos de infección por parvovirus B19.4
El serodiagnóstico a través de la detección de IgM ha sido la piedra angular en el diagnóstico de infectividad por parvovirus B19.2 En procesos agudos de pacientes inmunocompetentes, la presencia de IgM se detecta en el 90% de los casos. La cual puede estar presente a partir del tercer día de aparición de los síntomas, aunque puede no aparecer hasta 7 a 10 días después, alcanzando su máximo en el día 30, y deja de ser detectable entre los 60 y 90 días. La interpretación de su hallazgo después de los 3 meses de la infección es difícil debido a su baja concentración. De igual manera, hay que tomar en cuenta la existencia de títulos bajos o ausencia de IgM en pacientes inmunocomprometidos, así como las reacciones cruzadas con rubeola, citomegalovirus, herpes simple, Epstein-Barr, sarampión y toxoplasma. Sin embargo, la presencia de IgM es considerada como uno de los principales mecanismos de protección en contra de parvovirus B19.15 Posteriormente aparece la IgG, que persiste por años y puede incluso durar toda la vida en pacientes inmunologicamente normales.8

Haga clic para agrandar la imagen
Las técnicas empleadas en la detección de inmunoglobulinas para parvovirus B19 son: contrainmunoelectroforesis (CIE), inmunoensayo enzimático (ELISA).5 En aquellos casos en que el estudio serológico no ayuda al diagnóstico, existe la posibilidad de hacer el diagnóstico directo mediante la demostración del virus a través de la microscopia electrónica, o por medio de la detección del ADN viral.
La detección de proteínas de la cápside de parvovirus B19 puede ser a través de inmunohistoquímica 19
En resumen, ante la no existencia de líneas celulares comerciales o sistemas de cultivo de células convencionales para la detección de parvovirus B19, y a pesar de que la implementación de una prueba de amplificación de ácidos nucléicos resulta costosa y especializada, este virus puede ser evidenciado por la detección de IgM e IgG, a través de procedimientos serológicos como son los ensayos inmunoenzimáticos. Sin embargo, los anticuerpos contra parvovirus humano B19, pueden no ser detectables en pacientes inmunodeficientes y en algunos casos con infección crónica y persistente. Se encuentra también su uso limitado en el feto y en pacientes inmunocomprometidos.5,18
Ante esta situación, la demostración del ADN de parvovirus B19 por PCR en suero, sangre o tejidos de pacientes, se presenta como una excelente prueba diagnóstica. La literatura reporta alta sensibilidad (1 a 10 fentogramos de ADN), elevada especificidad, y detección temprana en relación con la determinación de IgM.
REFERENCIAS BIBLIOGRÁFICAS
1. Cossat YE, Field AM, Cant B, Widdows D. Parvovirus-like particles in human sera. Lancet. 1975;1:72-3. [ Links ]
2. Brown KE. Heamatological consequences of parvovirus B19 infection. Bailliere's Clinical Hematology. 2000;13: 245-59. [ Links ]
3. Kishore J, Kapoor A. Erythrovirus B19 infection in human. Indian J Med Res. 2000;112:149-64. [ Links ]
4. Portillo-Carrillo M, Velásquez-Jones L, Gómez-Chico VR y col. Aplasia adquirida de la serie roja por infección por parvovirus B19 en una adolescente con transplante renal. Bol Med Hosp. Infant Mex. 2006;63:255-63. [ Links ]
5. Enders M, Schalasta G, Baisch C y col. Human parvovirus B19 infection during pregnancy — Value of modern molecular and serological diagnostics. J Clin Virol. 2006;35: 400-6. [ Links ]
6. Pankuweit S, Moll R, Baandrup U, Portig I, Hufnagel G, Maisch B. Prevalence of the Parvovirus B19 genome in endomyocardial biopsy specimens. Hum pathol. 2003;3497-503. [ Links ]
7. Fixer J and Styles L. Sickle cell disease. In Vichinsky E, Walter MC and Feusner J, editores. Pediatric Clin N AM. 2000;149:1193-210. [ Links ]
8. Mustafa MM, McClain KL. Diverse hematologic effects of Parvovirus B19 infection. In (ed). Pediatric Clin NAM. 1996;43:809-21. [ Links ]
9. Heegaard ED, Brown KE. Human Parvovirus B19. Clin Microbiol Ver. 2002;15:485-505. [ Links ]
10. Söderiund M, Brown CS, Spaan WJM, Hedman L and Hedman K. Epitopes Type Specific Ig Responses to Capsid Proetins VP1 and VP2 of Human Parvovirus B19. J Infect Dis. 1995;172:1431-6. [ Links ]
11. Servant A, Laperche S, Lallemand F. Genetic diversity within human erythrovirus of three genotypes. J Virol 2002;76:9124-34. [ Links ]
12. Cohen BJ, Gandhi J and Clewley JP. Genetic variants of parvovirus B19 identified in the United Kingdon: Implications for diagnostic testing. J Clin Virol. 2006;36: 152-5. [ Links ]
13. Kurtzman G, Frickhofen N, Kimball J, Jenkins DW, Nienhuis AW, Young NS. Pure red-cell aplasia of 10 years' duration due to persistent Parvovirus B19 infection and it's cure with immunoglobulin therapy. N Engl J Med. 1989;321:519-23. [ Links ]
14. Artinos de OS, Bastos CLA, de Madeiros PAC, Faillace TF, Setúbal S, Pereira NJ. Clinical and epidemiological aspects of human Parvovirus B19 infection in an urban area in Brazil (Niterói city area state of Rio de Janeiro, Brazil). Mem Inst Oswaldo Cruz. 2002;97:965-70. [ Links ]
15. Grangeot-Keros L. Molecular disgnosis of viral materno-fetal infections. Ann Pharm Fr. 2003;61:259-64. [ Links ]
16. Aslan B, Serin MS, Aslan, et al. 2007. Detection of parvovirus B19 in synovial fluids of patients with osteoarthritis. Diagnostic Microbiology and Infectious Disease. 2007;60: 381-5. [ Links ]
17. Tercan US, Ozunel L, Kasifoglu N, Akgun Y. The investigation of Parvovirus B19 Infection in Patientes with Haematological Disorders by Using PCR and ELISA techniques. Brazilian J Infect Dis (BJID). 2007;11:327-30. [ Links ]
18. Lundvist A, Tolfvenstam T, Brytting M, Stolt CM, Hedman K, Broliden K. Prevalence of Parvovirus B19 DNA in bone marrow of patients with haematological disorders. Scand J Infect Dis. 1999;31:119-22. [ Links ]
19. Peterlana D, Puccetti A, Corrocher R, Lunardi C. Serologic and molecular detection of human Parvovirus B19 infection. Clinica Chimica Acta. 2006;372:14-23. [ Links ]
20. Beersma MFC, Claas ECJ, Sopaheluakan T, Kroes ACM. Parvovirus B19 viral loads in relation to VP1 and VP2 antibody responses in diagnostic blood samples. J Clin Virol. 2005;34:71-5. [ Links ]














