Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina (México)
versión On-line ISSN 2448-4865versión impresa ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.55 no.1 Ciudad de México ene./feb. 2012
Correlaciones históricas
Evolución de la transfusión sanguínea
Evolution of blood transfusion
Carlos Lenin Pliego Reyesa,b, Guadalupe Flores Alcántarc
aCoordinación de Medicina Interna. Hospital Regional "Lic. Adolfo López Mateos". ISSSTE. México, DF. Correo electrónico: dr_pliego_reyes@yahoo.com.mx
bMexican Group for Basic and Clinical Research in Internal Medicine, A.C.
cDepartamento de Enseñanza e Investigación. Hospital General Xoco. SSDF. México, DF.
Recepción: 27-07-10.
Aprobación: 24-08-11.
INTRODUCCIÓN
La sangre humana es la única fuente de eritrocitos, plaquetas y plasma, e incluye los factores de la coagulación. La transfusión es una forma simple de trasplante de órgano ya que se transfiere de un donante a un paciente, para corregir temporalmente una deficiencia o alteración de una función.
Tanto el órgano como el paciente deben ser rigurosamente examinados para asegurar la compatibilidad entre los elementos a infundir y el trasplante sólo está indicado cuando hay anormalidades específicas en espera de que el paciente-receptor sea beneficiado con dicho procedimiento. Más aún el proceso transfusional puede transmitir enfermedades infecciosas y diversas complicaciones, por lo que toma relevancia el manejo de los hemoderivados a través de los Bancos de Sangre (BS). De tal modo, los aspectos específicos de la selección de los donadores y las pruebas de compatibilidad que se realizan a cada uno de los componentes derivados de la sangre, son campo de acción en los bancos de sangre y en México se encuentra normado por la Norma Oficial Mexicana1, por lo que en el presente capítulo se realiza una descripción de la relevancia del banco de sangre.
ANTECEDENTES HISTÓRICOS
La primer trasfusión reportada fue entre 1666 y 1667 con sangre animal trasfundida a humanos. En los inicios de 1800 se desarrollo la trasfusión humano a humano, pero fue hasta 1900, cuando Landsteiner describe el grupo ABO, con lo que inicia a la era moderna en la trasfusión. Ya para 1914 se introduce el uso del citrato como medio de conservación.
De 1933 hasta 1947, John Lundy, establece los elementos y la generación del primer Banco de Sangre, con la finalidad de dotar rápidamente las demandas de hemoderivados en los servicios de cirugía en la Clínica Mayo2.
Fue desde entonces, basado en su experiencia y en los casos que se presentaban, que el punto de corte para indicar la trasfusión es la determinación menor de 10 g/dL de hemoglobina (Hb) o una pérdida mayor del 15% del volumen circulante3.
Durante la guerra de Vietnam, se describe el síndrome de distress respiratorio, y se dan los reportes relacionados a la lesión pulmonar aguda asociada a trasfusión (TRALI), considerada como uno de los riesgos más relevantes tras el uso de hemoderivados4.
MECANISMOS DE TRANSPORTE DE OXÍGENO
La hemoglobina a través de sus 2 cadenas, alfa y beta, sirve como sitio de anclaje para 4 átomos de oxígeno (O2), que al unir hasta 4 moléculas de O2, representa alrededor de 1.39 ml por gramo de Hb a una temperatura de 37° C. La unión del O2 depende de los cambios de afinidad explicados en la curva de disociación de la Hb.
El aporte de oxígeno a los tejidos es producto del contenido de éste en la sangre, y también interviene el gasto cardiaco. De modo que una caída en la concentración de Hb podría condicionar una disminución en el aporte de oxígeno a los tejidos, y considerando que la Hb se encuentra completamente saturada con oxígeno, entonces, la manera más fácil de incrementar el aporte a los tejidos es incrementando la concentración de esta proteína.
Este concepto resulta sencillo, sin embargo se sabe que cuando mantenemos una adecuada isovolemia en una pérdida de Hb de forma aguda de 4-5 g/dL, ésta es bien tolerada y no se muestran signos de hipoxia, gracias a los mecanismos de compensación basados en la disminución de las resistencias vasculares sistémicas y el incremento de la frecuencia cardiaca2,4.
Es así como se establecen los principios de transfusión del concentrado eritrocitario, sin embargo, este no es el único elemento que se maneja dentro de los bancos de sangre, pero sí resulta de mayor relevancia ante los procedimientos que deben llevarse a cabo antes de su utilización, así como la determinación de antígenos.
ANTÍGENOS Y TRANSFUSIÓN
Los antígenos relacionados con el sistema ABO se encuentran unidos a las células por proteínas de unión de membrana o por residuos de ceramida. Se piensa que los anticuerpos contra los antígenos A y B son formados como resultado de la exposición a diversas fuentes de antígenos (como una bacteria) después de los primeros meses de vida. La sangre de individuos del grupo A y B producen anticuerpos de tipo IgM y los individuos del grupo O producen tanto anticuerpos de tipo IgM e IgG. Los anticuerpos del grupo Lewis resultan clínicamente insignificantes.
Los antígenos del Rh son polipéptidos grasos con un grupo acil no glicosilados que cruzan la membrana celular eritrocitaria 12 veces. A pesar que se conocen 49 antígenos identificados para el Rh, los 5 principales, D, C, E, c y e, corresponden a la formación de anticuerpos hasta en el 99% de las reacciones clínicas. Asimismo, es importante considerar que el antígeno D es altamente inmunogénico y que 80% de los individuos que carecen de éste podrían formar anti-D una vez expuestos a trasfusión o bien hasta en un 15% a través del embarazo. Es por ello que estas determinaciones de antígenos son las que se realizan de forma rigurosa dentro de los BS.
Una vez indicada una trasfusión, debemos saber que los BS realizan una entrevista con el donador potencial, este elemento aunque sencillo e incluso para algunos considerado como trivial, representa un elemento de escrutinio importante de diversas enfermedades que pudieran estar presentes en él, ya que esta ha ayudado a disminuir la trasmisión de enfermedades, principalmente aquellas en que no contamos con elementos precisos de detección como acontece en la variante de la enfermedad de Creutzfeldt-Jacob, cuyo cuestionario es de relevancia al interrogar sobre la permanencia del donador potencial en sitios donde se ha reportado este tipo de patología.
Motivos de exclusión de donadores
Durante la solicitud de donadores debemos de excluir a las siguientes personas:
• Menores de 18 y mayores de 65 años.
• Sujetos carentes del uso pleno de sus facultades mentales o aquellos coartados del ejercicio libre de su propia voluntad.
• Personas que por razón de sus prácticas sexuales o por exposición a condiciones de alto riesgo, tienen mayor probabilidad de adquirir infección por el virus de la inmunodeficiencia humana o por los virus de la hepatitis.
Tampoco son candidatos los que tengan cualquiera de los siguientes antecedentes:
• Hepatitis.
• Positividad en marcadores serológicos para los virus B o C de la hepatitis, o ambos.
• Positividad en la prueba serológica para el virus de la inmunodeficiencia humana.
• Manifestaciones clínicas o patológicas que puedan estar asociadas o no a enfermedad por virus de inmunodeficiencia humana.
Otras causas para no ser candidato a donar son:
• Brucelosis, con persistencia de positividad en la prueba serológica.
• Toxoplasmosis.
• Tripanosomiasis americana (enfermedad de Chagas) o positividad en las pruebas serológicas.
• Paludismo, por Plasmodium malarie o por especie no identificada.
• Lepra.
• Cardiopatías.
• Epilepsia o convulsiones.
• Diátesis hemorrágica.
• Neoplasias hematológicas u otras.
• Los que hubieran recibido hormona hipofisiaria de crecimiento de origen humano.
Los candidatos a donación que en los últimos 5 años tengan antecedentes de paludismo por Plasmodium vivax o falciparum.
Personas que en los últimos 3 años tengan alguno de los antecedentes siguientes:
• Tuberculosis pulmonar.
• Haber tomado etretinato.
Sujetos que en los últimos 2 años, tengan antecedentes de 2 o más infecciones bacterianas, entre las siguientes:
• Septicemia.
• Neumonía.
• Meningitis.
• Absceso cerebral.
Aquellos que en el último año tengan cualquiera de los antecedentes siguientes:
• Sífilis, gonorrea, infección por Chlamydia u otras enfermedades transmitidas sexualmente.
• Violación o contacto sexual ocasional con desconocidos.
• Haber estado al cuidado o en estrecho contacto con pacientes con hepatitis viral.
• Haber recibido inmunoglobulina, por riesgo de transmisión del virus B de la hepatitis.
• Procedimientos o lesiones efectuados o provocados con instrumentos u objetos potencialmente contaminados con líquidos, tales como: tatuajes, acupuntura, perforación del lóbulo de la oreja, piloelectrólisis, cirugías o heridas accidentales.
• Transfusión de sangre, componente sanguíneo o crioprecipitado.
• Recepción de cualquier trasplante alogénico.
• Vacunación antirrábica.
Los que en los últimos 6 meses hayan tenido una cirugía mayor, parto o cesárea o bien un embarazo terminado por muerte del producto en cualquier edad gestacional.
Tampoco son candidatos las personas que en los últimos 45 días hayan donado sangre.
Aquellos que en los últimos 28 días, hayan recibido cualquiera de las siguientes vacunaciones:
• Antivariolosa.
• Antipoliomielítica por vía oral.
• Antisarampionosa.
• Antirubéola.
• Antiparotiditis.
• Anti fiebre amarilla.
• Antiinfluenza.
• Inmunoglobulina antitetánica.
O bien hayan tenido un tratamiento a base de tetraciclinas o isotretinoína.
Los que en las últimas 72 h hayan sido sometidos a cualquiera de los siguientes procedimientos:
• Extracción dentaria no complicada.
• Cirugía menor.
• Haber proporcionado algún componente sanguíneo por aféresis.
Candidatos que al momento de la valoración médica, cursen con cualquiera de lo que se indica a continuación:
• Síntomas de hipotensión secundarios o no a medicamentos antihipertensivos.
• Infecciones agudas o crónicas.
• Neumopatías agudas o crónicas.
• Enfermedades hepáticas activas o crónicas.
• Síntomas secundarios a cualquier inmunización.
• Efectos evidentes de intoxicación por alcohol, narcóticos, marihuana, inhalantes, o cualquier estupefaciente.
• Periodos menstrual, gestacional o de lactancia.
También al realizar la exploración física y documentar un peso menor de 50 kg, frecuencia cardíaca menor de 50 latidos por minuto (excepto en atletas) o mayor de 100. Cifras de tensión arterial de 100 mmHg o mayor para la diastólica y de 180 mmHg o mayor para la sistólica. Temperatura axilar de 37.0° C o mayor u oral de 37.5° C o mayor. O bien, la presencia de arritmia cardíaca.
Alteraciones en piel y mucosas como: ictericia, petequias, múltiples equimosis no asociadas a traumatismos, lesiones de sarcoma de Kaposi, candidiasis orofaríngea o leucoplasia pilosa. Al interrogar y observar una dermatitis persistente, lesiones activas o antiguas de herpes zoster, que abarquen más de un dermatoma, la presencia de múltiples venopunciones o mala calidad de las venas del paciente, presencia de adenomegalia en 2 o más regiones extrainguinales o bien la presencia de hepatomegalia o esplenomegalia.
Indicaciones
Dentro de las indicaciones de la trasfusión se encuentra el descenso en los niveles de hemoglobina, sin embargo en muchos estudios se ha reportado que los mecanismos compensadores que se activan en el organismo tras la presencia de anemia, generan una tolerancia adecuada en el paciente, pero esta opinión en muchas veces es poco compartida por el médico, ante la teoría de isquemia que produce la anemia.
También se han considerado las pérdidas sanguíneas en exceso como indicación para trasfundir, sin embargo este concepto resulta muy ambiguo, ya que se pueden definir cómo la pérdida de más de 2 l de sangre en 24 h durante el postoperatorio o bien una pérdida de 300 ml/h o de 100-200 ml/h durante 4 h.
Todos estos conceptos pueden ser indicativos del uso de este recurso terapéutico, sin embargo, para establecer el uso de concentrados eritrocitarios, debemos tener los siguientes datos:
• Depresión del segmento ST mayor de 0.1 mV o elevación mayor de 0.2 mV.
• Determinación de O2 menor de 32 mmHg con saturación menor del 60% de una determinación de mezcla venosa.
• Datos en relación al consumo de O2, como lo es una extracción mayor al 40%.
Por otro lado, el aumento en las "indicaciones" del evento trasfusional se han generalizado debido al conocimiento de la unión que establece la Hb con el óxido nítrico, que conlleva a un apropiado tono vascular. Con todo ello logramos garantizar el adecuado flujo capilar y la dotación de O2 a los tejidos.
Una vez descritos los elementos esenciales de las transfusiones, debemos ver el procesamiento y características de los 3 componentes que con mayor frecuencia se solicitan en la práctica diaria, cuando el banco de sangre tiene como objetivo llevar un adecuado control de calidad, y se hace referencia a cada uno de los métodos que se llevan a cabo para garantizar la efectividad y funcionalidad de equipos, reactivos y técnicas, así como, la viabilidad y seguridad de la sangre y de los componentes sanguíneos2,3,6,7.
TRANSFUSIÓN DE CONCENTRADO ERITROCITARIO
Al indicar una transfusión eritrocitaria debemos conocer que el BS trabaja con pruebas de compatibilidad: que son cada uno de los estudios practicados in vitro empleando muestras de sangre del disponente y del receptor, para comprobar la existencia de afinidad recíproca entre las células de uno y el suero del otro, para efectos transfusionales.
Existen pruebas pretransfusionales necesarias que determinaran la compatibilidad serológica de la sangre del donante y del receptor, dentro de ellas se encuentran:
Pruebas de compatibilidad. Son pruebas analíticas de laboratorio que funcionan para detectar anticuerpos en el receptor contra antígenos de las células que se transfundirán. Para ello son necesarias diversas pruebas en el receptor, inicialmente con la determinación del grupo, Rh y anticuerpos irregulares (anticuerpos aloinmunes contra antígenos eritrocitarios diferentes a los del sistema ABO), así como de pruebas cruzadas, estas últimas se llevan a cabo entre el suero del receptor y células del donante (eritrocitos o plaquetas), ello ayuda a determinar la presencia de anticuerpos en el suero.
Debido a la importancia de reacciones hemolíticas en aquellos casos de incompatibilidad eritrocitaria estas pruebas se realizan de manera rutinaria en la transfusión de sangre total, en la transfusión de plaquetas las pruebas de compatibilidad se realizan en casos de sospecha de anticuerpos (refractariedad plaquetaria).
La negatividad de estas pruebas aseguran la compatibilidad entre donante y receptor, pero ello no evitara la reacción hemolítica retardada ni la aloinmunización.
Antes de realizar las pruebas de compatibilidad, deben determinarse los grupos ABO y Rh del donador y del receptor, y el siguiente paso será seleccionar el producto sanguíneo a utilizar.
Pruebas cruzadas. Determinan los anticuerpos presentes en el suero del receptor frente a antígenos tanto ABO como el resto de antígenos eritrocitarios.
Estas pruebas se dividen en 2 grandes grupos:
• Mayor. De importancia para la transfusión, consiste en unir suero del receptor con glóbulos rojos del donador, ello determinará si existe compatibilidad ABO entre receptor y donador, además de identificar la presencia de anticuerpos en el suero del receptor que puedan producir hemolisis o aglutinación de eritrocitos transfundidos.
• Menor. En esta prueba el suero del donador se une con eritrocitos del receptor. Es menos significativa ya que en caso que se determine la existencia de anticuerpos en el plasma del donador que reaccionen con los glóbulos rojos del receptor se diluyen en el volumen sanguíneo circulante sin que tengan oportunidad de actuar.
Las pruebas son compatibles cuando no se observa hemolisis ni aglutinación, de lo contario, la aglutinación indica que algún anticuerpo del suero del donador se unió con los glóbulos rojos del receptor y por ello la prueba es incompatible.
En aquellos pacientes en los que el grupo ABO, Rh y anticuerpos irregulares son negativos, se puede descartar una reacción antígeno-anticuerpo por anticuerpos diferentes de ABO. Este paciente podrá recibir cualquier unidad de concentrado eritrocitario compatible ABO, comprobada con una prueba de compatibilidad rápida sin necesidad de hacer una prueba completa, en casos excepcionales ésta última se ha sustituido por una comprobación rápida de grupo ABO y Rh del paciente, la prueba cruzada completa se deberá realizar indudablemente en casos de anticuerpos irregulares positivos.
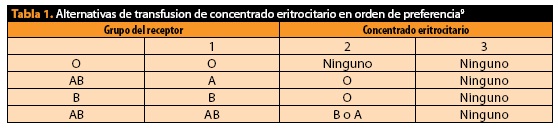
Cuando deseamos disminuir el riesgo de trasmisión de virus (específicamente citomegalovirus, por ejemplo en pacientes que serán sometidos a transplante) debemos indicar al BS se nos otorgue un concentrado con leucorreducción (tabla 1), ya que también disminuyen el número de reacciones febriles no hemolíticas así como la isoimnunización asociada a HLA. Asimismo, ha demostrado disminuir el proceso de inmunomodulación condicionado por el evento transfusional, y con ello disminuir el riesgo de procesos infecciosos e incluso de diseminación de cáncer. Sin embargo, no es una técnica que debe generalizarse, principalmente por los costos que implica6,8.
TRANSFUSIÓN DE CONCENTRADOS PLAQUETARIOS
Una unidad obtenida de un solo donante debe contener por lo menos 5,5x1010 plaquetas. La unidad de plaquetoféresis contiene por lo menos 30x1010 plaquetas, lo que la hace equivalente a 6 unidades de plaquetas de un solo donante. La decisión de transfundir plaquetas depende de la condición clínica del paciente, la causa de la trombocitopenia, el recuento de plaquetas y la capacidad funcional de las plaquetas del paciente. No debemos olvidar que se requieren dosis mayores en pacientes con fiebre, sepsis o esplenomegalia.
En general la dosis es de 6 a 10 unidades para el adulto. Se espera que cada unidad aumente el recuento plaquetario en 7.000/ml en un adulto de 70 kg de peso que no sea refractario.
Para controlar la efectividad de las transfusiones de plaquetas se debe hacer recuento dentro de las 24 h previas a la solicitud de dicha transfusión y el recuento postransfusión debe indicarse a la mañana siguiente de la transfusión del concentrado. Si 2 transfusiones consecutivas no producen el incremento esperado, hay que evaluar la efectividad de las siguientes transfusiones de plaquetas, haciendo un recuento 30-60 min después de terminada la transfusión. Si 3 transfusiones de plaquetas en el transcurso de 2 semanas no producen el incremento esperado, debemos considerar que el paciente es "refractario".
En la transfusión de concentrados plaquetarios se debe conservar la identidad ABO, en caso de no poderse lograr, se podrá transfundir concentrado plaquetario con incompatibilidad mayor como se muestra en la tabla 2.

Otro de los puntos relevantes durante el evento transfusional es la necesidad de mantener en movimiento el concentrado ya que evita la adherencia del componente10,11.
TRANSFUSIÓN DE PLASMA FRESCO
Se obtiene de donaciones individuales de sangre y se procesa en las primeras 6 h de la recolección. Contiene aproximadamente 400 mg de fibrinógeno y 200 unidades de otros factores de coagulación. El reemplazo total de un volumen sanguíneo deja al paciente con aproximadamente una tercera parte de sus factores de coagulación.
El volumen a transfundir es 10-15 ml/kg, excepto cuando hay urgencia de revertir la anticoagulación con warfarina y es suficiente una dosis de 5-8 ml/kg.
Por otro lado no debemos indicar plasma fresco para disminuir el riesgo de sangrado transoperatorio, ya que está plenamente comprobado que no tiene utilidad alguna.
En la transfusión de plasma fresco congelado (PFC) no se llevan a cabo pruebas de compatibilidad de manera rutinaria, pero es muy importante tener en cuenta la compatibilidad ABO. En relación a los anticuerpos irregulares, éstos son realizados en las donaciones y son habitualmente negativos. El PFC debe ser ABO idéntico con el receptor, en caso de no ser así se pueden realizar los cambios indicados en la tabla 3.

El PFC O deberá ser la última opción ya que los anticuerpos anti A y anti B de estos donantes tiene un título más elevado de anticuerpos IgM que los A y B y con frecuencia tienen además anticuerpos IgG, lo cual en transfusiones repetidas podría condicionar anemia hemolítica de causa inmune7,11.
CONSIDERACIONES DE CONSERVACIÓN
Otra de las complicaciones que ocupan mayor frecuencia, se trata de la contaminación bacteriana en 1 por cada 28,000-14,3000 unidades de concentrados eritrocitarios. Este riesgo es mayor al utilizar concentrados plaquetarios (1 por cada 2000 a 8000 unidades). El crecimiento bacteriano ocurre comúnmente en componentes sanguíneos que se conservan a temperatura ambiente o en aquéllos que el almacenamiento sobrepasa los 5 días. A este respecto también es digno de comentar que tras el almacenamiento sanguíneo, inicia la disminución de 2-3 difosfoglicerato (2,3 DPG) que condiciona decremento en la liberación de oxígeno.
También acontecen cambios bioquímicos, hormonales, los eritrocitos se tornan de forma bicóncava y toman formas en elipse y espiculados, y posterior a 5-10 días de almacenaje van perdiendo su flexibilidad. Al cabo de 15-28 días pierden aproximadamente el 15-20% de fosfolípidos de membrana. Debido al medio anóxico en el que se encuentran los eritrocitos, pierden función de la bomba Na-K ATPasa y de este modo se convierten en células edematosas. Todos estos cambios condicionan labilidad para ser destruidos, disminuye su vida media y no logran alcanzar adecuadamente los capilares y con ello no mejorar la oxigenación tisular.
Respecto a la conservación de concentrados plaquetarios, ya que este es el componente sanguíneo que conlleva más fácilmente la trasmisión de enfermedades infecciosas, es por esta razón que requieren refrigeración, ya que a temperatura ambiente y aquellas con períodos mayores a 5-7 días, tienen un riesgo importante para crecimiento bacteriano. Concepto a tener en cuenta principalmente cuando indiquemos este componente en pacientes con algún tipo de inmunosupresión.
Una vez completado el procedimiento de recolección de sangre, el banco de sangre deberá proporcionar a los disponentes un alimento líquido y sólido con un valor calórico mínimo de 400 Kcal y con un volumen mínimo de 500 ml y de considerarse para el disponente, la prescripción de suplementos de hierro1.
CONCLUSIONES
El evento transfusional representa una medida que tiene como finalidad corregir temporalmente una deficiencia o alteración de una función. De modo tal que los BS están encargados de llevar un adecuado control de calidad para llevar a cabo una transfusión en las mejores condiciones posibles. Asimismo, es la parte fundamental de las unidades médicas para el adecuado almacenamiento y distribución de los componentes sanguíneos.
REFERENCIAS BIBLIOGRÁFICAS
1. NOM -003-SSA2-1993 para la disposición de sangre humana y sus componentes con fines terapéuticos. [ Links ]
2. Goodnough LT, Brecher ME, Kanter MH, AuBuchon JP. Transfusion medicine. First of two parts. Blood transfusion. N Engl J Med. 1999;340(6):438-47. [ Links ]
3. American Society of Anesthesiologists. Task force on blood component therapy. Practice guidelines for blood component therapy. Anesthesiology. 1996;84(3):732-47. [ Links ]
4. Carson L, Duff A, Poses R, et al. Effect of anemia and cardiovascular disease on surgical mortality and morbility. Lancet. 1996;348:1055-60. [ Links ]
5. Simon TL, Alverson DC, AuBuchon J, Cooper ES, DeChristopher PJ, Glenn GC. Practice parameter for the use of red cell blood transfusions. Arch Pathol Lab Med. 1998; 122(2):130-8. [ Links ]
6. Marshal JC. Transfusion trigger: when to transfuse? Crit Care. 2004;8 Suppl 2:S31-3. [ Links ]
7. Welch H, Meehan K, Goodnough L. Prudent strategies for elective red blood cell transfusion. Ann Intern Med. 1992;116(5):393-402. [ Links ]
8. Shander A, Goodnough L. Why an alternative to blood transfusion?. Crit Care Clin. 2009;25(2):261-77. [ Links ]
9. Stroncek D, Rebulla P. Platelet transfusions. Lancet. 2007; 370:427-38. [ Links ]
10. Steiner M, Despotis G. Transfusion algorithms and how they apply to blood conservation: the high risk cardiac surgical patient. Hematol Oncol Clin North Am. 2007;21(1): 177-84. [ Links ]
11. Brooks, J. Qualitiy improvement opportunities in blood banking and transfusion medicine. Clin Lab Med. 2008;28(2): 321-37. [ Links ]














