Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina (México)
versión On-line ISSN 2448-4865versión impresa ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.55 no.1 Ciudad de México ene./feb. 2012
Caso clínico
Sarcoma granulocítico en una paciente con leucemia mieloide crónica
Granulocytic sarcoma in a female patient with chronic myeloid leukemia
Raúl Carrillo Esperª; Patricia Estévez Sánchezb; Jimena Muciño Bermejoc
aAcademia Nacional de Medicina. Academia Mexicana de Cirugía. Jefatura del Servicio de Terapia Intensiva. Fundación Clínica Médica Sur. México, DF.
bResidente de Medicina Interna. Hospital General Manuel Gea González. México, DF.
cResidentes de Medicina Intensiva. Fundación Clínica Médica Sur. México, DF. Correo electrónico: Revistacma95@yahoo.com.mx
Recepción: 25-08-11.
Aprobación: 12-09-11.
Resumen
El sarcoma granulocítico es un tumor localizado poco común, compuesto de células granulocíticas inmaduras. Generalmente se presenta en pacientes con leucemia mieloide aguda, síndromes mielodisplásicos o leucemia mieloide crónica. Puede ocurrir en cualquier localización anatómica. Reportamos el caso de una mujer de 41 años con el diagnóstico de leucemia mieloide crónica que presentó edema en brazo derecho que no remitía a pesar de tratamiento antibiótico y fasciotomía. El estudio histológico de la biopsia la lesión tomada mostró un sarcoma granulocítico. En este trabajo se revisa la citogenética, presentación clínica, diagnóstico y pronóstico de este síndrome tumoral.
Palabras clave: Sarcoma granulocítico, leucemia mieloide crónica, leucemia mieloide aguda.
Abstract
Granulocytic sarcoma is an uncommon and localized extramedullary tumor composed of immature granulocytic cells. It may present in patiens with acute myeloid leukaemia, myelodysplastic syndrome or chronic myelogenous leukaemia. It may occur in any anatomical site. We report on the case of a 41 year old female diagnosed with chronic myelogenous leukaemia who presented with right arm swelling that did not resolve after antibiotic and surgical fasciotomy. The histological examination showed granulocytic sarcoma. In this report the citogenetics, clinical presentation, diagnosis and outcome of granulocytic sarcoma was reviewed.
Key words: Granulocytic sarcoma, chronic myelogenous leukaemia, acute myeloid leukaemia.
INTRODUCCION
El sarcoma granulocítico (SG) es una masa tumoral compuesta por células inmaduras de la serie granulocítica originadas a partir de un precursor mieloide (mieloblastos)1.
Se ha descrito el desarrollo de SG de novo o asociado a leucemia mieloide aguda (LMA), neoplasia mieloproliferativa (NM) o síndrome mielodisplásico2. Puede ser la primera manifestación de una LMA, precederla o ser el primer dato de recurrencia de una LMA previamente tratada, considerada en remisión3. En cuanto a localización anatómica4, 24% se presentan en tejido celular subcutáneo, 24% en órbita, 11% en senos paranasales, 11% en nódulos linfoides, 5% en hueso/periostio y algunos casos aislados en el sistema nervioso central5 (tablas 1 y 2). El pronóstico de estos pacientes es malo, con una sobrevida promedio a 2 años de 6%o6'7.


El objetivo de este trabajo es presentar el caso clínico de un paciente con sarcoma granulocítico y hacer una revisión bibliográfica acerca de esta interesante entidad.
CASO CLÍNICO
Paciente de 41 años de edad con el diagnóstico de leucemia mieloide crónica por lo que recibió tratamiento con imatinib y dasatinib. Acudió al departamento de urgencias para evaluación de dolor en hombro derecho con aumento de volumen, limitación de movimiento de la articulación y fiebre. A su ingreso se corroboró el aumento de volumen asociado a disminución de la fuerza y limitación de los arcos de movilidad. Los exámenes de laboratorio con anemia Hb 10 gr/dL y trombocitopenia 78x103/microlitro. Se practicó estudio linfagamagráfico con hallazgos compatibles de proceso inflamatorio en la extremidad torácica derecha con drenaje adecuado de la vía linfática y alteración de los ganglios axilares derechos. Con base en los hallazgos clínicos y gamagráficos se diagnosticó infección de tejidos blandos, se tomaron cultivos y se inició manejo antibiótico de amplio espectro. No se observó crecimiento de microorganismos en los cultivos iniciales, ni se obtuvo mejoría clínica, por lo que se decidió realizar tomografía por emisión de positrones (PET-CT) y resonancia magnética (RM).
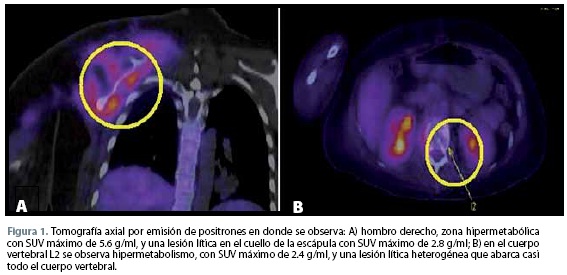
En el PET-CT se observó una amplia zona hipermetabólica que correspondía a la zona de aumento de volumen en el hombro derecho, y tenía un valor máximo de captación de 5.6 g/ml de estándar de máxima captación (SUV, por sus siglas en inglés), 2 lesiones líticas: una en la escápula derecha con SUV máximo de 2.8 gr/ml, y una heterogénea en el cuerpo vertebral en la segunda vértebra lumbar (L2) con SUV máximo de 2.4 gr/ml (figura 1). En la RM se observó una neoformación de aspecto permeativo en el cuello de la escápula con extensión glenohumeral que condicionaba desplazamiento de la transición miotendinosa del subescapular infraespinoso, redondo menor y de la capsula articular, compatible con SG (figura 2).

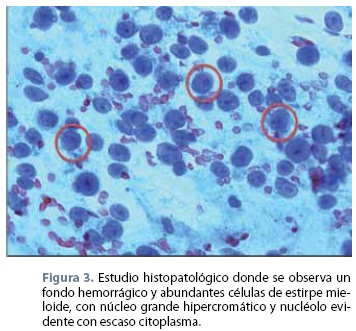
Se decidió manejo quirúrgico mediante fasciotomía con colocación de drenaje de cierre asistido con vacío (VAC, por sus siglas en inglés), así como toma de biopsia y citología. En el estudio histopatológico se observó miositis crónica inespecífica mínima, fibrosis local, y, abundantes células neoplásicas de estirpe mieloide con núcleo grande hipercromático y nucléolo evidente con escaso citoplasma, positivas para mieloperoxidasa (figura 3). Se estableció el diagnóstico de sarcoma granulocítico, y se inició quimioterapia con doxorrubicina, citarabina y dexametasona.
DISCUSIÓN
El SG, también denominado cloroma, mieloblastoma, tumor mieloide extramedular y sarcoma monocítico, fue descrito por primera vez por Burns en 1811. En 1853 King acuñó el término cloroma, debido a su apariencia típica amarillo-verdosa secundaria a su alto contenido de mieloperoxidasa. Su asociación a LMA fue reconocida en 1904 por Dock y Warthin. En 1966 Rappaport acuñó el término "sarcoma granulocítico", y en 1988 Davey propuso nombrarlo "tumor de células mieloides extramedular". En 2001 la Organización Mundial de la Salud (OMS) lo denominó sarcoma mieloide, y lo clasificó en 2 categorías mayores: sarcoma granulocítico y sarcoma monoblástico7,8.
Los factores de riesgo para el desarrollo de SG son leucemia FAB subtipo M4, M2 y M5, expresión de CD56, y anomalías genéticas como la t(8 -21) e inv(16). En adultos, la edad promedio de presentación es de 26 a 60 años, con mayor prevalencia en mujeres (80%). También ha sido descrito en niños9'10.
El SG está conformado por células inmaduras de la serie granulocítica, originadas a partir de un precursor mieloide, generalmente mieloblastos con o sin características de maduración promielocítica o polimorfonuclear, pero algunos casos tienen características mielomonocíticas o monoblásticas puras, y se ha descrito una pequeña proporción de estos tumores con hematopoiesis trilinear o con predominio eritroide o megacariocítico1.
Es un tumor de coloración verdosa debido a su alto contenido de mieloperoxidasa, pero pueden encontrarse SG de otros colores según la concentración y diferentes estados de oxidación en que se encuentre esta enzima10. En pacientes no leucémicos, el SG puede ser confundido con linfoma no Hodgkin (LNH), granuloma eosinófilo, carcinoma anaplásico o rabdomiosarcoma11.
La presentación clínica incluye datos por compresión local como dolor, aumento de volumen, masa palpable e involucración de estructuras nerviosas o vasculares vecinas. Mediante ultrasonido de tejidos blandos, puede aparecer como una masa hipoecoica homogénea, o masa hipoecoica con ecogenicidad central y lesiones hipoecoicas heterogéneas, con o sin sombra acústica11. En la tomografía axial computada (TAC), pueden observarse lesiones óseas con patrón lítico y esclerótico mixto, o lesiones con hiperintensidad homogénea tras la administración de contraste12.
El estándar de oro diagnóstico es la toma de biopsia (que puede ser tomada por aguja fina) para estudio de inmunohistoquímica e inmunofenotipo13. Las tinciones para esterasa de cloroacetato, mieloperoxidasa, lisozima, CD 43, 68 y 34 pueden ayudar a emitir un diagnóstico rápido y preciso14. En pacientes no leucémicos, la identificación de transcriptos del gen AML1/ETO, resultante de la fusión t(8;21) mediante reacción en cadena de la polimerasa en tiempo real (RT-PCR) en la médula ósea puede ser de utilidad diagnóstica15.
Una biopsia negativa puede representar una zona libre de infiltración, por lo que en pacientes con sospecha clínica y ultrasonido y tomografía compatibles con el diagnóstico es razonable utilizar RM o PET-CT para confirmar el diagnóstico de sarcoma granulocítico.
En la RM, los sarcomas granulocíticos se observan como una imagen bien definida, en "cera goteando" en T116 , con baja intensidad tanto en T1 como en T217, que realza homogénea o heterogéneamente tras la administración de gadolíneo y puede presentarse con una zona de necrosis central. En T2 pueden presentarse zonas hipointensas correspondientes a zonas con altos niveles de mieloperoxidasa y enzimas que contienen hierro (normalmente encontradas en los leucocitos)11. En pacientes con involucra-miento del sistema nervioso central (SNC), pueden encontrase masas dependientes de la duramadre, y en aquellos con actividad leucémica, grandes zonas de infiltración leucémica a la médula ósea18,19.
En un estudio retrospectivo, Ueda20 describió que el PET-CT era igualmente efectivo que el diagnóstico histopatológico en la evaluación de SG, cuando se usaba un punto de corte de 2.6 a 9.7 g/ml de SUVmax, sobre todo en tejidos en donde la captación de la fluoroglucosa en el tejido circundante normal no es muy alto, y las lesiones no están al alcance de una biopsia. Se ha descrito, además, que los cambios en la captación de la 18F fluorodesoxiglucosa (FDG) después de la quimioterapia se correlacionan con el desenlace clínico del paciente21,22.
El tratamiento debe ser dirigido a la neoplasia hematológica de base. La quimioterapia puede mejorar la sobrevida global14. La respuesta a la quimioterapia sistémica es mucho menor en pacientes que presentan recurrencia de LMA22. El trasplante de médula ósea prolonga la sobrevida en pacientes con SG aislado o asociado a LMA23, pero no disminuye la probabilidad de recurrencias extramedulraes24. A pesar de ser un tumor radiosensible, no se ha demostrado que la radioterapia mejore la sobrevida o el desenlace clínico de los pacientes con SG14. En pacientes con SG aislado, sin LMA, el tiempo a la defunción no es significativamente diferente al de aquellos con SG asociado a LMA, y la radioterapia tampoco impacta en el tiempo promedio a la defunción23.
En caso de sarcomas primarios, 87% de los pacientes desarrollarán LMA en un tiempo promedio de 7.4 meses7. Aunque se han documentado casos de sobrevida a largo plazo, el pronóstico de los pacientes que presentan SG es generalmente malo, en especial cuando se presenta en pacientes que habían logrado entrar en remisión.6 El SG es radiosensible 92 % de los pacientes entran en remisión con quimio y radioterapia, pero en pacientes con SG multifocal, la tasa de remisión disminuye a 50%14 , sin embargo, el tiempo de remisión es corto y la mayoría de los pacientes recurre10 , con una sobrevida de 6% a dos años y de 0% a cinco años6,7.
CONCLUSIONES
Presentamos el caso de una paciente con el diagnóstico previo de leucemia mieloide crónica que presentó, aumento de volumen y limitación de la movilidad en hombro derecho a secundaria a SG. Inicialmente, se pensó que se trataba de una infección de tejidos blandos, pero ante la pobre respuesta a tratamiento se decidió realizar estudios de imagen en los que se identificó una masa tumoral compatible con SG. Posteriormente, el estudio histopatológico confirmó: 1) que se trataba de un SG, y 2) que el fenotipo había cambiado a Leucemia crónica en fase blástica. Al igual que en los casos reportados en la literatura, la sobrevida de la paciente después del diagnóstico fue muy corto. En pacientes con LMC, LMA o SMD, la posibilidad de aparición de un SG debe ser considerada ante cualquier nuevo síntoma por compresión o aumento de volumen, y debe considerarse la toma de estudios de imagen para descartar la presencia de SG.
REFERENCIAS BIBLIOGRÁFICAS
1. Campidelli C, Agostinelli C, Stitson R, Pileri SA. Myeloid sarcoma: extramedullary manifestation of myeloid disorders. Am J Clin Pathol. 2009;132:426-37. [ Links ]
2. Elenitoba-Johnson K, Hodges GF, King TC, Wu CD, Medeiros LJ. Extramedullary myeloid cell tumors arising in the setting of chronic myelomonocytic leukemia. A report of two cases. Arch Pathol Lab Med. 1996;120:62-7. [ Links ]
3. Russell SJ, Giles FJ, Thompson DS, Scanlon DJ, Walker H, Richards JD. Granulocytic sarcoma of the small intestine preceding acute myelomonocytic leukemia with abnormal eosinophils and inv(16). Cancer Genet Cytogenet. 1988;35:231-5. [ Links ]
4. Xu Q, Wang M, You Q, Wang H, Ye K, Zhan R, et al. Isolated recurrence of granulocytic sarcoma-two case reports. Neurol Med Chir. 2009;49:611-5. [ Links ]
5. Smidt MH, de Bruin HG, van't Veer MB, van den Bent MJ. Intracranial granulocytic sarcoma (chloroma) may mimic a subdural hematoma. J Neurol. 2005;252:498-9. [ Links ]
6. Fitoz S, Atasoy C, Yavuz K, Gozdasoglu S, Erden I, Akyar S. Granulocytic sarcoma. Cranial and breast involvement. Clin Imaging. 2002;26:166-9. [ Links ]
7. Pathak B, Bruchim I, Brisson ML, Hammouda W, Bloom C, Gotlieb WH. Granulocytic sarcoma presenting as tumors of the cervix. Gynecol Oncol. 2005;98:493-7. [ Links ]
8. Sabattini E, Bacci F, Sagramoso C, Pileri SA. WHO classification of tumours of haematopoietic and lymphoid tissues in 2008: an overview. Pathologica. 2010;102:83-7. [ Links ]
9. Karnak I, Ciftci AO, Senocak ME, Gogus S. Granulocytic sarcoma of the scapula: an unusual presentation of acute myeloblastic leukemia. J Pediatr Surg. 1997;32:121-2. [ Links ]
10. Suzer T, Colakoglu N, Cirak B, Keskin A, Coskun E, Tahta K. Intracerebellar granulocytic sarcoma complicating acute myelogenous leukemia: a case report and review of the literature. J Clin Neurosci. 2004;11:914-7. [ Links ]
11. Fitoz S, Atasoy C, Yavuz K, Gozdasoglu S, Erden I, Akyar S Granulocytic sarcoma. Cranial and breast involvement. Clin Imaging. 2002;26:166-9. [ Links ]
12. Rysanek B, Nicolas J, Alix T, Boutard P, Minckes O, Jeanne-Pasquier C, et al. Mandibular chloroma. Rev Stomatol Chir Maxillofac. 2007;108:68-70. [ Links ]
13. Suh YK, Shin HJ. Fine-needle aspiration biopsy of granulocytic sarcoma: a clinicopathologic study of 27 cases. Cancer. 2000:25;364-72. [ Links ]
14. Hetzler L T, Manera R, Lapentino S, Hotaling A. Primary granulocytic sarcoma presenting as an external auditory canal mass in a newborn with a draining ear. Int J Pediatr Otorhinolaryngol. 2009;4:1-5. [ Links ]
15. Schwarz J, Trnková Z, Bedrlíková R, Jirásek A, Záková D, Trnený M Aleukemic granulocytic sarcoma with AML1/ ETO fusion gene expression and clonal T cell populations. Leuk Res. 2001;251137-42 [ Links ]
16. Ang P, Virapongse C. Magnetic resonance imaging of spinal intradural granulocytic sarcoma. Magn Reson Imaging. 1990;8:95-100. [ Links ]
17. Lee SS, Kim HK, Choi SC, Lee JI. Granulocytic sarcoma occurring in the maxillary gingiva demonstrated by magnetic resonance imaging. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;92:689-93. [ Links ]
18. Gong J, Li J, Liang H. Extramedullary relapse presenting as trigeminal neuralgia and diplopia after allogeneic hematopoietic stem cell transplantation. Intern Med. 2011;50:1117-9. [ Links ]
19. Seok JH, Park J, Kim SK, Choi JE, Kim CC. Granulocytic sarcoma of the spine: MRI and clinical review. Am J Roentgenol. 2010;194: 485-9. [ Links ]
20. Ueda K, Ichikawa M, Takahashi M, Momose T, Ohtomo K, Kurokawa M. FDG-PET is effective in the detection of granulocytic sarcoma in patients with myeloid malignancy. Leuk Res. 2010;34:1239-41. [ Links ]
21. Aschoff P, Häntschel M, Oksüz M, Werner MK, Lichy M, Vogel W, et al. Integrated FDG-PET/CT for detection, therapy monitoring and follow-up of granulocytic sarcoma. Initial results. Nuklearmedizin. 2009;48:185-91. [ Links ]
22. Avni B, Rund D, Levin M, Grisariu S, Ben-Yehuda D, Bar-Cohen S, et al. Clinical implications of acute myeloid leukemia presenting as myeloid sarcoma. Hematol Oncol. 2011:2. [ Links ]
23. Warme B, Sullivan J, Tigrani DY, Fred DM. Chloroma of the forearm: a case report of leukemia recurrence presenting with compression neuropathy and tenosynovitis. Iowa Orthop J. 2009;29:114-6. [ Links ]














