Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Medicina (México)
On-line version ISSN 2448-4865Print version ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.54 n.5 Ciudad de México Sep./Oct. 2011
Correlaciones históricas
El centenario de la descripción de los cuerpos de Mallory
Jesús Aguirre García*
* Facultad de Medicina. UNAM.

En 1911 el Dr. Frank Burr Mallory, patólogo del Boston City Hospital, publicó en el boletín del Hospital Johns Hopkins un artículo titulado "Cirrosis del hígado. Cinco tipos de lesiones de las cuales puede originarse" (figura 1), en el que describió las cirrosis tóxica, infecciosa, pigmentaria, sifilítica y alcohólica. En los hepatocitos de pacientes con cirrosis alcohólica observó inclusiones citoplásmicas hialinas que se teñían intensamente con eosina y hematoxilina fosfotúngstica; los hepatocitos eran rodeados y destruidos por leucocitos polimorfonucleares1 (figura 2). Las inclusiones recibieron el nombre de "cuerpos de Mallory" (CM), "hialino-alcohólico" o "hialino de Mallory".

Frank B. Mallory perteneció a la primera generación de patólogos de Estados Unidos2 y fue el iniciador de una famosa dinastía de patólogos de Harvard. Nació en Cleveland, Ohio, el 12 de noviembre de 1862 y murió en Nueva York el 27 de septiembre de 1941. Uno de sus biógrafos menciona que su padre trabajó durante toda su vida como marinero en los Grandes Lagos. Por insistencia de su madre, Frank y su hermana Eleanor iniciaron sus primeros estudios. En 1890 Mallory recibió el grado de doctor en la Escuela de Medicina de Harvard; para pagar sus estudios trabajó como histotecnólogo en el departamento de histología, actividad que despertó su interés por las tinciones histológicas y seguramente influyó en la decisión de dedicarse a la patología. Al concluir sus estudios desempeñó varios trabajos: fue instructor de histología, alimentaba a pacientes que tenían enfermedades mentales a través de una sonda gástrica en un hospital y durante varios meses intentó dedicarse a la práctica privada de la medicina; la circunstancia que le hizo desistir de esta última actividad fue que su primera paciente le pidió que interrumpiera su embarazo. En 1891 fue contratado como asistente del Dr. William T. Councilman, profesor de patología de la Escuela de Medicina de Harvard y patólogo del Boston City Hospital. Dos años después contrajo matrimonio y en su luna de miel viajó a Europa, donde permaneció un año trabajando con Chiari en Praga y con Ziegler, un prolífico autor de libros de texto de patología, en Freiburg4. A su regreso a Estados Unidos fue profesor asistente de patología en Harvard; en 1901 fue nombrado profesor asociado y en 1908, al retirarse Councilman, ocupó el puesto de jefe de patología. En 1932, a los 70 años de edad, recibió el nombramiento de profesor emérito y consultante del Boston City Hospital3.
Mallory era un hombre alto y delgado, de apariencia severa, con un comportamiento militar, exigente y minucioso, pero también paternal y generoso, especialmente con sus técnicas4 (figura 3). Por su carácter perfeccionista afirmaba que la única forma de desempeñar bien el trabajo era haciendo de éste una obsesión y evitando la vida social. Opinaba que la tinción perfecta de un corte histológico perfecto podía revelar las alteraciones de cualquier enfermedad y, por el contrario, una mala tinción y un corte inadecuado sólo podrían resultar en una falsa conclusión. En los inicios de su actividad profesional los cortes histológicos eran de mala calidad. En 1897 publicó, con otro distinguido colega y amigo, el Dr. James Homer Wright, un libro titulado Técnica Patológica. Un Manual Práctico para Técnicos en Histopatología y Bacteriología, que fue una guía imprescindible de técnicas histológicas en todo departamento de patología y se reeditó 8 veces en el curso de 40 años4. Mallory desarrolló tinciones especiales para amibas, neuroglia, tejido muscular, tejido fibroso y los CM. Fue uno de los primeros patólogos que utilizó las fotografías en las publicaciones y un experto en fotomicrografía; la calidad de sus ilustraciones histológicas era excepcional3.

A diferencia de otros patólogos contemporáneos, su principal interés no fue la patología quirúrgica sino el estudio de las enfermedades. En una ocasión expresó a uno de sus alumnos: "si tuvieras la oportunidad de decidir la localización de un nuevo laboratorio ten la certeza de que se construya lo más alejado posible de los doctores y los pacientes para evitarte molestias y pérdida de tiempo"4. A pesar de lo anterior, sus publicaciones tuvieron una gran trascendencia en patología quirúrgica. Algunas de sus principales aportaciones fueron la clasificación de la cirrosis, el estudio de las alteraciones histológicas de la tifoidea y la clasificación de los tumores. Antes de la aparición de su trabajo sobre cirrosis hepática se desconocían las causas de esta enfermedad y su clasificación era confusa. Mencionó que el material hialino observado en los hepatocitos era una alteración patognomónica de la cirrosis alcohólica y durante muchos años intentó producir cirrosis en diversos animales de laboratorio a los que administraba alcohol; después de fracasar concluyó que el alcohol por sí solo no era la causa de la cirrosis3. En las primeras décadas del siglo pasado publicó numerosos artículos acerca de la aplicación de las tinciones especiales en el estudio de los tumores; en esa época los tumores se clasificaban por la morfología de las células como "sarcoma de células redondas, de células fusiformes", etcétera. La clasificación que propuso se basó en la diferenciación histológica, algunos términos que acuñó fueron "fibroblastoma", "leiomioblastoma" y "glioma" y fue el primero que demostró el origen del ependimoma a partir de las células del epéndimo. Sus investigaciones representaron un estímulo para el surgimiento gradual de la nomenclatura actual de los tumores4.
Durante su vida recibió numerosas distinciones. Fue miembro de un gran número de sociedades médicas de Estados Unidos, fundador de la American Association of Pathologist and Bacteriologist, de la que fue tesorero y presidente, fundador de la American Association for Cancer Research, miembro honorario de la Sociedad de Patología de Gran Bretaña e Irlanda y miembro correspondiente de la Real Sociedad Médica de Budapest. En 1923 fue nombrado editor de la revista Journal of Medical Research, puesto en el que continuó cuando se transformó en la American Journal of Pathology en 1940; para los autores de los artículos pedía el mismo grado de perfección en el texto y las fotografías que exigía para sí mismo. En 1933, un año después de su retiro, la ciudad de Boston lo honró con la construcción de un moderno laboratorio, el Mallory Institute of Pathology3.
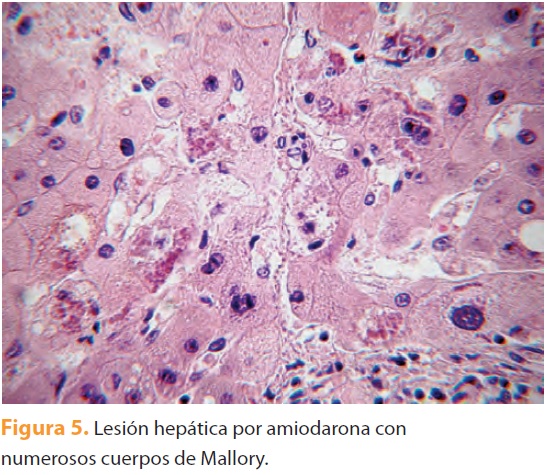
En relación a los cuerpos de Mallory, durante cerca de 5 décadas se consideraron un marcador patognomónico de alcoholismo, y la naturaleza del material hialino permaneció desconocida. A partir de la década de los sesenta se describieron en otras enfermedades hepáticas: la enfermedad de Wilson, la cirrosis infantil de la India, la cirrosis biliar primaria (figura 4) y otros padecimientos colestáticos crónicos, la derivación yeyunoileal por obesidad extrema, la hepatopatía de la obesidad, lesiones tumorales y seudotumorales (hepatocarcinoma, adenoma e hiperplasia nodular focal) y lesiones producidas por fármacos, como la amiodarona (figura 5) y el maleato de perhexilina5.

En 1973 Rubin y Lieber6 produjeron por primera vez, en forma experimental, hepatitis alcohólica con CM en babuínos que recibieron una dieta rica en alcohol durante 9 meses. Ese mismo año Wiggers et al7 describieron las características ultramicroscópicas de los CM y por el hallazgo de estructuras fibrilares sugirieron que correspondían a proteínas del citoesqueleto. Dos años más tarde Denk et al8 llevaron a cabo estudios sobre protoporfirina en ratones a los que administraron un antimicótico, la griseofulvina; los ratones desarrollaron porfiria y hepatomas con CM.
El trabajo de Helmut Denk, patólogo de la Escuela de Medicina de la Universidad de Graz, Austria, y su grupo, demostró que un agente diferente al alcohol podía producir CM, lo cual representó un valioso modelo experimental en el estudio del material hialino y fue el inicio de un gran número de investigaciones que permitieron conocer su composición y patogenia. Por la extraordinaria contribución de Denk al conocimiento de las inclusiones citoplásmicas hialinas varios hepatólogos y hepatopatólogos propusieron llamarles cuerpos de Mallory-Denk9, desde 2007 aparecen generalmente en la literatura con este nombre. Otros agentes que producen la formación de CM son la colchicina10, el DDC (dietil1, 4-dihidro-2,4,6-trimetil-3,5-piridinedicarboxilato)11 y el dieldrin12. En los seres humanos y los ratones los CM desaparecen cuando se suprime la ingestión de alcohol o la administración de griseofulvina o DDC durante varios meses9.
En 1979 el grupo de Denk13 y otros investigadores demostraron por análisis bioquímico e inmunohistoquímico que los CM están formados por 3 clases de proteínas: filamentos intermedios, chaperonas y proteínas que participan en la degradación proteica. Los principales componentes son los filamentos intermedios, las citoqueratinas 8 y 18. Entre las chaperonas están proteínas de choque de calor Hsp 70 y miembros de las familias Hsp 90 y Hsp 25. Las proteínas responsables de la proteólisis son la ubicuitina y la p62 (o secuestosoma 1). Diversos agentes etiológicos, como el calor, la luz ultravioleta y los radicales libres, producen un plegamiento anormal de las proteínas en células eucarióticas y procarióticas. La alteración en la estructura de las proteínas es corregida por las chaperonas, cuyo papel es auxiliar a las proteínas al conseguir una conformación funcional y facilitar su llegada al sitio de la célula donde llevan a cabo sus funciones14,15. Cuando este mecanismo falla, las proteínas anormales son degradadas por medio de proteasomas y vacuolas autofágicas, y cuando la degradación proteica falla, las proteínas anormales son segregadas en el citoplasma como cuerpos de inclusión llamados "secuestosomas" o "agresomas"9,16.
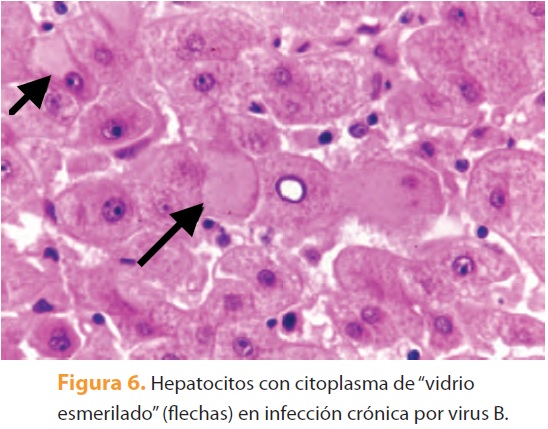
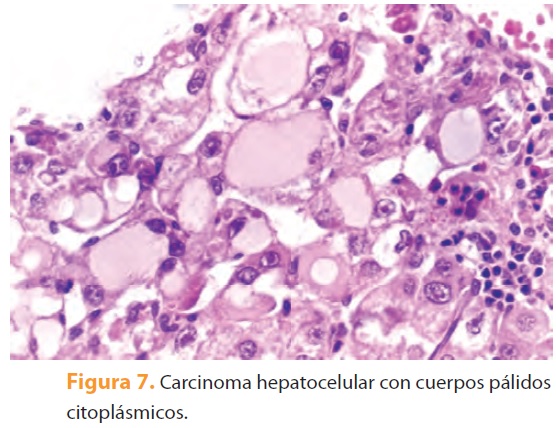
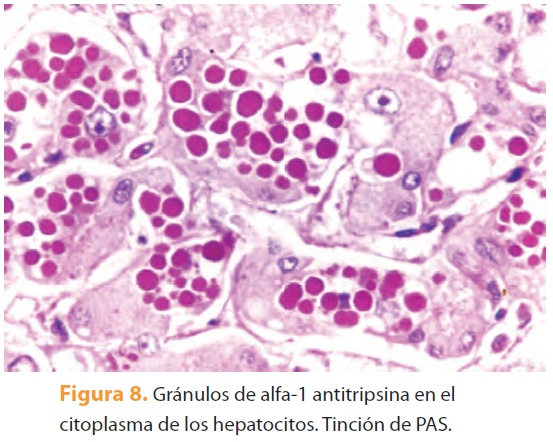
Otros ejemplos de agresomas en los hepatocitos, además de los CM, son las inclusiones de "vidrio esmerilado" en la infección crónica por virus de la hepatitis B (figura 6), los "cuerpos pálidos" que se observan en la enfermedad por almacenamiento de fibrinógeno y el carcinoma hepatocelular (figura 7) y las inclusiones de alfa-1-antitripsina en la deficiencia congénita de esta enzima16 (figura 8). Los CM se han observado también en colangiocitos y raramente en neumocitos tipo 2, células trofoblásticas y células del carcinoma renal9.
Por medio de diversos estudios se ha concluido que la formación de CM requiere varios factores: la expresión de citoqueratinas 8 y 18 mayor a la normal, con niveles de citoqueratina 8 superiores a los de citoqueratina 18; algunas modificaciones postranscripcionales de las citoqueratinas, como transamidación por transglutaminasa tisular-2 e hiperfosforilación, que impiden su degradación por proteasomas; la presencia de proteína p62 y probablemente su producción aumentada, y posiblemente también factores genéticos que explicarían la gran diferencia en la formación de CM en diversas cepas de ratón17. Otros factores son el alcohol18 y el envejecimiento9, que disminuyen la función de los proteasomas, y la activación de la autofagia, que inhibe la formación de CM o estimula su reabsorción19.
El significado de los CM se desconoce. Pueden representar un mecanismo de protección celular que secuestra proteínas potencialmente nocivas e impide la interferencia con procesos celulares vitales (las células de ratones con CM generalmente son viables y tienen la capacidad de dividirse) o representan el inicio de un daño celular progresivo porque atraen a los neutrófilos que destruyen a los hepatocitos9.

REFERENCIAS BIBLIOGRÁFICAS
1. Mallory FB. Cirrosis of the liver. Five different types of lesions from which it may arise. Bul Johns Hopkins Hosp. 1911;22:69-75. [ Links ]
2. Reuben A. Pearls of pathology. Hepatology. 2003;37:715-8. [ Links ]
3. Freeman W. Frank Burr Mallory. A doctor of physicians. N Engl J Med. 1944;231:824-8. [ Links ]
4. Scully RE, Vickery AL Jr. Surgical pathology at the hospitals of Harvard Medical School. En: Guiding the Surgeon's Hand. The History of American Surgical Pathology. Ed. Rosai J. Chap 6. American Registry of Pathology. Armed Forces Institute of Pathology. Washington, D.C.; 1997. p. 91-3. [ Links ]
5. Jensen K, Gluud C. The Mallory body: morphological, clinical and experimental studies (Part 1 of a literature survey). Hepatology. 1994;20:1061-77. [ Links ]
6. Rubin E, Lieber CS. Experimental alcoholic hepatitis: a new primate model. Science. 1973;182:712-3. [ Links ]
7. Wiggers KD, French SW, French BA, Carr BN. The ultrastructure of Mallory body filaments. Lab Invest. 1973;29:652-8. [ Links ]
8. Denk H, Gschnait F, Wolff K. Hepatocellular hyaline (Mallory bodies) in long term griseofulvin-treated mice: a new experimental model for the study of hyaline formation. Lab Invest. 1975;32:773-6. [ Links ]
9. Zatloukal K, French SW, Stumptner C, Strnad P, Harada M, Toivola DM, et al. From Mallory to Mallory-Denk bodies: what, how and why ? Exp Cell Res. 2007;313:2033-49. [ Links ]
10. Denk H, Eckerstorfer R. Colchicine-induced Mallory bodies formation in the mouse. Lab Invest. 1977;36:563-5. [ Links ]
11. Yokoo H, Harwood TR, Racker D, Arak S. Experimental production of Mallory bodies in mice by diet containing 3,5-diethoxycarbonil-1,4-dihydrocollidine. Gastroenterology. 1982;83:109-13. [ Links ]
12. Meierhenry EF, Ruebner BH, Gershwin ME, Hsie LS, French SW. Mallory body formation in hepatic nodules of mice ingesting dieldrin. Lab Invest. 1981;44:392-6. [ Links ]
13. Franke WW, Denk H, Schmid E, Osborn M, Weber K. Ultrastructural, biochemical, and immunologic characterization of Mallory bodies in livers of griseofulvin-treated mice. Fimbriated rods of filaments containing prekeratin-like polypeptides. Lab Invest. 1979;40:207-20. [ Links ]
14. Macario AJL, Conway de Macario E. Sick chaperones, cellular stress and disease. N Engl J Med. 2005;353:1489-501. [ Links ]
15. Goldberg AL. Protein degradation and protection against misfolded or damaged proteins. Nature. 2003;426:895-9. [ Links ]
16. Stumptner C, Fuchsbichler A, Heid H, Zatloukal K, Denk H. Mallory body -a disease- associated type of sequestosome. Hepatology. 2002;35:1053-62. [ Links ]
17. Omary MB, Ku N-O, Strnad P, Hanada S. Toward unraveling the complexity os simple epithelials keratins in human disease. Lab Invest. 2009;119:1794-805. [ Links ]
18. Fataccioli V, Andraud E, Gentil M, French SW, Rouach H. Effects of chronic ethanol administration on rat proteasome activities: relationship with oxidative stress. Hepatology. 1999;29:14-20. [ Links ]
19. Harada M, Hanada S, Toivola DM, Ghori N, Omary MB. Autophagy activation by rapamycin eliminates mouse Mallory-Denk bodies and blocks their proteasome inhibitormediated formation. Hepatology. 2088;47:2026-35. [ Links ]
Nota
Agradecimiento a la Dra. Rocío Arreóla por su valiosa colaboración.














