Antecedentes
El síndrome de Guillain-Barré (SGB) es la principal causa de parálisis flácida aguda en el mundo, con incidencia de 0.81 a 1.89 casos por 100 000 habitantes al año.1 Se debe a una respuesta inmunológica aberrante hacia el nervio periférico, desencadenada por un agente ambiental como infección de vías respiratorias, infección gastrointestinal o aplicación reciente de vacuna (cuatro semanas antes).2 La neuropatía axonal motora aguda (AMAN, acute motor axonal neuropathy) es la variante electrofisiológica más frecuente en México, la cual se asocia a infección gastrointestinal por Campylobacter jejuni.3,4 Las pandemias se han relacionado con aumento de casos de SGB, por ejemplo, en el contexto de la fiebre por el virus del Zika, la variante electrofisiológica AIDP fue la más frecuente.5 Ciertas aplicaciones de vacunas están relacionadas en temporalidad (< 6 semanas posterior a la aplicación de vacuna) con SGB, como las vacunas contra el virus de la influenza estacional, contra la poliomielitis y, recientemente, contra SARS-CoV-2.6-8
Los tratamientos del SGB, tanto la inmunoglobulina humana intravenosa (2 g/kg divididos en cinco días) como los recambios plasmáticos (cinco sesiones), son igualmente eficaces. Sin embargo, a pesar del diagnóstico temprano e inicio oportuno del tratamiento, 30 a 40 % de los pacientes presenta pobre pronóstico funcional a corto y largo plazo.9 Debido a la pandemia ocasionada por la infección por SARS-CoV-2, a partir del 1 de marzo de 2020 (al inicio de la pandemia) en la gran mayoría de los países se instalaron medidas de aislamiento social e higiene frecuente de manos. En 2021, en México se llevó a cabo vacunación masiva contra este virus en toda la población.10
El objetivo del estudio fue describir el comportamiento clínico del SGB durante los años de la pandemia de COVID-19, en comparación con años previos (2019-2018) en el Instituto Nacional de Neurología y Neurocirugía.
Material y métodos
Estudio transversal anidado en una cohorte prospectiva de pacientes con diagnóstico de SGB conforme a los criterios de Ausbury,11 atendidos en un centro de tercer nivel en México entre el 1 de enero de 2018 y el 31 de diciembre de 2021. Los pacientes fueron clasificados en dos grupos:
- Atendidos entre 2018 y 2019 (antes de la pandemia por virus del SARS-CoV-2).
- Atendidos entre 2020 y 2021 (durante la pandemia de COVID-19).
De los pacientes incluidos se obtuvo información de las siguientes características clínicas: edad (años), sexo, antecedente de infección previa, antecedente de vacunación previa (< 6 semanas de aplicación de vacuna e inicio de síntomas), valoración de la fuerza muscular a través de la escala MRC (escala del Medical Research Council) al diagnóstico, escala de discapacidad de SGB (al momento del diagnóstico), afección de nervios de cráneo, disautonomías durante la evolución (variabilidad de tensión arterial o frecuencia cardíaca no explicada por alguna condición médica asociada como fiebre, dolor o sepsis según el criterio del médico tratante), requerimiento de ventilación mecánica invasiva, duración de la estancia hospitalaria, tratamiento (2 g/kg de inmunoglobulina humana o cinco sesiones de recambios plasmáticos) y defunción. Se recabó información acerca de los resultados del examen citoquímico de la punción lumbar: niveles de proteínas (mg/dL) y recuento celular, considerando los niveles de proteínas ≥ 45 mg/dL con recuento celular ≤ 5 como disociación proteico-citológica.
Con los estudios de neuroconducción realizados rutinariamente, conforme a los criterios de Rajabally12 se distinguen las siguientes variantes electrofisiológicas:
- Polineuropatía desmielinizante inflamatoria aguda (AIDP, acute inflammatory demyelinating polyneurophaty).
- Neuropatía axonal motora aguda (AMAN).
- Neuropatía axonal sensorial motora aguda (AMSAN, acute motor sensory axonal neurophaty).
- Inexitable.
- Equívoca.
La marcha independiente (escala Hughes ≤ 2 puntos) a los tres meses de seguimiento se definió como buen pronóstico funcional.
Análisis estadístico
Para el análisis descriptivo se determinó la distribución de las variables continuas con la prueba de Kolmogorov-Smirnov, las variables se describieron en medias con desviación estándar (DE) o medianas y rangos intercuartílicos (RIC), según su distribución. Las variables categóricas se expresaron en frecuencias y porcentajes. Para buscar diferencias entre los grupos se utilizaron pruebas de chi cuadrada y exacta de Fisher para variables categóricas, prueba t de Student para comparar medias y prueba U de Mann-Whitney para comparar medianas. Un valor de p < 0.05 se consideró estadísticamente significativo. Mediante curvas de supervivencia de Kaplan-Meier se analizó la recuperación de la marcha independiente entre los grupos, un valor de log-rank < 0.05 fue considerado significativo.
Resultados
Características de la población
Fueron atendidos 201 pacientes (123 en época COVID-19 y 78 antes de la pandemia), 69 % fue del sexo masculino, la edad promedio fue de 45.5 ± 16 años. Respecto a los antecedentes clínicos, 22 % presentó infección de vías respiratorias; 37 %, diarrea; y 10 %, vacunación. Las principales características clínicas fueron puntuación promedio en la escala MRC de 32 ± 17, afección de nervios de cráneo, necesidad de ventilación mecánica invasiva en 29 %, mediana de 4 puntos en la escala de Hughes al ingreso (RIC = 1-5). Se recabaron 151 resultados citoquímicos de líquido cefalorraquídeo, de los cuales 48 % presentaba disociación proteico-citológica. Se dispuso de 162 estudios de neuroconducción, entre los cuales la variante AIDP fue la más frecuente (48.8 %). Ciento sesenta y tres pacientes (81 %) presentaron pérdida de la marcha independiente (Hughes ≥ 3) al ingreso, 152 completaron el seguimiento de tres meses, 43.7 % recuperó la marcha independiente (Hughes ≤ 2); cinco pacientes presentaron defunción intrahospitalaria (2.5 %).
Análisis comparativo
Los pacientes en época COVID-19 presentaron menor antecedente de infección de vías respiratorias (18 % versus 29 %, p = 0.049), mayor frecuencia de afección de nervios de cráneo bulbares (44 % versus 28 %, p = 0.026), menor puntuación en la escala MRC (30 ± 16.7 versus 34.3 ± 17.7, p = 0.04) y mayor frecuencia de antecedente de vacunación (16 % versus 0 %, p = 0.001). No existieron diferencias en la frecuencia de las variantes clínicas o electrofisiológicas. Los pacientes en época COVID-19 fueron mayormente tratados con inmunoglobulina humana (68.3 %), Tabla 1.
Tabla 1 Características clínicas y paraclínicas de pacientes con SGB antes y durante la pandemia de COVID-19
| Característica | Época COVID, 2020-2021 (n = 123) | Época no COVID, 2018-2019 (n = 78) | p | ||
|---|---|---|---|---|---|
| Promedio ± DE | Promedio ± DE | ||||
| Edad (años) | 45.2 ± 15.4 | 46.0 ± 16.8 | 0.73 | ||
| Escala MRC (puntuación) | 30 ± 16.7 | 34.3 ±17.7 | 0.04 | ||
| Mediana | RIC | Mediana | RIC | ||
| Días inicio de síntomas al ingreso | 4 | 2-9 | 5 | 2-5 | 0.80 |
| Niveles de proteínas en LCR (mg/dL) | 49 | 32-106 | 36 | 26-90 | 0.29 |
| Estancia hospitalaria (días) | 37.5 | 21.15-74 | 56 | 32-82.25 | 0.09 |
| Hughes al ingreso | 5 | 4-5 | 4 | 4-5 | 0.35 |
| n | % | n | % | ||
| Sexo masculino | 90 | 73 | 29 | 37 | 0.15 |
| Diarrea previa | 44 | 36 | 31 | 29 | 0.65 |
| IVRA previa | 22 | 18 | 23 | 29.5 | 0.049 |
| Vacunación previa | 20 | 16 | 0 | 0 | 0.001 |
| Afección del nervio craneal VII | 55 | 44.7 | 32 | 41 | 0.66 |
| Afección de nervios oculares | 17 | 13.8 | 17 | 16.6 | 0.17 |
| Afección de nervios craneales IX y X | 54 | 44 | 22 | 28 | 0.026 |
| Disautonomías cardiovasculares | 38 | 31 | 21 | 27 | 0.63 |
| Requerimiento de VMI | 34 | 28 | 24 | 30.8 | 0.63 |
| Variante clínica | |||||
| Sensitivomotora | 80 | 65 | 40 | 51 | 0.057 |
| Motora pura | 32 | 26 | 24 | 31 | 0.51 |
| Miller-Fisher/SGB | 8 | 6.5 | 10 | 13 | 0.13 |
| Variante electrofisiológica | |||||
| AIDP | 48/96 | 50 | 31/66 | 47 | 0.75 |
| AMAN | 29/96 | 30.2 | 19/66 | 29 | 0.86 |
| AMSAN | 4/96 | 4.2 | 3/66 | 4 | > 0.99 |
| Inexitable | 6/96 | 6.2 | 7/66 | 11 | 0.38 |
| Equívoca | 9/96 | 9.3 | 6/66 | 9 | > 0.99 |
| Disociación proteico-citológica | 45/92 | 49 | 27/59 | 45.7 | 0.74 |
| Tratamiento | |||||
| Inmunoglobulina | 84/123 | 68.3 | 38/78 | 48.7 | 0.008 |
| Recambios plasmáticos | 21/123 | 17 | 25/78 | 32 | 0.016 |
| Defunción | 2 | 3 | 0.37 | ||
| Marcha independiente a los tres meses de seguimiento | 43/91 | 47.2 | 23/61 | 37.7 | 0.31 |
AIDP: acute inflammatory demyelinating polyneurophaty; AMAN: acute motor axonal neurophaty; AMSAN: acute motor sensory axonal neurophaty; DE: desviación estándar; IVRA: infección de vías respiratorias altas; LCR: líquido cefalorraquídeo; RIC: rango intercuartílico; SGB: síndrome de Guillain-Barré; VMI: ventilación mecánica invasiva.
De los 20 pacientes con antecedente de vacunación contra SARS-CoV-2, en seis la vacuna relacionada fue Gam-COVID-Vac; en siete, ChAdOx1-S; y en cuatro, BNT162b2.
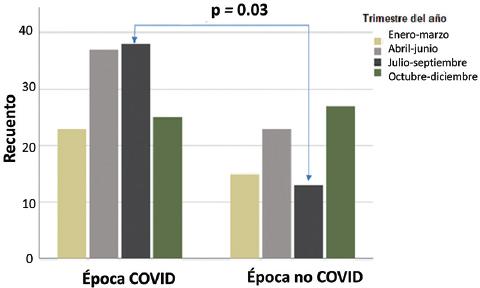
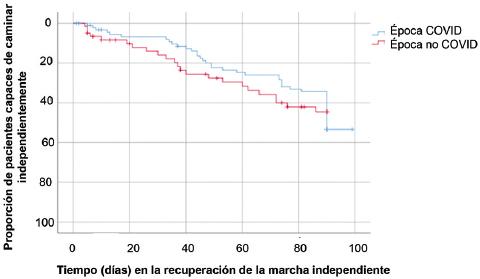
Al analizar la presentación de los casos de SGB de acuerdo con los trimestres del año, se observó un incremento en el trimestre julio-septiembre en época COVID-19 (38 % versus 13 %, p = 0.03), como se aprecia en la Figura 1. Respecto al pronóstico, no se identificó diferencia entre los grupos en la recuperación de la marcha independiente (Figura 2) o en la mortalidad.
Discusión
El SGB es la principal causa de parálisis flácida aguda en el mundo, con una prevalencia de 0.83 a 1.89 casos por cada 100 000 habitantes. Afecta mayormente a hombres, con una relación hombre-mujer de 2:1. Observamos que durante la pandemia de COVID-19, 90 % de los casos fue del sexo masculino, sin que ello resultara significativo.1,2
El incremento de casos de SGB se ha asociado a pandemias, como se observó en la pandemia por el virus del Zika; se identificaron partículas del virus en suero, orina o líquido cefalorraquídeo de los pacientes con SGB.5 Respecto a la pandemia de COVID-19, se reportaron varias manifestaciones del sistema nervioso central ocasionadas directamente por el virus, como enfermedad vascular cerebral (isquémica y hemorrágica) e hiposmia, entre otras.13 No obstante, fisiopatológicamente en los casos de SGB no se ha podido establecer una causa directa porque no se han aislado partículas del virus en líquido cefalorraquídeo o en nervio periférico.10 No obstante, los estudios epidemiológicos son controversiales. En una investigación realizada en Reino Unido se reportó que durante los primeros meses de la pandemia (marzo-junio de 2020) se observó un decremento de la incidencia de casos de SGB, en comparación con años previos.13,14 En Corea, la incidencia de SGB durante el primer año de la pandemia (2020) fue menor: 1.01 a 1.19 casos por 100 000 personas, a diferencia de 1.33 a 1.68 casos por 100 000 personas en años previos.15 En Brasil, durante los años de la pandemia (2020-2021) se atendieron 1815 casos de SGB, 248 casos (15.8 %) más que en años anteriores (208-2019), lo que representó un incremento en la incidencia de SGB durante la pandemia: de 1.08 a 1.24 por 100 000 personas.16
En nuestro centro se apreció un incremento de 56 % de casos de SGB durante la pandemia (2020-2021); no obstante, esta información debe considerarse con reserva debido a que en este tiempo varios hospitales de la Ciudad de México se convirtieron en centros de atención de COVID-19 y el Instituto Nacional de Neurología y Neurocirugía continuó con la atención de padecimientos neurológicos y apoyando a otras instituciones.
En 76 %, los casos de SGB se relacionan con alguna infección previa (entre dos y cuatro semanas antes), ya se viral o bacteriana de vías respiratorias o gastrointestinal (por ejemplo, Campylobacter jejuni).17 Durante la pandemia de COVID-19, en los pacientes con SGB disminuyó el antecedente de infección de vías respiratorias. Lo anterior probablemente se debió, como en otras poblaciones, a las medidas de aislamiento social, uso de cubrebocas e higiene frecuente de manos, sobre todo durante el primer año de la pandemia.15
Las inmunizaciones constituyen uno de los principales disparadores de SGB.8,18 Sejvar et al. señalaron que para que un caso de SGB sea relacionado con una vacuna, esta debió haber sido aplicada dentro de las seis semanas previas al inicio de los síntomas de SGB, además deben excluirse otros desencadenantes (infección de vías respiratorias o gastroenteritis), contar con resultado de análisis citoquímico de líquido cefalorraquídeo con hallazgo típico (disociación proteico-citológica) y estudio de neuroconducción con hallazgos de la variante electrofisiológica clásica (ADIP o axonal).19 A finales de 2020 y durante 2021, los países iniciaron la vacunación masiva contra SARS-CoV-2 y México no fue la excepción.10
Desde las primeras poblaciones vacunadas, se reportaron casos de SGB relacionados con las diferentes vacunas disponibles.7 Durante 2021, 20 casos (16 %) de nuestra población presentaron antecedente de vacunación (< 6 semanas); Gam-COVID-Vac fue la vacuna implicada con más frecuencia. Es importante mencionar que ocho casos fueron publicados previamente.20
La información anterior está condicionada por la naturaleza del Instituto: se trata de un hospital de tercer nivel donde se reciben pacientes de toda el área conurbana de la Ciudad de México que durante la pandemia recibió pacientes con efectos secundarios a las vacunas. Estudios epidemiológicos informan aumento de casos de SGB relacionados con la vacuna contra SARS-CoV-2, con incidencias que varían conforme el tipo de vacunación. En México, un estudio reportó que la incidencia de SGB por cualquier tipo de vacuna es de 1.19/1 000 000 dosis, pero la incidencia aumenta a 3.86/1 000 000 dosis con la vacuna Ad26.COV2-S. Información parecida se registró en otros países. En Estados Unidos se informó que la incidencia de SGB por la vacuna Ad26.COV2.S fue de 4.07 casos/1 000 000 dosis; por la vacuna tipo BNT162b2, 0.34 casos/1 000 000 dosis; y por la vacuna mRNA-1273, 0.44 casos/1 000 000 dosis.21 Esta información pudiera constituir una coincidencia en el tiempo debido a la situación actual de vacunación masiva en adultos. Tomando en cuenta la experiencia reportada con las campañas de vacunación masivas contra la influenza estacional, los primeros reportes indicaron incremento de la incidencia de SGB relacionada con las vacunas; en estudios más recientes se informa que la población no vacunada contra influenza presenta mayor número de casos de SGB.22,23
En países como México, donde la variante electrofisiológica más frecuentes es AMAN, el SGB tiene un comportamiento bimodal en el transcurso del año, con un primer pico de casos en los meses de abril a junio relacionado con infecciones gastrointestinales bacterianas, y otro pico de noviembre a enero, asociado a infecciones virales de vías respiratorias o gastrointestinales.4 Pensamos que la situación de la pandemia por COVID-19, tanto las medidas de aislamiento social como las vacunaciones masivas, han cambiado la epidemiologia de las enfermedades posinfecciosas en México. Durante la pandemia de COVID-19 se registró un incremento de casos de julio a septiembre de 2021, un trimestre en el que no se esperaba tal comportamiento de los casos.
El presente análisis no es un estudio epidemiológico, solo registramos la información de un centro de tercer nivel. No obstante, nuestra institución recibe un número importante de pacientes con SGB de la Ciudad de México para confirmar diagnóstico o proporcionar tratamiento (inmunoglobulina humana o recambios plasmáticos), por lo cual puede ser el reflejo de lo que sucede en otras instituciones.
Las enfermedades posinfecciosas cambian debido a las variaciones epidemiológicos de los agentes virales o bacterianos que las preceden. En países europeos, la variante electrofisiológica más frecuente de SGB es AIDP (90 % de los casos);17 sin embargo, se han observado cambios en la frecuencia de las variantes en ciertas poblaciones europeas. En un estudio se informa que una población de Italia presentó disminución en la frecuencia de la variante AIDP (47 %) e incremento en la variante axonal (35 %).24 En nuestro Instituto, durante los años de la pandemia observamos un incremento de casos de la variante electrofisiológica AIDP (50 %), lo cual pudiera está condicionado por las medidas de higiene y aislamiento social de los años anteriores. Sera interesante si este cambio en la frecuencia de las variantes del SGB se mantiene en los próximos años.
En nuestro estudio observamos que durante los años de la pandemia de COVID-19, los pacientes con SGB presentaron menor puntuación en la escala de MRC y mayor frecuencia de afección de nervios bajos de cráneo (IX y X), la cual se explica porque la variante AIDP (caracterizada por mayor afección de nervios craneales) fue la más frecuente en esta época.9
La inmunoglobulina humana y los recambios plasmáticos son igualmente efectivos en el tratamiento del SGB.1,9 Aunque en nuestro centro hospitalario contamos con ambas modalidades, en pacientes con requerimiento de ventilación mecánica invasiva, avance rápido de la enfermedad e inestabilidad hemodinámica optamos por la inmunoglobulina humana debido a su rápido inicio de administración y porque no se necesitan procedimientos invasivos. Durante la pandemia, además de los circunstancias mencionadas, en la mayoría de los pacientes se prefirió la inmunoglobulina para acortar los días de estancia hospitalaria.
Los pacientes con variante AMAN presentan peor pronóstico funcional en comparación con los pacientes con variante AIDP.4 Al respecto, los pacientes atendidos durante la pandemia de COVID-19 presentaron mayor porcentaje en la recuperación de la marcha independiente, aunque este hallazgo no fue significativo. Consideramos que el incremento de casi 50 % de recuperación de la marcha independiente a tres meses se debió a que la variante electrofisiológica AIDP fue más frecuente en la población. En nuestro Instituto, centro de tercer nivel de la atención de problemas neurológicos, la mortalidad intrahospitalaria de pacientes con diagnóstico de SGB fue de 2.5 %, sin diferencia entre los grupos, semejante a lo observado en otras poblaciones; sin embargo, la mortalidad en otras instituciones en nuestro país fue alta (12 %).25,26
La presente investigación tiene algunas limitaciones: se reportó la información de un solo centro y, además, no se dispuso de estudios de cultivos o moleculares para detectar la presencia de Campylobacter jejuni u otros virus o bacterias relacionados con SGB.
Conclusiones
Durante la pandemia de COVID-19, en nuestro centro se registró mayor frecuencia de pacientes atendidos por SGB, 16 % tenía antecedente de vacunación contra SARS-CoV-2, la variante electrofisiológica AIDP fue la más frecuente, los pacientes presentaron mayor frecuencia de afección de nervios de cráneo bulbares y menor puntuación en la escala MRC. Los pacientes atendidos durante la pandemia no presentaron peor pronóstico funcional (recuperación de la marcha independiente) ni aumento de mortalidad intrahospitalaria.











 nueva página del texto (beta)
nueva página del texto (beta)