Antecedentes
La infección por SARS-CoV-2 comprende características clínicas que van desde infección asintomática hasta enfermedad multisistémica grave.1 Los pacientes con cáncer y COVID-19 tienen mayor riesgo de resultados adversos,2,3 especialmente aquellos con neoplasias malignas hematológicas, quimioterapia activa y enfermedad metastásica.4-7
La vacunación es la estrategia más eficaz para reducir la carga que representa COVID-19, tanto por los casos graves como por la hospitalización y la mortalidad. Sin embargo, todavía quedan brechas de conocimiento sobre la eficacia de los diferentes tipos de vacunas contra COVID-19 en los pacientes con cáncer, quienes parecen tener una respuesta subóptima en comparación con las personas no inmunodeprimidas.8,9 Además, los casos de cáncer están aumentando rápidamente en México y en todo el mundo, lo que se suma a la urgencia de estudiar la respuesta inmune a la vacunación en esta población.10-12 Teniendo en cuenta estos factores, las estrategias de vacunación adecuadas y los esquemas de inmunización personalizados para pacientes con cáncer son de especial importancia.
En México, al cierre de 2021, siete vacunas contra COVID-19 habían sido aprobadas para su uso en personas ≥ 18 años y más de 70 % de la población había recibido dos dosis de vacunas contra COVID-19, cuyos tipos incluyen vacunas de ARNm, vacunas basadas en vectores virales y vacunas de virus inactivados. La Secretaría de Salud de México centralizó el programa nacional de inmunización por edades y grupos ocupacionales de alto riesgo. Con base en esta estrategia, primero se vacunaron los trabajadores de la salud, seguidos de las personas ≥ 60 años. Los pacientes con cáncer no fueron priorizados para la vacunación temprana, ni para recibir un tipo específico de vacuna.
Todavía se necesita información sobre la efectividad de la vacuna contra COVID-19 en pacientes con cáncer y conocer la respuesta inmunológica a las diferentes alternativas de los biológicos para COVID-19. Este estudio tuvo como objetivo evaluar la respuesta humoral, determinada por la cuantificación de anticuerpos poliespecíficos contra la proteína espiga (anti-S) y las características asociadas después de la inmunización contra SARS-CoV-2 en pacientes con cáncer y trabajadores de la salud de un centro oncológico de referencia en México.
Material y métodos
Diseño del estudio y población
En noviembre de 2021 se llevó a cabo un estudio transversal en el Instituto Nacional de Cancerología, un centro de atención y enseñanza de tercer nivel en la Ciudad de México. Se incluyeron pacientes con cáncer y trabajadores de la salud mayores de 18 años con un régimen de dos dosis de la vacuna BNT162b2 o AZD122 contra SARS-CoV-2. Todos los sujetos que aceptaron participar completaron un cuestionario electrónico en el que se investigaron variables sobre las vacunas contra SARS-CoV-2, comorbilidades y características demográficas. Respecto a los pacientes con cáncer, se recolectaron variables adicionales del expediente clínico electrónico, incluido el tipo de cáncer, su estadificación y tratamiento.
Este estudio fue aprobado por el Comité de Ética en Investigación (No-2022/013). Los pacientes dieron su consentimiento informado por escrito para la extracción de sangre y asentimiento para el cuestionario.
Pruebas de serología
Los títulos de anticuerpos anti-S de SARS-CoV-2 se cuantificaron mediante un ensayo de electroquimioluminiscencia con un autoanalizador Cobas e411 (Roche). Los títulos se obtuvieron en unidades por mililitro (UI/mL), en una escala de 0.80 a 250 UI/mL. Todas las muestras por debajo del umbral inferior de detección se consideraron negativas; las que rebasaron el umbral de detección superior se diluyeron (1:300) para estimar la concentración exacta de anticuerpos anti-S.
Se realizó un análisis de subgrupos con una muestra aleatoria de pacientes con cáncer y trabajadores de la salud para evaluar las diferencias en la respuesta humoral (títulos de anticuerpos anti-S) según la infección previa por SARS-CoV-2, determinada por la positividad para anticuerpos antinucleocápside (anti-N) de SARS-CoV-2.
Definiciones
El uso de quimioterapia se clasificó como quimioterapia citotóxica, terapia dirigida o inmunoterapia durante el mes anterior a la vacunación. El cáncer activo se definió como pacientes con un diagnóstico reciente o bajo tratamiento relacionado con el cáncer. En este estudio, la respuesta humoral se refiere a la producción de anticuerpos anti-S poliespecíficos. Una respuesta inmunológica humoral baja se definió como títulos de anticuerpos anti-S < 1000 UI/mL. La infección previa por SARS-CoV-2 se definió como seropositividad a los anticuerpos contra SARS-CoV-2 (anti-N).
Análisis estadístico
Se llevó a cabo análisis descriptivo en el que reportamos frecuencias y proporciones de las variables cualitativas, así como mediana y cuartiles 1 y 3 (Q1-Q3) de las variables continuas. Se utilizó la prueba U de Mann-Whitney para comparar los títulos de anticuerpos anti-S de SARS-CoV-2 entre los grupos, y se utilizó una escala logarítmica para visualizar los datos. Se empleó la prueba exacta de Fisher o χ2 para comparar proporciones, según correspondiera.
En los estudios observacionales, el efecto del tratamiento o la exposición a menudo puede ser influido por las características iniciales del paciente. Por lo tanto, evaluamos el impacto del diagnóstico de cáncer y el tipo de vacuna en la respuesta humoral con una puntuación de emparejamiento de propensión, para lo cual se utilizó un algoritmo de emparejamiento del valor (vecino) más cercano 1:1 y calculamos la diferencia de medias estandarizada (DME) para cuantificar el grado de equilibrio. Este enfoque asigna el control más cercano a cada caso de tratamiento en sus respectivas puntuaciones de propensión, y ayuda a reducir el sesgo asociado a la asignación no aleatoria de la exposición, siempre que la distribución de algunas covariables medidas sea similar entre la exposición y no exposición de los individuos.13
El modelo para el efecto del diagnóstico de cáncer se equilibró por edad, hipertensión, sexo, tipo de vacuna y tiempo desde la vacunación, mientras que el efecto del tipo de vacuna en los pacientes con cáncer se equilibró por edad, sexo, tiempo desde la vacunación, status oncológico y uso de quimioterapia. Posteriormente se realizaron modelos de regresión logística múltiple para doble ajuste con el fin de reducir el efecto de las variables mal equilibradas (DME > 0.1), como se sugirió anteriormente.14 Se utilizó la prueba de Nagelkerke para evaluar la bondad de ajuste y la razón de momios (RM) con intervalos de confianza de 95 % (IC 95 %) para el tamaño del efecto. Se utilizaron pruebas de dos colas y un valor de p < 0.05 fue considerado como estadísticamente significativo. Los gráficos y análisis estadísticos se realizaron en el programa RStudio, versión 4.1.2.
Resultados
Características clínicas y demográficas
Se incluyeron 566 personas: 127 pacientes con cáncer (22 %) y 439 trabajadores de la salud (78 %); 410 fueron mujeres (72 %) y la mediana de edad fue de 45 años (Q1-Q3 = 33-54). Otras características demográficas y clínicas se muestran en la Tabla 1.
Tabla 1 Características basales de pacientes con cáncer y trabajadores de la salud y emparejamiento de puntuación de propensión
| Variable | Antes del emparejamiento | Después del emparejamiento | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| PC (n = 127) | TS (n = 439) | p | PC (n = 127) | TS (n = 127) | DME | |||||
| Mediana (Q1-Q3) | Mediana (Q1-Q3) | Mediana (Q1-Q3) | Mediana (Q1-Q3) | |||||||
| Edad (años) | 57(49-65) | 41 (32-51) | < 0.001 | 57 (49-65) | 52 (46-59) | 0.403 | ||||
| Tiempo desde la vacunación (días) | 206 (112-249) | 147 (113-198) | < 0.001 | 119 (107-204) | 147 (113-198) | 0.003 | ||||
| n | % | n | % | n | % | n | % | |||
| Sexo | ||||||||||
| Mujer | 91 | 72 | 319 | 73 | 0.822 | 91 | 72 | 94 | 74 | 0.053 |
| Hombre | 36 | 28 | 120 | 27 | 36 | 28 | 33 | 26 | ||
| Comorbilidad | ||||||||||
| Diabetes mellitus | 10 | 8 | 22 | 5 | 0.218 | 10 | 8 | 8 | 6 | N/A |
| Hipertensión | 19 | 15 | 34 | 8 | 0.013 | 19 | 15 | 13 | 10 | 0.143 |
| Tipo de vacuna | ||||||||||
| BNT162b2 | 54 | 43 | 301 | 69 | < 0.001 | 54 | 43 | 53 | 42 | 0.016 |
| AZD122 | 73 | 57 | 138 | 31 | 73 | 57 | 74 | 58 | ||
DME: diferencia de medias estandarizada; N/A: no aplica; PC: pacientes con cáncer; Q1-Q3: cuartiles 1-3; TS: trabajadores de la salud.
Entre los trabajadores de la salud, 10 sujetos (8 %) tenían diabetes mellitus y 19 (15 %), hipertensión. En el grupo de pacientes con cáncer, nueve (7 %) presentaban neoplasias hematológicas y 118 (93 %), neoplasias sólidas. La neoplasia maligna más frecuente fue el cáncer de mama (n = 36 pacientes, 28 %), seguida del cáncer colorrectal (n = 10 pacientes, 8 %) y el de próstata (n = 8 pacientes, 6 %). Veinticuatro (19 %) pacientes recibieron quimioterapia citotóxica y cuatro (3 %), inmunoterapia o terapia dirigida dentro de los 30 días posteriores a la administración de la vacuna contra SARS-CoV-2; ninguno había recibido terapia anti-CD20 o trasplante de células madre hematopoyéticas. En cuanto al estado del cáncer, 47 pacientes (37 %) tenían enfermedad activa. Diez (8 %) tenían diabetes mellitus, y 18 (14 %), hipertensión.
Títulos de anticuerpos anti-S de SARS-CoV-2
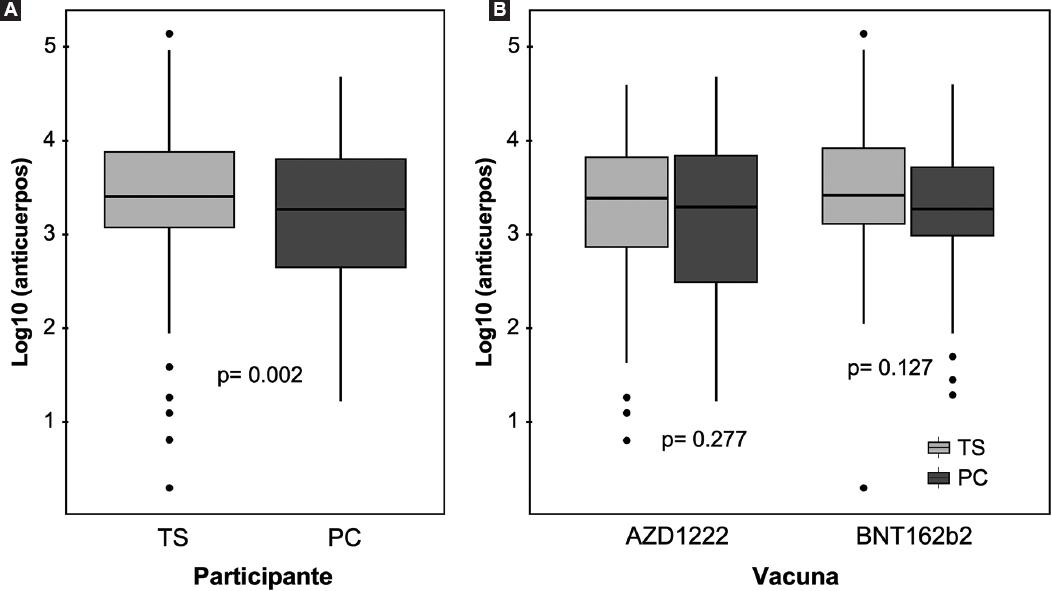
Se detectaron anticuerpos anti-S en 561 individuos (99 %) y solo cinco (1 %) tenían serología negativa: cuatro trabajadores de la salud (1 %) y un paciente con cáncer (1 %). La mediana del título de anticuerpos anti-S fue mayor en los trabajadores de la salud (2544 UI/mL, Q1-Q3 = 1188-7488) que en los pacientes con cáncer (1827 UI/mL, Q1-Q3 = 396-6402), p = 0.002, como puede apreciarse en la Figura 1A. Después de la estratificación por tipo de vacuna, los pacientes con cáncer presentaron títulos de anticuerpos más bajos; sin embargo, no se observaron diferencias estadísticas (Figura 1B). La mediana del título de anticuerpos fue de 1888 UI/mL (Q1-Q3 = 927-5408) en el grupo de pacientes con cáncer y de 2586 UI/mL (Q1-Q3 = 1311-8383) en los trabajadores de la salud que recibieron la vacuna BNT162b2 (p= 0,127); y 1788 UI/mL (Q1-Q3 = 235-7162) en los pacientes con cáncer y 2473 UI/mL (Q1-Q3 = 737-6848) en los trabajadores de la salud inmunizados con AZD122 (p = 0.277). El tiempo entre la vacunación y la cuantificación del título de anticuerpos anti-S fue mayor en los trabajadores de la salud (206 días) versus los pacientes con cáncer (148 días), p < 0.001. Se observó una mayor proporción de pacientes con títulos de anticuerpos ≥ 1000 UI/mL en los trabajadores de la salud (n = 351 pacientes, 80 %) que en los pacientes con cáncer (n = 82 pacientes, 65 %), p < 0.001.
Coincidencia de puntuación de propensión en la respuesta humoral alta (títulos de anticuerpos anti-S ≥ 1000 UI/mL)
Después de emparejar los grupos, se compararon 176 pacientes con cáncer y 176 trabajadores de la salud para evaluar el efecto del diagnóstico de cáncer en la respuesta humoral. En el modelo de regresión logística multivariante, la vacuna BNT162b2 se asoció a mayor probabilidad de títulos séricos de anticuerpos anti-S ≥ 1000 UI/mL (RMa = 3.60, IC 95 % = 1.79-7.53, p < 0.001) en comparación con la vacuna AZD122 (prueba de Nagelkerke = 0.116). No se observaron diferencias conforme a la edad, sexo, comorbilidad o tiempo desde la vacunación (Tabla 2).
Tabla 2 Análisis de regresión logística multivariable de variables asociadas a títulos de anticuerpos anti-S ≥ 1000 UI/mL en pacientes con cáncer y trabajadores de la salud después de emparejamiento por puntuación de propensión
| Variable | Respuesta alta (n = 179) | Respuesta baja (n = 75) | RMa (IC 95 %) | p | ||
|---|---|---|---|---|---|---|
| Mediana (Q1-Q3) | Mediana (Q1-Q3) | |||||
| Edad (años) | 54 (47-60) | 57 (49-63) | 0.97 (0.94-1.01) | 0.184 | ||
| Tiempo desde la vacunación (días) | 145 (108-204) | 128 (107-178) | 0.99 (0.99-1.00) | 0.810 | ||
| n | % | n | % | |||
| Sexo | ||||||
| Mujer | 133 | 74 | 52 | 69 | Referencia | 0.404 |
| Hombre | 46 | 26 | 23 | 31 | 0.76 (0.41-1.44) | |
| Diagnóstico de cáncer | 82 | 46 | 45 | 60 | 0.61 (0.33-1.09) | 0.098 |
| Comorbilidad | ||||||
| Diabetes mellitus | 12 | 7 | 6 | 8 | 0.89 (0.28-3.08) | 0.852 |
| Hipertensión | 21 | 12 | 11 | 15 | 1.00 (0.40-2.61) | 0.985 |
| Tipo de vacuna | ||||||
| AZD122 | 88 | 49 | 19 | 25 | Referencia | < 0.001* |
| BNT162b2 | 91 | 51 | 56 | 75 | 3.60 (1.79-7.53) | |
Q1-Q3: cuartiles 1-3; RMa: razón de momios ajustada.
En el segundo modelo, se emparejaron 54 pacientes con cáncer vacunados con BNT162b2 y 54 vacunados con AZD122 para examinar los efectos del tipo de vacuna en la respuesta humoral (Tabla 3). Los pacientes con cáncer que recibieron BNT162b2 presentaron más probabilidades de tener títulos de anticuerpos anti-S ≥ 1000 UI/mL en comparación con los inmunizados con AZD122 (RMa = 3.56, IC 95 % = 1.46-9.26, p = 0.006). Además, el cáncer activo se asoció a menor probabilidad de títulos altos de anticuerpos, definidos como ≥ 1000 UI/mL (RMa = 0.38, IC 95 % = 0.14-0.96, p = 0.046), prueba de Nagelkerke = 0.161. No se encontraron diferencias respecto a otras características clínicas relacionadas con el cáncer (Tabla 4).
Tabla 3 Características basales de los pacientes oncológicos vacunados contra SARS-CoV-2 y emparejamiento por puntuación de propensión
| Variable | Antes del emparejamiento | Después del emparejamiento | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Vacuna BNT162b2 (n = 54) | Vacuna AZD122 (n = 73) | p | Vacuna BNT162b2 (n = 54) | Vacuna AZD122 (n = 54) | DME | |||||
| Mediana (Q1-Q3) | Mediana (Q1-Q3) | Mediana (Q1-Q3) | Mediana (Q1-Q3) | |||||||
| Edad (años) | 59 (52-68) | 57 (46-65) | 0.065 | 59 (52-68) | 59 (48-65) | 0.273 | ||||
| Tiempo desde la vacunación (días) | 168 (139-216) | 121 (68-176) | < 0.001 | 169 (139-216) | 140 (114-198) | 0.509 | ||||
| n | % | n | % | n | % | n | % | |||
| Sexo | ||||||||||
| Mujer | 36 | 67 | 55 | 75 | 0.283 | 36 | 67 | 39 | 72 | 0.120 |
| Hombre | 18 | 33 | 18 | 25 | 18 | 33 | 15 | 28 | ||
| Uso de quimioterapia | 10 | 19 | 16 | 22 | 0.638 | 10 | 19 | 13 | 24 | 0.136 |
| Estado de cáncer activo | 25 | 46 | 25 | 34 | 0.169 | 25 | 46 | 21 | 39 | 0.150 |
| Neoplasias hematológicas | 5 | 9 | 4 | 5 | 0.412 | 5 | 9 | 4 | 7 | 0.067 |
| Comorbilidad | ||||||||||
| Diabetes mellitus | 4 | 7 | 6 | 8 | 1.000 | 4 | (7) | 5 | (1) | N/A |
| Hipertensión | 8 | 15 | 11 | 15 | 0.968 | 8 | (15) | 9 | (17) | N/A |
DME: diferencia de medias estandarizada. N/A: no aplica. Q1-Q3: cuartiles 1-3.
Tabla 4 Análisis de regresión logística multivariable de variables asociadas a títulos de anticuerpos anti-S ≥1000 UI/mL en pacientes con cáncer después de emparejamiento por puntuación de propensión
| Variable | Respuesta alta (n = 68) | Respuesta baja (n = 40) | RMa (IC 95 %) | p | ||
|---|---|---|---|---|---|---|
| Mediana (Q1-Q3) | Mediana (Q1-Q3) | |||||
| Edad (años) | 57 (48-66) | 62 (52-67) | 0.96 (0.91-1.01) | 0.162 | ||
| Tiempo desde la vacunación (días) | 153 (123-203) | 167 (126-206) | 0.99 (0.99-1.01) | 0.970 | ||
| n | % | n | % | |||
| Sexo | ||||||
| Mujer | 47 | 69 | 28 | 70 | Referencia | 0.982 |
| Hombre | 21 | 31 | 12 | 30 | 0.98 (0.38-2.59) | |
| Comorbilidad | ||||||
| Diabetes mellitus | 6 | 8 | 3 | 8 | 1.58 (0.26-10.94) | 0.619 |
| Hipertensión | 10 | 15 | 7 | 18 | 0.96 (0.24-3.92) | 0.954 |
| Uso de quimioterapia | 14 | 21 | 9 | 23 | 1.44 (0.47-4.67) | 0.526 |
| Estado de cáncer activo | 25 | 37 | 21 | 53 | 0.38 (0.14-0.96) | 0.046* |
| Neoplasias hematológicas | 5 | 7 | 4 | 10 | 0.68 (0.15-3.19) | 0.616 |
| Tipo de vacuna | ||||||
| AZD122 | 28 | 41 | 26 | 65 | Referencia | 0.006* |
| BNT162 | 40 | 59 | 14 | 35 | 3.56 (1.46-9.26) | |
RMa: razón de momios ajustada. Q1-Q3: cuartiles 1-3
Los anticuerpos contra el antígeno N se midieron en una muestra aleatoria de 327 sujetos que incluyó pacientes con cáncer y trabajadores de la salud para evaluar la infección previa por SARS-CoV-2: 178 (54 %) presentaron anticuerpos anti-N positivos y 149 (46 %) fueron negativos. En los pacientes con infección previa por SARS-CoV-2, la mediana del título de anticuerpos anti-S fue de 8548 UI/mL (Q1-Q3 = 4538-17 751), mayor en comparación con la mediana observada en los individuos sin infección previa por SARS-CoV-2 (1488 UI/mL, Q1-Q3 = 594-2902), p < 0.001.
Además, se observaron títulos de anticuerpos anti-S más altos en individuos con infección previa por SARS-CoV-2 en ambos grupos. La mediana del título de anticuerpos para pacientes con cáncer con infección previa fue de 7974 UI/mL (Q1-Q3 = 3335-13814) versus 657 UI/mL (Q1-Q3 = 94-2982) en aquellos sin infección previa (p < 0.001). De manera similar, en los trabajadores de la salud, el título de anticuerpos fue mayor en aquellos con prueba de anticuerpos N positiva (8617 UI/mL; Q1-Q3 = 4602-20 385) versus aquellos con resultado negativo (1644 UI/mL; Q1-Q3 = 801-2919), p < 0.001. En el análisis de emparejamiento por puntuación de propensión que incluyó sujetos con anticuerpos anti-N, la vacuna BNT162b2 (RMa = 5.15, IC 95 % = 1.45-20.85, p = 0.014) y la infección previa por SARS-CoV-2 (RMa = 40.85, IC 95 % = 11.21-209.39, p < 0.001) se asociaron a títulos de anticuerpos anti-S más altos (Datos suplementarios).
Discusión
Este estudio evaluó la respuesta de anticuerpos en un subconjunto de pacientes con cáncer y trabajadores de la salud después de recibir las dos dosis iniciales de vacunas BNT162b2 o AZD122 contra SARS-CoV-2. La presente investigación es uno de los pocos estudios en la región que evalúa la respuesta a la vacunación en pacientes inmunocomprometidos.
México fue pionero en establecer convenios para adquirir y administrar un gran volumen de vacunas contra SARS-CoV-2. Los principales aspectos de esta estrategia fueron la priorización de la vacunación por edades y grupos de riesgo y la amplia disponibilidad de múltiples agentes biológicos para aumentar la cobertura.
Según lo establecido por el Programa Nacional de Vacunación, los grupos con exposición ocupacional de alto riesgo, como médicos, enfermeras y socorristas, fueron inmunizados en el primer trimestre de 2021, principalmente con la vacuna BNT162b2. Posteriormente, se inmunizó a la población general según el grupo de edad: adultos mayores en febrero-marzo de 2021, seguidos por los adultos de 50 a 59 años en abril-mayo, adultos de 40 a 49 años en mayo-junio y de 39 años o menos en la segunda mitad de 2021. Sin embargo, no se adoptó una estrategia precisa para pacientes con cáncer ni otras poblaciones inmunodeprimidas, lo que llevó a una amplia gama de esquemas de vacunas en estos grupos. Lo anterior proporcionó un marco interesante para evaluar la aceptación de la vacuna, así como la respuesta a la inmunización contra SARS-CoV-2 en los pacientes con cáncer, y ha permitido compararla con la de individuos no inmunocomprometidos, como es el caso de los trabajadores de la salud.
Las estrategias disponibles para evaluar la respuesta humoral a la vacunación incluyen ensayos comerciales basados en anticuerpos anti-S de SARS-CoV-2 y la cuantificación de anticuerpos neutralizantes virales. Aunque esta última refleja con mayor precisión el grado de protección contra el virus, los ensayos de anticuerpos anti-S son ampliamente utilizados debido a su mayor disponibilidad y menor costo. Además, la mayoría de las vacunas se dirigen a la proteína espiga viral y se ha observado previamente una buena correlación entre los anticuerpos anti-S y los anticuerpos neutralizantes.15,16
Otros estudios que compararon población no inmunocomprometida con población con cáncer encontraron una respuesta humoral más alta en los trabajadores de la salud (mediana de títulos de anticuerpos de 8581 UI/mL, Q1-Q3 = 2375-26 799 UI/mL) en comparación con pacientes con tumores sólidos (mediana de títulos de anticuerpos de 1794 UI/mL, Q1-Q3 = 6504-20 698 UI/mL) y neoplasias hematológicas (mediana de títulos de anticuerpos de 1128 UI/mL, Q1-Q3 = 188-11 115 UI/mL) inmunizados con vacunas BNT162b2 y mRNA-1273.8 De manera semejante, en un metaanálisis que incluyó a pacientes con cáncer inmunizados con dos dosis de vacunas diferentes, los autores informaron una menor probabilidad de seroconversión, tanto en neoplasias malignas sólidas (RR = 0.90, IC 95 % = 0.88-0.93, I2 = 51 %) como hematológicas (RR = 0.63, IC 95 % = 0.57-0.69, I2 = 88 %), en comparación con individuos sin inmunocompromiso.17
En nuestro estudio se identificó una buena respuesta inmunológica humoral a las vacunas contra SARS-CoV-2, tanto en los trabajadores de la salud como en los pacientes con cáncer. Solo cinco sujetos (1 %), cuatro trabajadores de la salud (1 %) y un paciente con cáncer (1 %) dieron negativo para el ensayo de serología. Aunque los trabajadores de la salud mostraron concentraciones medias de anticuerpos significativamente más altas en general, no se observaron diferencias significativas entre los grupos después de la estratificación por tipo de vacuna. Lo anterior podría estar relacionado con la heterogeneidad en las características clínicas y demográficas entre grupos, como edad, comorbilidad y tiempo desde la vacunación.
En nuestra cohorte, los participantes no fueron muestreados en el mismo intervalo de tiempo desde la vacunación. Para los trabajadores de la salud, la mediana del tiempo desde la inmunización hasta la cuantificación de anticuerpos fue más larga que en los pacientes con cáncer (206 en comparación con 147 días, p < 0.001). Sin embargo, a pesar de la diferencia en el intervalo de tiempo de vacunación, los trabajadores de la salud mantuvieron títulos de anticuerpos más altos. Por otro lado, la distribución de vacunas fue diferente entre grupos; BNT162b2 se administró principalmente a trabajadores de la salud (el grupo no inmunocomprometido). Además, los pacientes en el grupo de cáncer eran mayores en comparación con el grupo de trabajadores sanitarios. Para abordar este problema, realizamos un emparejamiento en la puntación de propensión para evaluar el impacto del diagnóstico de cáncer y el tipo de vacuna en la concentración de anticuerpos anti-S, sin que encontráramos diferencias entre los grupos. Lo anterior puede explicarse por la baja proporción de pacientes bajo quimioterapia activa, así como a la alta proporción de pacientes con tumores sólidos y el escaso número de pacientes con neoplasias hematológicas, debido en parte a la presencia de neoplasias activas, neoplasias hematológicas, quimioterapia citotóxica y uso frecuente de anticuerpos monoclonales anti-CD20.18
Similar a otros estudios, encontramos una asociación entre la vacuna BNT162b2 y la proporción de individuos con una respuesta humoral inmunológica alta (definida como títulos de anticuerpos anti-S ≥ 1000 UI/mL).19 Kang et al. encontraron títulos de anticuerpos anti-S más altos (1020 UI/mL, Q1-Q3 = 571.0-1631.0 versus 2360 UI/mL, Q1-Q3 = 1243-2500) y títulos mayores de anticuerpos neutralizantes (85.0 %, IC 95 % = 65.9-92.1 versus 95.8 %, IC 95 % = 94.4-96.6) en personas que recibieron BNT162b2 versus AZD122.20 Este fenómeno podría explicarse por los mecanismos de las vacunas de ARNm, como la inducción de una respuesta persistente de células B en el centro germinal, lo que permite generar una mayor respuesta de inmunidad humoral.21 Además, en pacientes con antecedentes de COVID-19 o anticuerpos N, los títulos de anticuerpos S fueron más altos.
Aunque las vacunas de ARNm se han asociado a una respuesta inmune más robusta, su disponibilidad varía entre los países debido a que su producción es más compleja, su costo es elevado y a la cadena de frío requerida para su distribución. Al igual que otros países de América Latina, México diversificó el tipo de vacunas para lograr una amplia cobertura poblacional, lo que llevó a la adquisición de mayores cantidades de vacunas con base en vectores virales y virus inactivados. Conforme a nuestros hallazgos, destacamos la necesidad de evaluar la selección de vacunas en función de las características clínicas individuales, dado que algunos grupos parecen beneficiarse del uso de un tipo específico de vacuna más que de otras. Además, existe un beneficio potencial del uso de dosis más altas durante la vacunación primaria sobre la protección conferida en pacientes con cáncer.15 Sin embargo, es importante señalar que las comparaciones son difíciles de evaluar, ya que existe una falta de consenso sobre el umbral óptimo de la titulación de anticuerpos a partir de la cual existe una protección óptima, así como escasa evidencia respecto a la inmunidad a largo plazo en poblaciones vulnerables.
Shapiro et al. observaron que 56 % de los pacientes con neoplasias hematológicas respondieron favorablemente a la vacunación de refuerzo; entre quienes no respondieron, 57 % estaba en tratamiento activo contra el cáncer.22 Del mismo modo, Hall et al. encontraron una inmunogenicidad significativamente mayor en las respuestas humoral y celular en un grupo de receptores de trasplantes después de la tercera dosis de la vacuna de ARNm.23 Fendler et al. informaron un aumento significativo en los títulos de anticuerpos anti-S en pacientes con cáncer después de la tercera dosis de la vacuna BNT162b2.24 Por su parte, Benjamini et al. demostraron que una cuarta dosis mejora la respuesta serológica en pacientes con leucemia.25
Las vacunas de refuerzo en México, tanto para trabajadores de la salud como para pacientes con cáncer, estuvieron disponibles a principios de 2022, casi un año después de que los trabajadores de la salud fueran vacunados por primera vez contra SARS-CoV-2. Además, a mediados de 2022 se dispuso de una dosis adicional para los pacientes de alto riesgo y personas mayores; sin embargo, la distribución y las coberturas de vacunación fueron irregulares y no siempre accesibles a los grupos de alto riesgo, como sucedió con los pacientes con cáncer.
Debido a la naturaleza de este estudio, se pueden destacar varios posibles sesgos. Probablemente existió un sesgo de selección porque se invitó a las personas a participar durante la campaña de vacunación contra la influenza en fechas previamente definidas. Se ha reconocido que las personas que acuden regularmente a la vacunación tienen más interés en participar en estudios como el realizado, lo que deriva en un sesgo de selección. Además, la disponibilidad para el muestreo fue más fácil con los trabajadores de la salud en comparación con los pacientes con cáncer. Por otro lado, los pacientes vacunados estaban más a menudo en seguimiento del cáncer, lo que también introdujo un sesgo de selección hacia los tumores sólidos.
Nuestro estudio también tiene varias limitaciones. En primer lugar, fue observacional y se registró alta heterogeneidad, esperada por las características de los grupos de estudio. No obstante, este efecto se ajustó con una puntuación de propensión coincidente durante el análisis. En segundo lugar, nuestra investigación fue un estudio puntual de seroprevalencia, por lo tanto, no se pudo examinar la dinámica de la respuesta humoral en diferentes momentos. En tercer lugar, existe una falta de consenso sobre el umbral óptimo de los títulos de anticuerpos para una protección adecuada contra la infección por SARS-CoV-2. Finalmente, en este estudio no se examinaron los anticuerpos neutralizantes o la inmunidad celular, cuyo papel al parecer es esencial en la respuesta a la vacuna.
Conclusiones
Este estudio exploró la respuesta inmunológica humoral a la inmunización contra SARS-CoV-2 en pacientes con cáncer y trabajadores de la salud con vacunas basadas en adenovirus (AZD122) y ARNm (BNT162b2). Aunque todos los grupos desarrollaron anticuerpos anti-S en respuesta a la vacunación, BNT162b2 se asoció a mayor probabilidad de títulos de anticuerpos más altos. Además, el cáncer activo se asoció a menor respuesta humoral. Se necesitan nuevas estrategias de inmunización para lograr y mantener una respuesta adecuada a la vacunación entre las poblaciones inmunocomprometidas, como los pacientes con cáncer, que incluirían la selección de tipos de vacunas específicos en función de las características clínicas individuales, o bien, el aumento de las dosis de vacunas, especialmente en aquellos con neoplasias hematológicas y cáncer activo, quienes tienen un mayor riesgo de resultados adversos y muerte.
Información suplementaria
Los datos complementarios están disponibles en línea en Gaceta Médica de México en línea (DOI: 10.24875/GMM.23000038). Estos datos son proporcionados por los autores y publicados en línea para beneficio del lector. El contenido es responsabilidad exclusiva de los autores.











 nueva página del texto (beta)
nueva página del texto (beta)