Antecedentes
Existe una fuerte correlación entre la diabetes mellitus tipo 2 (DM2) y la enfermedad cardiovascular, que representa aproximadamente 65 % de la mortalidad relacionada con la diabetes.1 La enfermedad cardíaca en diabetes puede ocurrir como enfermedad coronaria, neuropatía autonómica cardíaca o miocardiopatía diabética (MCD).2 La prevalencia de diferentes grados de insuficiencia cardíaca (IC) en pacientes con DM2 fue de 19 a 26 % en diferentes ensayos clínicos.3 La prevalencia de disfunción diastólica en estos pacientes fue de 30 a 60 % en algunos estudios.4-6
Respuesta cardíaca a la diabetes
Se encontraron hallazgos asociados como fibrosis miocárdica, hipertrofia del cardiomiocito, fibrosis perivascular y aumento en la deposición de colágeno, aunados a incremento en la masa del ventrículo izquierdo (VI), empeoramiento de la función diastólica y reducción en la función sistólica del VI, debido en parte a un estado de inflamación crónica propia de la DM2.7
El estadio temprano es normalmente asintomático con cambios miocárdicos a nivel molecular. La hipertrofia ventricular y la disfunción diastólica con una fracción de expulsión del VI (FEVI) en rangos normales son las principales anormalidades en este estadio.1
La etapa intermedia está caracterizada por cardiomiopatía hipertrófica progresiva y fibrosis miocárdica, las cuales resultan en empeoramiento de la disfunción diastólica y disfunción sistólica leve.
La etapa tardía está asociada a disfunción sistólica y diastólica.3,4
Correlación de IC en pacientes con DM2
La obesidad y la DM2 son factores de riesgo para el desarrollo de IC con FEVI preservada, ya que ambas pueden llevar al desarrollo de miocardiopatía auricular y ventricular inflamatoria o fibrótica.3
La hipertrofia ventricular izquierda es el principal cambio morfológico en la MCD asociada a IC con FEVI preservada; se observa incluso en pacientes con prediabetes, en quienes es reconocida como un predictor de morbimortalidad cardiovascular. La hipertrofia ventricular izquierda concéntrica representa la principal característica estructural en pacientes con MCD manifiesta.4
La deformación global longitudinal (SGL, strain global longitudinal, promedio del grado de deformación de las fibras miocárdicas longitudinales a todos sus segmentos) del VI está reducida en pacientes con DM2. Esas anormalidades subclínicas en la función sistólica pueden ser precursoras del inicio de una IC sintomática.3
Asociación entre DM2 y cardiomiopatía
La MCD se define como una disfunción miocárdica en pacientes con DM2 en ausencia de enfermedad coronaria, hipertensión o enfermedades valvulares del corazón4 (Figura 1A). Actualmente, los criterios mínimos para el diagnóstico de MCD incluyen disfunción diastólica en el VI o reducción en la FEVI, hipertrofia ventricular izquierda y fibrosis miocárdica intersticial.1,8
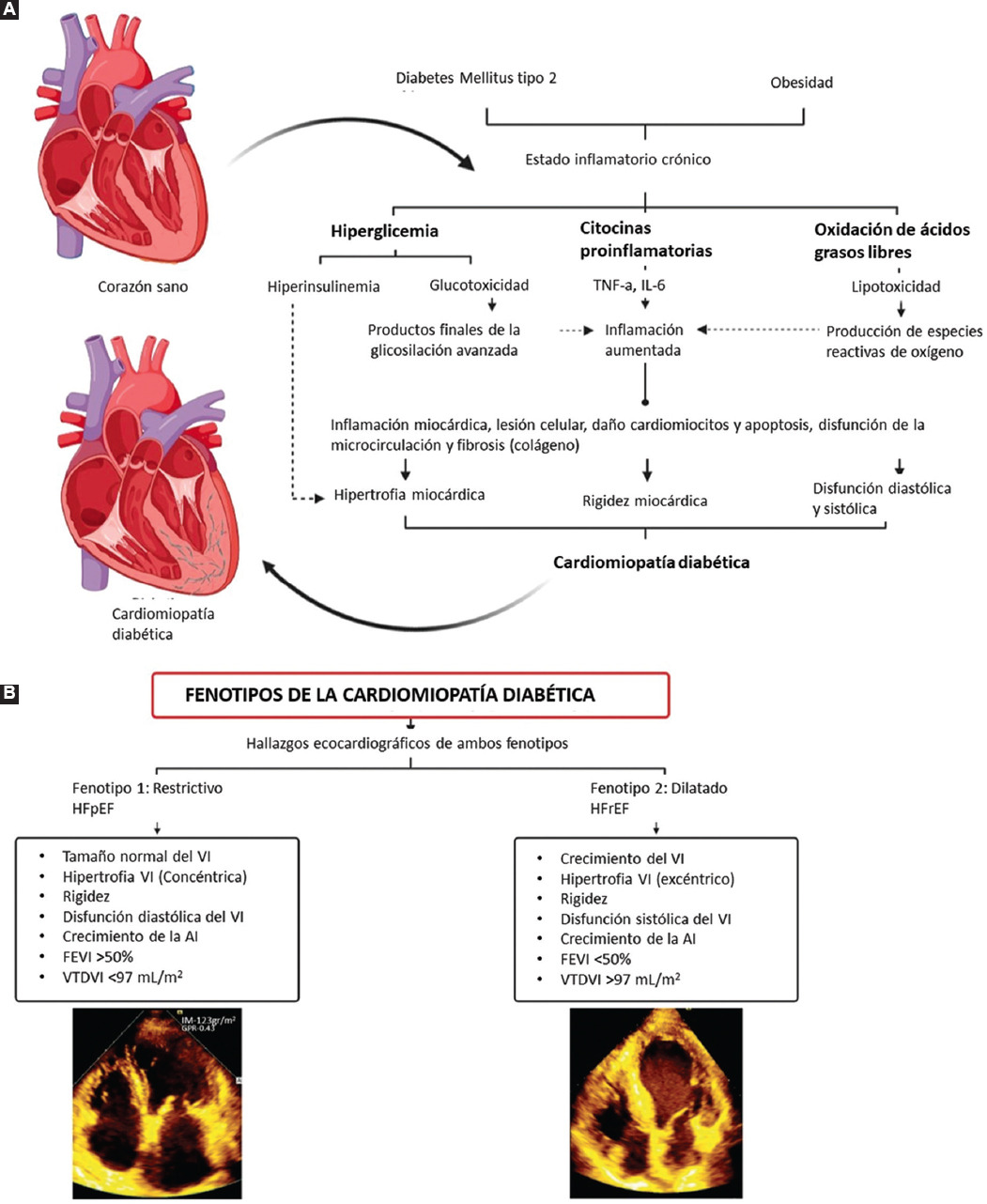
Figura 1 A: vías patológicas de la miocardiopatía diabética. B: fenotipos de miocardiopatía diabética. AI: aurícula izquierda; FEVI: fracción de expulsión del ventrículo izquierdo; VI: ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo.
Fisiopatología implicada en la MCD
La fisiopatología de la MCD no ha sido dilucidada completamente. Se han propuesto mecanismos como disfunción del eje renina-angiotensina-aldosterona, resistencia a la insulina, producción de radicales libres de oxígeno, que tienden a dañar la microcirculación coronaria, así como alteraciones en el metabolismo de carbohidratos y lípidos, lo que puede ocasionar estados de glucotoxicidad y lipotoxicidad. Además, el estado proinflamatorio, con la producción de citocinas inflamatorias, perpetúa el daño celular.
La glucotoxicidad es uno de los principales mecanismos fisiopatológicos. La hiperglucemia crónica lleva a cambios metabólicos y funcionales en las fibras miocárdicas debido a estrés oxidativo, lo cual disminuye la capacidad contráctil del cardiomiocito y posteriormente deriva en un estado de fibrosis, que lleva a cambios en la relajación ventricular y, finalmente, a insuficiencia diastólica.
Por último, pero no menos importante, debe mencionarse que en los estadios iniciales de la DM2, la hiperinsulinemia compensatoria desempeña un papel importante en la hipertrofia del ventrículo izquierdo mediante mecanismos aún desconocidos.4
Hallazgos ecocardiográficos de IC con MCD
El Doppler transmitral es la técnica usual para la valoración de la función diastólica. Las variables son onda de llenado ventricular temprana (equivalente a la onda E, que representa el llenado rápido pasivo ventricular cuando se abren las válvulas auriculoventriculares), onda de llenado ventricular tardío (equivale a la onda A, que representa el llenado activo o contracción auricular), relación E/A (relación entre las ondas E y A, el aumento en este valor es sugerente de insuficiencia diastólica), tiempo de relajación isovolumétrica (parte del ciclo cardíaco que comienza con el cierre de las válvulas sigmoideas y termina con la apertura de las válvulas auriculoventriculares), velocidad pico de la onda E (velocidad en la onda E en su punto máximo), tiempo de desaceleración de la onda E (parte descendente de la onda E, que comprende desde el pico máximo a la línea basal) y duración de la onda A9 (para un mayor detalle de las definiciones ecocardiográficas consultar el material suplementario).
Fenotipos de la MCD
La presentación más común de la MCD es con una FEVI reducida o un patrón dilatado (fenotipo 1). El otro patrón está asociado a FEVI preservada, en la que las presiones dentro de las cavidades ventriculares están incrementadas, el cual se ha denominado patrón restrictivo o concéntrico, es decir, IC con FEVI preservada (fenotipo 2).8 Los hallazgos más frecuentes en el fenotipo 2 son hipertrofia ventricular concéntrica con un tamaño ventricular normal, rigidez aumentada y aumento en las presiones de llenado ventricular (Figuras 1B y 2A).8,10

Figura 2 A: miocardiopatía diabética con fenotipo restrictivo/insuficiencia cardíaca con fracción de expulsión preservada. Varón de 63 años y diabetes mellitus tipo 2, con antecedente de disnea de medianos esfuerzos de 10 años de evolución. B: miocardiopatía diabética con fenotipo dilatado/insuficiencia cardíaca con fracción de expulsión reducida. Varón de 37 años y diabetes tipo 1, con antecedentes recientes de ortopnea e insuficiencia cardíaca. C: ecocardiografía 2D y 3D del ventrículo derecho; volúmenes y fracción de eyección en un paciente con miocardiopatía diabética.
Por otro lado, el patrón fenotípico dilatado se ha asociado más a un mecanismo de autoinmunidad que deriva en IC, principalmente en pacientes con diabetes mellitus tipo 1.8-11 (Figura 2B). La teoría de la autoinmunidad implicada en el desarrollo de MCD con un patrón fenotípico dilatado se conformó debido a autoanticuerpos de miosina cardíaca identificados en pacientes con diabetes mellitus tipo 1 después de un infarto, hallazgos que sugirieron un "síndrome autoinmune posinfarto" en ese tipo de pacientes, lo que exacerbaba el daño celular producido por la glucotoxicidad, la lipotoxicidad y los radicales libres, así como el mayor riesgo de IC con FEVI disminuida. Sin embargo, los mecanismos fisiopatológicos todavía no son claros.8
Relación entre DM2 y enfermedad arterial coronaria
La mortalidad cardiovascular en todos los grupos de edad y en ambos sexos se incrementa con la DM2 o antecedente de infarto de miocardio, los cuales actúan en forma sinérgica.12 Al mismo tiempo, la DM2 exacerba los mecanismos subyacentes de la aterosclerosis y la IC.13 La DM2 se asocia a incremento de dos a cuatro veces del riesgo de mortalidad por afección cardiovascular.14 En el estudio de Reis et al. se sugiere un efecto directo de la elevación del nivel de la glucosa en sangre a largo plazo o un efecto indirecto debido a las múltiples anomalías metabólicas asociadas a la diabetes y la prediabetes.15 Estas alteraciones se reflejan en el corazón con cambios de remodelación en su estructura y función.16
Remodelación y cambios funcionales en el ventrículo derecho
Kang et al. observaron que el ventrículo derecho desempeña un papel importante en la estratificación del riesgo de IC y es un fuerte predictor para la aparición de fibrilación auricular. Las alteraciones en ese ventrículo están relacionadas con eventos cardiovasculares mayores.17-20 Los pacientes tienen una disfunción diastólica más profunda, caracterizada por presiones significativamente elevadas de la aurícula derecha y mayor rigidez del ventrículo derecho, cuya remodelación incluye hipertrofia excéntrica, dilatación y disfunción sistólica, debido a una alteración concomitante del miocardio de ese ventrículo y de la vasculatura pulmonar20,21 (Figura 2C).
Hallazgos ecocardiográficos en pacientes con diabetes (Tabla 1)
Tabla 1 Hallazgos ecocardiográficos en diabetes mellitus tipo 2
| Modalidades ecocardiográficas | IC en DM2 | MCD | EAC y DM2 | |
|---|---|---|---|---|
| Fenotipo 1 | Fenotipo 2 | |||
| Ecocardiografía 2D | Hipertrofia del VI | VI de tamaño normal | VI dilatado | Hipertrofia del VI. |
| Relación E/A transmitral disminuida Menor velocidad diastólica temprana anular mitral (e), mayor E/e Disfunción diastólica del VI Mayor volumen AI Deterioro de SGL del VI |
Hipertrofia concéntrica del VI Rigidez Disfunción diastólica del VI Relación E/e > 15 y menor relación E/A AI dilatada Deterioro del SGL Deterioro del strain circunferencial |
Hipertrofia excéntrica del VI Rigidez Disfunción sistólica del VI Deterioro del SGL Deterioro del strain circunferencial |
Pico sistólico del strain Pico diastólico del strain Todos los parámetros del strain afectados Disminución de la función sistólica y diastólica |
|
| Ecocardiografía 3D | FEVI >50 % (disminución con la progresión de la
enfermedad) VTDVI <97 mL/m2 |
FEVI >50 % VTDVI <97 mL/m2 |
FEVI <50 % VTDVI >97 mL/m2 |
VTDVI VTSVI FEVI (disminuye con la edad) |
AI: aurícula izquierda; FEVI: fracción de expulsión del ventrículo izquierdo; SGL: strain global longitudinal; VI: ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo
Ecocardiografía convencional Doppler 2D. Los rangos de llenado ventricular se ven alterados en presencia de disfunción diastólica,2 que se manifiesta por reducción en la velocidad de la onda E, con aumento en la onda A y tiempo prolongado de desaceleración de la onda E, lo que corresponde a disfunción diastólica.1,9
Doppler tisular. Es importante el análisis del movimiento anular mitral diastólico: ondas e y a. El cociente de E/e se ha descrito como una medida indirecta de la disfunción diastólica cuando es superior a 15. Además, el strain rate (tasa de deformación) y strain (deformación) pueden analizarse con Doppler tisular.1 Ambos parámetros proporcionan una evaluación más directa de la contractilidad miocárdica intrínseca.9
Ecocardiografía con contraste intravenoso. La opacificación ventricular mejora los bordes endocárdicos al delinear la anatomía, lo que lleva a mayor precisión del tamaño y movimiento ventricular. Sin embargo, los estudios sobre MCD evaluaron el flujo sanguíneo miocárdico en lugar del movimiento; además, la administración intravenosa de medios de contraste también puede limitar el uso de esta modalidad.17
Ecocardiografía 3D. Esta modalidad se utiliza para evaluar ventrículos con formas o movilidad anormales por su mayor precisión diagnóstica.1
Ecocardiografía con seguimiento de manchas (speckle tracking). Permite la detección de anomalías en la deformación global del miocardio. La técnica de seguimiento tridimensional confirma la correlación entre la microangiopatía diabética y la deformación miocárdica en pacientes con DM2 asintomáticos, mediante la reducción del SGL y la deformación miocárdica circunferencial global.2
La primera evaluación del paciente diabético incluye la medición de las dimensiones y de la función del VI, seguida de la determinación de la causa subyacente de la IC. Lo anterior se debe a que una de las primeras alteraciones estructurales y funcionales que desarrollan los pacientes con diabetes es el remodelado ventricular.17,18 La hipertrofia ventricular izquierda y la fibrosis miocárdica son los principales hallazgos de la MCD.19 Sin embargo, el hallazgo ecocardiográfico más temprano en pacientes con MCD es la disfunción diastólica del VI, que predispone al desarrollo de IC con FEVI preservada.16 La disfunción diastólica puede diagnosticarse mediante Doppler tisular, especialmente en los casos con una relación E/e´ > 15. Actualmente, los métodos ecocardiográficos avanzados, como las imágenes de strain, han identificado alteraciones subclínicas en la función miocárdica sistólica en pacientes con DM2 y FEVI preservada (típicamente > 50 %). Los estudios sugieren que las alteraciones en el SGL en realidad pueden constituir un marcador más sensible que la disfunción diastólica.17
Comparación con otras modalidades de imagen (Tabla 2)
Tabla 2 Hallazgos comparativos entre diferentes modalidades de imagen
| Ecocardiografía transtorácica | 2D: relación E/A transmitral disminuida. velocidad diastólica temprana anular mitral más baja, mayor E/e, mayor volumen de la aurícula izquierda, relación E/e > 15, hipertrofia del VI y deterioro del SGL |
| 3D: al inicio FEVI >50 % y VTDVI <97 mL/m2. En estadios avanzados, FEV I<50 % y VTDVI >97 mL/m2 | |
| Tomografía computarizada | Visualiza las arterias coronarias y las estructuras anatómicas del corazón y confirma el diagnóstico de MCD |
| SPECT | Evalúa cambios metabólicos y cambios funcionales dinámicos como la reserva del flujo coronario, que es menor en pacientes con MCD |
| PET | Evalúa cambios metabólicos, reserva del flujo coronario y flujo sanguíneo miocárdico, poniendo de manifiesto la enfermedad arterial coronaria. |
| Resonancia magnética | Evalúa y detecta hallazgos anatómicos y funcionales mínimos en el músculo cardíaco. Es el estándar de oro para medir volúmenes y función sistólica del ventrículo izquierdo. La resonancia magnética se puede utilizar para evaluar el tejido adiposo epicárdico, que se asocia con resistencia a la insulina y con deformación sistólica reducida en MCD |
FEVI: fracción de expulsión del ventrículo izquierdo; MCD: miocardiopatía diabética; PET: tomografía por emisión de positrones; SGL: strain global longitudinal; SPECT: tomografía computarizada por emisión de fotón único; VTDVI: índice de volumen telediastólico del ventrículo izquierdo.
Imagen de perfusión miocárdica nuclear. La imagen de perfusión miocárdica mediante talio-201 o tecnecio-99m sestamibi por tomografía computarizada por emisión de fotón único (SPECT) es una herramienta no invasiva ampliamente utilizada y validada para el diagnóstico de isquemia miocárdica. La prevalencia de defectos de perfusión miocárdica evaluada por SPECT en pacientes con diabetes asintomáticos oscila entre 20 y 40 %.22,23
Tomografía por emisión de positrones. La evaluación de la perfusión miocárdica mediante la tomografía computarizada por emisión de positrones puede ser una buena alternativa en situaciones en las que la calidad de la imagen por SPECT es subóptima (pacientes con obesidad y mujeres).24 Varios estudios han demostrado desregulación de la reactividad microvascular miocárdica en pacientes con diabetes.25
Imagen de perfusión por resonancia magnética. Existe un número limitado de estudios que han realizado perfusión miocárdica por resonancia magnética cardíaca en pacientes con diabetes.22,26
Complicaciones microvasculares de la diabetes y su implicación cardiovascular
La esperanza de vida en pacientes con diabetes es 10 años menor en población no diabética.
Las complicaciones microvasculares incluyen la neuropatía diabética (neuropatía cardíaca autonómica), la cual está relacionada con la duración y el grado de control glucémico.27
La microangiopatía diabética es una enfermedad multifactorial causada por factores ambientales y genéticos. Una de las complicaciones graves de la diabetes que más pasa desapercibida es la neuropatía autonómica cardiovascular, en la cual existe una activación de citocinas inflamatorias que se correlacionan con anomalías en el equilibrio simpatovagal. La disfunción del sistema autónomo predice riesgo cardiovascular y muerte súbita en pacientes con DM2.
La disfunción autonómica y la neuropatía se han convertido en los predictores más poderosos del riesgo de mortalidad. El cambio en el estilo de vida con tratamiento farmacológico de la hiperglucemia, la hipertensión, la dislipidemia y la microalbuminuria reducen en 68 % las anomalías en la función autonómica. El tratamiento intensivo de la diabetes retrasa el desarrollo y la progresión de la neuropatía autonómica cardíaca en la diabetes tipo 1.28
Relación entre el control glucémico y cambios en los parámetros ecocardiográficos
Las alteraciones ecocardiográficas en la DM2 parecen estar relacionadas con el control glucémico. No está claro si la mejoría del control glucémico podría revertir estos cambios estructurales y funcionales;29 sin embargo, los pacientes con mejor control glucémico y lipídico tuvieron una mejoría relativa en el SGL, e septal y E/e después de 12 meses de intervenciones. Quienes presentaron la mayor disminución en la hemoglobina glucosilada mostraron mayor mejoría en la función sistólica y diastólica del VI.29,30
Los pacientes de alto riesgo se benefician de un manejo agresivo de los factores de riesgo, con control de la hipertensión arterial, colesterol, lipoproteínas de baja densidad, control glucémico, protección renal e intervenciones en el estilo de vida.31
Además, Wright et al. demostraron que el tratamiento de la diabetes (sobre todo con inhibidores del cotransportador sodio-glucosa tipo 2) es beneficioso en la prevención primaria de los eventos cardiovasculares mayores e IC.32,33
En el tratamiento del fenotipo dilatado se usan los mismos pilares establecidos por las guías para el manejo de la IC con FEVI reducida, como inhibidores de la enzima convertidora de la angiotensina, antagonistas de los receptores de la angiotensina II, betabloqueadores, antagonistas del receptor de mineralocorticoides, ivabradina y terapia de resincronización.32,34
Discusión
La cardiomiopatía diabética es la principal complicación cardiovascular de la DM2.35 La patogénesis de la enfermedad cardiovascular en pacientes con DM2 aún no está clara, sin embargo, la hiperglucemia crónica, el estrés oxidativo y metabólico, la lipotoxicidad, la resistencia a la insulina y la enfermedad microvascular se encuentran entre los factores contribuyentes más establecidos en la enfermedad cardiovascular en estos pacientes.36 Varios estudios han demostrado que la hiperglucemia crónica en los pacientes con prediabetes y DM2 se asocian a aterosclerosis, deterioro de la función cardíaca y disfunción sistólica y diastólica del VI en etapas posteriores de la vida.37,38
Las guías de práctica clínica recientes recomiendan el tamizaje de pacientes con alto riesgo de IC. Se están estableciendo estrategias para tratar o prevenir la progresión de la MCD, con el objetivo de abarcar los diferentes mecanismos patogénicos involucrados en el desarrollo de la MCD.
Resultados recientes de ensayos cardiovasculares han identificado nuevos agentes terapéuticos con beneficio cardiovascular, como los SGLT-2, que reducen la hospitalización por IC.39-42 Otras opciones terapéuticas como vericiguat y omecamtiv mecarbil han sido estudiadas para IC, pero no para MCD.43,44
Conclusiones
La incidencia de la enfermedad cardiovascular e IC se incrementa notablemente en pacientes con DM2 y contribuye a la disminución en la esperanza de vida. La hipertrofia ventricular izquierda y disfunción diastólica y sistólica subclínica son hallazgos ecocardiográficos frecuentemente observados en pacientes con DM2. Estos cambios estructurales y funcionales podrían ser relevantes para prevenir eventos cardiovasculares mayores. Se requieren investigaciones más confiables en pacientes con DM2 mediante ecocardiografía, con el objetivo de investigar los mecanismos y efectos beneficiosos de la terapia antidiabética.
Material suplementario
El material suplementario se encuentra disponible en DOI: 10.24875/GMM.M23000749. Este material es provisto por el autor de correspondencia y publicado online para el beneficio del lector. El contenido del material suplementario es responsabilidad única de los autores.











 nueva página del texto (beta)
nueva página del texto (beta)


