Antecedentes
La Organización Mundial de la Salud publicó la quinta edición de la Clasificación de Tumores del Sistema Nervioso Central (WHO CNS5 por sus siglas en inglés) en 2021. Las cuatro ediciones previas correspondieron a los años 1979, 1993, 2000 y 2007, y una revisión posterior en 2016.1,2 En la clasificación WHO CNS5 se reconocen 22 nuevos tipos de tumores; además, la nomenclatura de algunos tumores fue revisada en 2016 con base en hallazgos recientes en diagnósticos genético-moleculares.1 En la quinta edición se enfatiza en la importancia de los diagnósticos integrados, algunos basados en novedosas tecnologías de diagnóstico, como el perfilado de metilomas de ADN.2
Para estadificar la severidad y el manejo de los tumores, la nueva clasificación resalta la identificación de mutaciones específicas (entre las más relevantes, en isocitrato deshidrogenasa [IDH]) y la dominancia de patrones genéticos, más que las características histológicas. Como consecuencia de esta nueva clasificación, la Sociedad Americana de Radio-Oncología ha publicado recientemente guías de práctica clínica actualizadas para el glioma difuso con mutaciones en IDH, las cuales se publicaron en mayo de 2022.3 Durante la segunda mitad de 2021 y en 2022, algunas revistas indizadas y oficiales de especialidades médicas en Estados Unidos que tratan tumores cerebrales publicaron artículos en los que se comenta el tema.2,4-6 La mayoría de esos artículos están dirigidos a médicos especialistas (radiólogos, oncólogos, neurocirujanos, etcétera) y abordan técnicas de resonancia magnética (RM) avanzada que permiten, de forma no invasiva, la caracterización en vivo de tumores cerebrales; además de los aspectos morfológicos cualitativos, esas técnicas hacen posible la cuantificación de metabolitos relacionados con mutaciones en el sistema nervioso central (SNC), parte fundamental del diagnóstico. Estas posibilidades en la imagen de RM, que hasta hace pocos años parecían de ciencia ficción, se han convertido en una realidad en hospitales de tercer nivel que disponen de la tecnología necesaria.
Debido a que el tema es una de nuestras líneas de investigación, preparamos este escrito dirigido a médicos que tratan tumores cerebrales (pediatras, neurólogos, oncólogos, radiólogos, neurocirujanos, etcétera), en el que comentamos los cambios en la clasificación WHO CNS5 de gliomas que pueden ser tipificados mediante imágenes de RM avanzada, a fin de evidenciar las mutaciones genéticas indicativas de un tumor agresivo y de que es necesario cambiar el plan de tratamiento. Se incluye una descripción histórica de la clasificación del WHO CNS5, un resumen de los cambios más relevantes en la clasificación, los conceptos actuales en el diagnóstico con imágenes de RM convencional para el glioblastoma, y una descripción breve de las técnicas de RM avanzada que identifican las mutaciones mencionadas.
Aspectos históricos
La primera edición de la clasificación WHO CNS fue presentada en 1979 por Zülch et al. Este sistema se ha convertido en el estándar internacional para el diagnóstico de tumores del SNC, con revisiones periódicas y ediciones actualizadas.6 La primera edición se basó principalmente en datos clínicos e histológicos, como los obtenidos mediante tinción por hematoxilina-eosina; ediciones posteriores integraron conocimientos de inmunohistoquímica, así como biomarcadores moleculares.1,2,6
Tradicionalmente, la gradación de tumores de SNC se basó en aspectos histológicos, pero ciertos marcadores moleculares pueden proporcionar importante información pronóstica. Por este motivo, parámetros moleculares han sido incluidos como biomarcadores para la gradación de tumores y posterior estimación pronóstica.2
Cambios en la clasificación WHO CNS5
En esta edición se presentan numerosos cambios de relevancia, desde la nomenclatura de ciertos tumores y su gradación, hasta el agregado de nuevos tipos de tumores cerebrales. En la cuarta edición, los gliomas estaban distribuidos en distintos grupos de la clasificación; en la quinta edición se englobaron en un solo grupo titulado "Gliomas, tumores glioneuronales, y tumores neuronales". Un aspecto importante es la división de los gliomas difusos según su frecuencia en niños o adultos.2
Un cambio específico para la categoría de gliomas difusos consiste en nuevos criterios para establecer el diagnóstico de glioblastoma IDH-wildtype: se observó que los tumores clasificados por sus características histopatológicas como astrocitoma IDH-wildtype grado 2 o 3 frecuentemente tenían un comportamiento agresivo, comparable con el de los glioblastomas, motivo por el cual se valoró qué alteraciones genéticas podían predecir el comportamiento agresivo. El resultado fue la amplificación de EGFR, mutaciones en TERTp, ganancia de cromosoma 7 o pérdida de cromosoma 10. Actualmente, un astrocitoma IDH-wildtype con alguna de estas alteraciones permite el diagnóstico de glioblastoma, aun si no presenta las características histopatológicas típicas.6 Los cambios en la clasificación WHO CNS5, comparados con la edición previa, se resumen en la Tabla 1. En la Figura 1, a manera de algoritmo, se describe cómo se realiza el diagnóstico de gliomas difusos según la nueva clasificación.
Tabla 1 Diferencias entre las ediciones de 2016 y 2021 de la WHO CNS
| WHO CNS | ||
|---|---|---|
| Cuarta edición (2016) | Quinta edición (2021) | |
| Términos para clasificación | Entidades y variantes | Tipos y subtipos |
| Numeración | Números romanos | Números arábicos |
| Taxonomía: grupos de tumores | Dividida en 17 grupos: tumores oligodendrogliales y astrocíticos difusos, otros tumores astrocíticos, tumores ependimales, otros gliomas, tumores del plexo coroideo, tumores neuronales y tumores mixtos neuronales-gliales, tumores de la región pineal, tumores embrionales, tumores de los nervios craneales y paraespinales, meningiomas, tumores mesenquimales y tumores no meningoteliales, tumores melanocíticos, linfomas, tumores histiocíticos, tumores de células germinales, tumores de la región selar y tumores metastásicos | Dividida en 13 grupos: gliomas, tumores glioneuronales y neuronales, tumores del plexo coroideo, tumores embrionales, tumores pineales, tumores de los nervios craneales y paraespinales, meningiomas, tumores mesenquimales y no meningoteliales que involucran SNC, tumores melanocíticos, tumores hematolinfoides que involucran SNC, tumores de células germinales, tumores de la región selar, metástasis a SNC y síndromes genéticos tumorales que involucran SNC |
| Estadificación | A través de distintas entidades tumorales | Entre el mismo tipo |
| Nuevos tipos tumorales reconocidos | 22 | |
| Cambios específicos: Gliomas, tumores glioneuronales y neuronales | ||
| Gliomas difusos | Se encontraban en el grupo de tumores oligodendrogliales y astrocíticos difusos. No había distinción por edades | Se encuentran en el grupo de gliomas, tumores glioneuronales y neuronales, divididos en dos subgrupos según su frecuencia de afectación en niños o adultos |
| Nuevos tipos tumorales reconocidos | 14 | |
| Simplificación de la clasificación | Los gliomas difusos comunes se dividían en 15 entidades distintas | Los gliomas difusos comunes se dividen en 3 tipos |
| Tumores astrocíticos difusos de IDH-mutante; correspondían a tres tipos tumorales distintos según parámetros histológicos | Tumores astrocíticos difusos IDH-mutante; solo se consideran astrocitoma IDH-mutante y posteriormente reciben grado WHO 2, 3 o 4 | |
| Gradación de tumores | Con base en características histológicas | Las alteraciones genéticas pueden cambiar el grado del tumor, aun sin que este presente las características histológicas correspondientes, como deleción homocigótica CDKN2A/B, que resulta en un grado 4 en los astrocitomas IDH-mutante. De igual forma, el diagnóstico de glioblastoma IDH-wildtype puede establecerse en el contexto de un glioma astrocítico difuso IDH-wildtype si presenta alguna de las siguientes mutaciones: mutación en el promotor TERT, amplificación de EGFR, ganancia de un cromosoma 7 o pérdida de un cromosoma 10 |
CDKN2A: inhibidor de la quinasa dependiente de ciclina 2A; EGFR: receptor del factor de crecimiento epidérmico; IDH: isocitrato deshidrogenasa; SNC: sistema nervioso central; TERT: telomerasa transcriptasa inversa; WHO CNS: Clasificación de Tumores del Sistema Nervioso Central de la Organización Mundial de la Salud.

Figura 1 Esquema representativo del diagnóstico de los gliomas difusos según la nueva clasificación WHO CNS5. ATRX: helicasa dependiente de ATP; CDKN2A: inhibidor de la quinasa dependiente de ciclina 2A; EGFR: receptor del factor de crecimiento epidérmico; IDH: isocitrato deshidrogenasa; OMS: Organización Mundial de la Salud; TERT: telomerasa transcriptasa inversa; TP53: proteína tumoral 53.
En la WHO CNS5 también se hace énfasis en el uso de los biomarcadores moleculares para el diagnóstico de gliomas, implementados desde la revisión de la cuarta edición en 2016, es decir, de acuerdo con las mutaciones en el gen que codifica IDH1 o IDH2. Estas mutaciones se consideran un evento temprano en la génesis de gliomas y son comúnmente encontradas en gliomas de bajo grado. El pronóstico de los pacientes con gliomas difusos con mutaciones en IDH1 o IDH2 es mejor que en quienes presentan gliomas con IDH-wildtype.7 Esas mutaciones se han asociado a acumulación de 2-hidroxiglutarato (2-HG) en el tumor.8
Imágenes convencionales de RM para el diagnóstico
Los gliomas son tumores primarios del SNC que surgen a partir de los diferentes linajes de células gliales.9 El glioblastoma es un subtipo de los gliomas difusos de alto grado extremadamente heterogéneo, el más frecuente en adultos, el más letal9,10 y que se estratifica como grado 4 según la clasificación de la Organización Mundial de la Salud.2,10 Este tumor se caracteriza por marcada neovascularidad, mitosis incrementada, alta celularidad, pleomorfismo nuclear y evidencia microscópica de necrosis. Desde décadas anteriores, como hallazgos por imagen se describe un aspecto muy heterogéneo, típicamente con áreas centrales de necrosis o hemorragia, bordes irregulares y edema perilesional.11
La RM con gadolinio es el estándar de oro para la evaluación de tumores cerebrales. Las modalidades convencionales de RM incluyen T1 sin contraste, T1 con contraste (frecuentemente gadolinio), FLAIR y T2.10,12,13 En la Figura 2 se aprecia el aspecto clásico de un glioblastoma con el empleo de técnicas de imagen convencionales. Las características imagenológicas sugestivas de un glioma difuso grado 2 o 3 incluyen una masa circunscrita y supratentorial, homogénea e hiperintensa en T2, típicamente localizada en lóbulos frontales o temporales, sin calcificaciones o realce con contraste. Con FLAIR es característico encontrar una masa homogénea, relativamente hipointensa en toda su extensión si se compara con la secuencia T2, excepto por un halo periférico hiperintenso. Los astrocitomas grado 3 pueden mostrar mayor heterogeneidad en T2 y realce con contraste.5
Secuencias de RM avanzada para el diagnóstico
Desde 2006 se han publicado estudios acerca del uso de técnicas de RM avanzada con las cuales es posible analizar de forma cuantitativa las imágenes. Con la implementación de las técnicas de RM avanzada se logró estudiar en forma no invasiva las características tumorales y peritumorales útiles para la valoración del pronóstico y tratamiento.14-16 Las técnicas de RM avanzada continúan en desarrollo y los médicos no especialistas en el tema pueden desconocerlas; generalmente se tiene el concepto de que la imagen solo muestra aspectos cualitativos. Conforme se obtienen más conocimientos acerca de la imagenología avanzada, los médicos hemos aprendimos que la RM convencional es solo la punta del iceberg. Las técnicas de RM avanzada se dividen en cuatro tipos: difusión, perfusión, espectroscopia y tensor de difusión. En los últimos años hemos publicado artículos acerca de cómo se observa el glioblastoma con el uso de estas cuatro modalidades de imagen.12,13,17-20 En la Figura 3 se representan las técnicas de RM; las modalidades convencionales implican un porcentaje menor de la imagenología actual.

Figura 3 Técnicas cualitativas convencionales (sobre la línea gris) comparadas con las técnicas de resonancia magnética avanzada (bajo la línea gris). AD: difusividad axial; ASL: marcado del espín arterial; Cho: colina; CL: tensor lineal; CP: tensor plano; CS: tensor esférico; DCE: contraste dinámico mejorado; DSC: contraste de susceptibilidad dinámica; FA: anisotropía fraccionada; mI/Cr: mioinositol/creatina; L: magnitud total del tensor de difusión; NAA: N-acetil-aspartato; P: difusión isotrópica pura; Q: difusión anisotrópica pura; RA: anisotropía relativa; rCBF: flujo sanguíneo cerebral relativo; rCBV: volumen sanguíneo cerebral relativo; RD: difusividad radial.
Espectroscopia por RM para identificar mutaciones en IDH
En los gliomas, la espectroscopia por resonancia magnética (MRS) de hidrógeno muestra una imagen típica caracterizada por incremento de ácido láctico y colina en las regiones de 0.9 a 1.3 partes por millón (ppm), así como decremento de N-acetil-aspartato en la región de 2.0 ppm.21
La MRS tiene un papel en la evaluación de mutaciones en IDH1 y IDH2 (aunque por sí mismas no muestren una clara evidencia radiológica, el 2-HG, metabolito aumentado ante estas mutaciones, sí puede detectarse por MRS); su sensibilidad y especificidad es de 100 y 81.3 %, respectivamente, valores que favorecen su alcance diagnóstico.22,23
Inicialmente se pensó que el metabolito 2-HG podía detectarse en la región entre 1.91 y 2.24 ppm, pero el pico de ese metabolito se superponía con glutamato, glutamina y ácido gamma-aminobutírico. Por esa razón se utiliza la región entre 4.0 y 3.5 ppm para identificar los gliomas con mutaciones en IDH1 y IDH2, en la que se observan diferencias entre las mutaciones IDH-wildtype y las anteriormente clasificadas como "IDH-mutantes".21 En la Figura 4 se muestra un ejemplo de la presencia de 2-HG en tejido tumoral detectado por MRS.
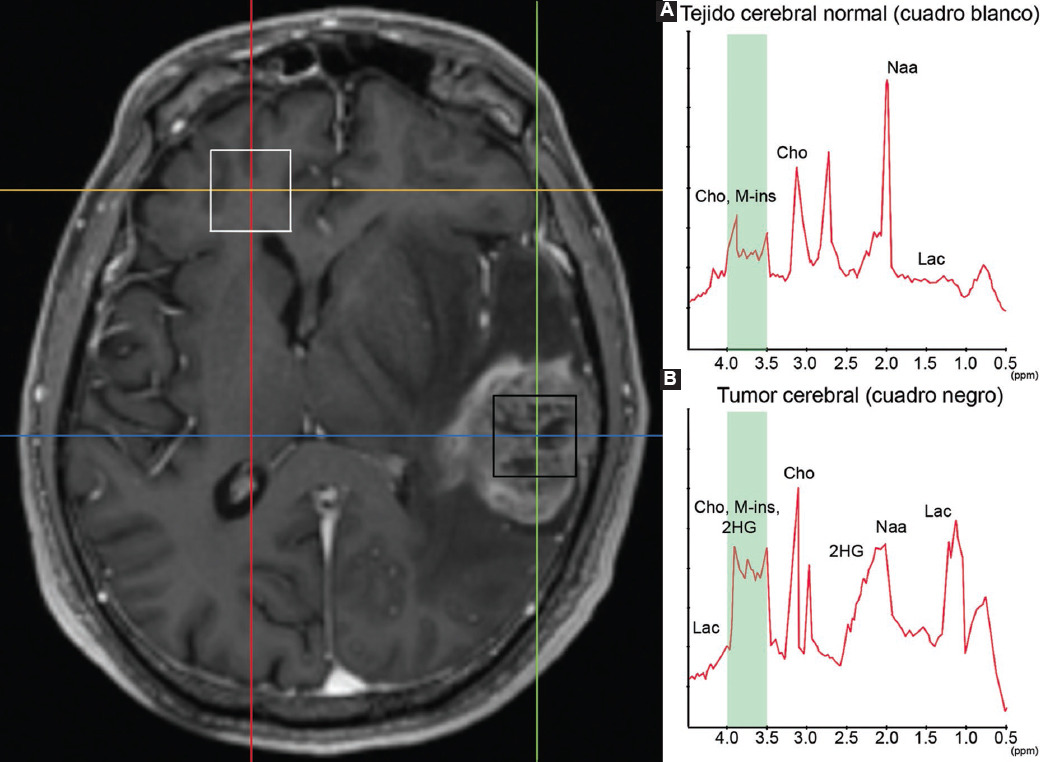
Figura 4 MRS de paciente con tumor positivo a mutación en IDH1. A: gráfica de metabolitos detectados en el cuadro blanco (zona de tejido sano); B: gráfica de los metabolitos detectados en el cuadro negro (zona de lesión tumoral). Destaca la presencia del oncometabolito 2-HG en la gráfica B (tumor), completamente ausente en la gráfica A (tejido sano). MRS: espectroscopia por resonancia magnética; Cho: colina; Naa: N-acetil-aspartato; Lac: lactato; 2-HG: 2-hidroxiglutarato; M-ins: mioinositol.
Asimismo, la tipificación del estado de las enzimas IDH1 y IDH2 mediante imágenes por tensor de difusión ha mostrado resultados favorables cuando se combinan técnicas de inteligencia artificial como el machine learning.24 En 2020, Flores Alvares et al. señalaron que la MRS y las imágenes por tensor de difusión serían implementadas en la clasificación de tumores cerebrales de la Organización Mundial de la Salud.12
Direcciones futuras
El estudio del glioblastoma y otros gliomas aún no ha terminado; la integración de nuevas técnicas de imagenología avanzada proporciona una mejor caracterización in vivo no invasiva de los tumores.25 La utilización de estas técnicas en hospitales de tercer nivel permitirá la obtención de información nueva que podrá ayudar a identificar la microestructura y heterogeneidad de los gliomas, así como la infiltración tumoral, entre otros aspectos, lo cual permitirá una mejor estratificación de riesgo y la planeación de los tratamientos.25-27
La RM desempeña un papel clave en la evaluación de los tumores cerebrales, aunque las técnicas convencionales siguen siendo el estándar para diagnosticar y evaluar la evolución.10 En la última actualización de la guía de la Sociedad Americana para la Radio-Oncología se recomienda la vigilancia con RM cada seis meses en pacientes con oligodendrogliomas con buenos pronósticos.3
La posibilidad de identificar la presencia de mutación en IDH mediante MRS y tensor de difusión tiene un gran impacto en la evaluación del tumor y el establecimiento del pronóstico, motivo por el cual desde 2020 se hizo evidente que podría ser incorporada en la clasificación de tumores del SNC de la Organización Mundial de la Salud.12
La MRS tiene un gran potencial en el análisis rutinario de 2-HG, especialmente en áreas elocuentes del cerebro en la que el riesgo quirúrgico es alto, así como en el seguimiento de metabolitos asociados a mutaciones en IDH durante el tratamiento con terapias específicas.
En conclusión, la implementación de la imagenología avanzada constituye un desafío en las distintas especialidades relacionadas con el manejo de los tumores cerebrales. Sin embargo, el dificultad para acceder a estas tecnologías (las cuales no se encuentran disponibles en todas las instituciones) y el mayor tiempo de procesamiento de las imágenes (que debe ser realizado por personal capacitado) constituyen limitantes importantes. A pesar de lo anterior, el futuro de la práctica cotidiana de la neurorradiología incluirá las técnicas de imagenología avanzada, las cuales proporcionarán más conocimientos acerca de la biología y estadificación tumoral, además del seguimiento de nuevas tratamientos.











 nueva página del texto (beta)
nueva página del texto (beta)



