Antecedentes
Las inmunodeficiencias son un grupo de enfermedades causadas por la alteración o ausencia de uno o más componentes específicos o inespecíficos que participan en la respuesta inmune innata y adaptativa. Pueden clasificarse en primarias o congénitas, las cuales tienen su origen en un defecto genético intrínseco, y en secundarias o adquiridas, que aparecen como consecuencia de una gran variedad de condiciones patológicas.1
Las citocinas son proteínas solubles de bajo peso molecular (de 6 a 70 kDa), producidas por casi todas las células. Estos mediadores químicos forman la red de comunicación intercelular de todos los sistemas celulares del cuerpo, incluyendo el sistema inmune; son responsables de la regulación dinámica de la maduración, el crecimiento, la capacidad mediadora y moduladora de la respuesta de las células inmunitarias a agentes infecciosos y estímulos inflamatorios. Asimismo, las citocinas regulan la homeostasis de las células, donde los circuitos de señalización de citocinas incluyen múltiples puntos de control regulatorios, que a menudo implican la inhibición de la retroalimentación, proceso que permite que los tejidos vuelvan a un estado de inmunotolerancia no inflamatorio relativamente inactivo. En forma general, las citocinas se pueden agrupar en proinflamatorias y antiinflamatorias, si promueven o inhiben la inflamación, respectivamente. Investigaciones recientes indican que la liberación simultánea de ambos grupos de citocinas es obligatoria en cualquier respuesta inmunitaria.2-6
En años recientes, la presencia de autoanticuerpos contra citocinas (ACAA, anticytokine autoantibodies) ha sido cada vez más reconocida como una inmunodeficiencia secundaria, ya que al neutralizar la función de su citocina blanco dichos anticuerpos pueden predisponer a diversas infecciones y manifestaciones inmunológicas; los ACAA también pueden ser considerados como "fenocopias autoinmunes de inmunodeficiencias primarias". No obstante, niveles bajos de estos anticuerpos están presentes en algunos individuos sanos y pueden contribuir a mantener la homeostasis de la respuesta inmune.7-9
La inmunodeficiencia adquirida debida a ciertos ACAA puede predisponer a diversas infecciones y manifestaciones inmunológicas, por lo que se consideran fenocopias autoinmunes de inmunodeficiencias primarias en las que se presentan variantes patogénicas en genes que codifican ciertas citocinas, sus receptores o moléculas que median la transducción de señales de citocinas,55 como interferón gamma (IFNγ) -alteraciones genéticas en las cascadas de señalización de IFNγ/IL-12-, interleucina (IL)-6 (mutaciones en gp130, IL-6R y el factor de transcripción STAT3), IL-17 (afectación en IL-17F, IL-17RA, IL17RF, el adaptador intracelular ACT1, la vía de señalización de IL12/IL23 y en los factores de transcripción CARD9, STAT3, STAT1 y RORgT) y el factor estimulador de colonias de macrófagos y granulocitos (GM-CSF), con mutaciones en el receptor A de este.10-18
Hasta la fecha, autoanticuerpos contra IFNγ, GM-CSF, IL-6, IL-10, IL-12, un grupo de citocinas producidas por células Th-17 (IL-17A, IL-17F, IL-22, IL-23), así como contra IFN tipo I, han sido asociados a susceptibilidad a infecciones, por lo que esta revisión busca ofrecer un panorama sobre la comprensión actual de las inmunodeficiencias secundarias asociadas a la presencia de ACAA.
Autoanticuerpos anti-IFNγ
IFNγ es una citocina pleiotrópica relacionada con mecanismos antiproliferativos, proapoptóticos y antitumorales; también es clave en la defensa contra agentes infecciosos intracelulares y es producida principalmente por células Th1 y células natural killer. El IFNγ actúa principalmente sobre macrófagos (induce la destrucción intracelular de patógenos fagocitados) y tiene efecto sobre las funciones de diferentes tipos celulares (linfocitos Th1, Th2, Th17, células B, entre otros).19
Anticuerpos neutralizantes contra IFNγ relacionados con una predisposición a infecciones micobacterianas fueron reportados por primera vez en 2004. Las características clínicas de los pacientes con esos autoanticuerpos son análogas a las de pacientes con alteraciones genéticas en las cascadas de señalización de IFNγ/IL-12, lo que indica que autoanticuerpos anti-IFNγ inducen un estado de inmunodeficiencia adquirida y predisponen al huésped a infecciones por microorganismos intracelulares como las micobacterias.8,20,21 Desde entonces, más de 600 casos han sido reportados, principalmente en pacientes originarios del sureste de Asia (Tailandia, Taiwán, Japón, Filipinas, Vietnam y el sureste de China), lo que sugiere que factores genéticos pudieran estar involucrados.22
Autoanticuerpos anti-IL-12
La IL-12 es una citocina proinflamatoria heterodimérica conformada por dos subunidades, IL-12p40 e IL-12p35, es producida por macrófagos y células dendríticas e induce la producción de IFNγ, por lo que participa en la protección contra patógenos intracelulares. La IL-12 mejora la generación y la actividad citotóxica de los linfocitos T citotóxicos, células natural killer y natural killer activadas por linfocinas, donde todas estas células secretan IFNγ.23,24
Debido a que IL-12 participa en la respuesta inmune contra patógenos intracelulares, la presencia de autoanticuerpos contra la subunidad IL-12p40 en pacientes se ha asociado a desarrollo de infecciones por organismos oportunistas como nocardiosis, coccidioidomicosis, toxoplasmosis y leishmaniasis; recientemente se reportó un paciente con infecciones por Burkholderia gladioli. Asimismo, altos títulos de autoanticuerpos contra IL-12 se han reportado en pacientes con miastenia gravis y timoma.25-27
Autoanticuerpos contra GM-CSF
El GM-CSF es un factor de crecimiento hematopoyético, puede ser producido por células mieloides, células dendríticas, linfocitos T, linfocitos B y células no hematopoyéticas (tales como células endoteliales, condrocitos y células epiteliales alveolares tipo II). En el pulmón, el GM-CSF es importante para la diferenciación y función de los macrófagos alveolares; recientemente se ha propuesto que GM-CSF es necesario para la eliminación del colesterol en estos macrófagos. La reducción de esta función del GM-CSF constituye la principal causa de la acumulación del colesterol, lo que favorece el desarrollo de la proteinosis alveolar pulmonar (PAP), caracterizada por la acumulación progresiva de surfactante en los alvéolos pulmonares, lo que resulta en insuficiencia respiratoria hipoxémica y un mayor riesgo de infecciones secundarias o fibrosis pulmonar.18-28
Asimismo, los autoanticuerpos contra GM-CSF son el análogo autoinmune de la deficiencia primaria de GM-CSF que causa PAP, lo que altera la función del GM-CSF sobre los macrófagos alveolares y afecta el metabolismo de los lípidos y las proteínas del surfactante mediado por estas células, lo que deriva en acumulación del surfactante y, por lo tanto, en insuficiencia respiratoria.29
Desde hace tiempo se reconoce que los pacientes con PAP corren el riesgo de infecciones por una gran variedad de organismos intracelulares, como Nocardia e Histoplasma, que pueden ser secundarias a la disfunción pulmonar subyacente. Asimismo, se han reportado pacientes con PAP autoinmune con infecciones pulmonares recurrentes (principalmente aspergilosis, micobacterias atípicas y Mycobacterium tuberculosis), así como con sobreinfección con influenza H1N1, que puede exacerbar la PAP.18,30
Autoanticuerpos anti-IL-17
La familia de IL-17 comprende seis citocinas diferentes (IL-17A, IL-17B, IL-17C, IL-17D, IL-17E e IL-17F), producidas principalmente por células Th17. Las IL-17 tienen un papel importante en la defensa de las mucosas, particularmente contra Candida, al inducir la producción de citocinas proinflamatorias, péptidos antimicrobianos y quimiocinas, con lo cual ocasionan el reclutamiento de células inmunitarias al sitio de infección y la eliminación del patógeno.31,32
En pacientes con poliendocrinopatía autoinmune tipo 1 (APECED, autoimmune poly-endocrinopathy candidiasis ectodermal dystrophy), causada por mutaciones en el regulador autoinmune, y también en pacientes con timoma, se reportó el desarrollo de candidiasis mucocutánea crónica relacionada con altos títulos de autoanticuerpos neutralizantes contra IL-17A, IL-17F e IL-22; esos autoanticuerpos podrían considerarse como fenocopias de las alteraciones genéticas en estas citocinas ya que inhiben su actividad biológica, favoreciendo una infección crónica con Candida en mucosas.33,34
Autoanticuerpos anti-IL-6
IL-6 es una citocina pleiotrópica que participa en la inflamación, la hematopoyesis y en la respuesta contra infecciones virales, parasitarias, fúngicas y bacterianas. Es producida por varios tipos celulares (fibroblastos, queratinocitos, células endoteliales, macrófagos, entre otras) en respuesta al daño tisular o a infecciones. La desregulación de IL-6 se asocia a inflamación crónica (enfermedad inflamatoria intestinal), trastornos autoinmunes multifactoriales (esclerosis múltiple y artritis reumatoide), cáncer, anemia y enfermedad de Alzheimer.35-38
Por otra parte, se ha reportado inmunodeficiencia secundaria por la presencia de autoanticuerpos contra IL-6, como en un niño con abscesos subcutáneos y celulitis estafilocócica recurrente, en quien estos autoanticuerpos anti-IL-6 preceden a una infección estafilocócica. Asimismo, otros dos pacientes con altos títulos de autoanticuerpos neutralizantes contra la IL-6 presentaron infecciones por Staphylococcus aureus, Staphylococcus intermedius y Escherichia coli. También se han detectado estos autoanticuerpos en pacientes con APECED y timoma.39,40
Autoanticuerpos contra interferones tipo I
IFNα e IFNω forman parte de los IFN tipo I, los cuales son un gran subgrupo de proteínas interferón que ayudan a regular la actividad del sistema inmunológico, son secretados por varios tipos de células durante las infecciones virales. Los IFN tipo I presentan una capacidad para inducir directamente una respuesta antiviral entre las células infectadas y circundantes.41,42
Se ha reportado la presencia de autoanticuerpos neutralizantes contra IFN tipo I en pacientes con timoma y APECED, si bien no parecen estar asociados a incremento de infecciones virales. Por otra parte, se ha reportado este tipo de autoanticuerpos en individuos con lupus eritematoso sistémico; sin embargo, considerando que se detectaron altos títulos de autoanticuerpos anti-IFNα en pacientes con enfermedad leve, se sugirió que la severidad de esta podría estar regulada por los autoanticuerpos contra IFNα.43-46
También se han reportado autoanticuerpos neutralizantes contra IFNα en pacientes con infecciones causadas por el virus de varicela-zóster. Recientemente, se reporta la presencia de autoanticuerpos contra IFN tipo I en pacientes con COVID-19 grave. Estos autoanticuerpos neutralizaron a IFNα o IFNω, lo que resalta la importancia de este tipo de interferones en la inmunidad protectora contra el virus SARS-CoV-2 y establece una relación entre la presencia de autoanticuerpos neutralizantes contra interferones tipo I y la complicación de COVID-19.47-49
Tratamiento
El tratamiento de pacientes con ACAA es variado y depende del autoanticuerpo detectado y el tipo de enfermedad asociada. En general, entre los tratamientos que se han utilizado en pacientes con infecciones relacionadas con ACAA se encuentran los dirigidos a disminuir las manifestaciones clínicas (antimicrobianos apropiados como primer tratamiento, antiinflamatorios, entre otros), la administración de la citocina exógena y el uso de inhibidores de células B (rituximab y daratumumab).50,51
Particularmente para el tratamiento de pacientes con títulos muy altos de autoanticuerpos neutralizantes a IFNγ se ha reportado que el uso de la citocina exógena no disminuye los signos de la enfermedad; sin embargo, por otra parte, se ha observado disminución en los títulos de autoanticuerpos anti-IFNγ cuando se emplea rituximab, un anticuerpo monoclonal terapéutico dirigido contra CD20 que agota las células B maduras. Recientemente se reportó el uso exitoso de daratumumab en un paciente con títulos altos de anti-IFNγ y que presentaba infecciones progresivas por micobacterias a pesar del tratamiento previo con rituximab.52
Mientras que el tratamiento utilizado en la PAP causada por anti-GM-CSF es el lavado pulmonar, la administración de GM-CSF humano recombinante y rituximab, el uso de la citocina exógena se lleva a cabo de forma inhalada y subcutánea, y en ambos casos se ha reportado una respuesta clínica favorable en pacientes con PAP. Es importante mencionar que existen informes de que el tratamiento con rituximab ha sido exitoso en la reducción de los niveles de ACAA; sin embargo, es menos efectivo en cuadros clínicos en los cuales están involucrados autoanticuerpos anti-GM-CSF, en comparación con los relacionados con la presencia de autoanticuerpos contra IFNγ.53,54
En pacientes con candidiasis mucocutánea crónica que presentan autoanticuerpos anti-IL-17 se emplean agentes antifúngicos, tanto tópicos como sistémicos, para el control de la infección, por lo que tratamientos más agresivos contra el sistema inmune de los pacientes, como los inmunomoduladores, por lo general no son requeridos o recomendados; sin embargo, como los antifúngicos no actúan directamente sobre el mecanismo autoinmune, los pacientes suelen requerir este tipo de fármacos de forma frecuente o prolongada.16
Etiología
Los ACAA pueden contribuir a mantener la homeostasis de la respuesta inmune en individuos sanos, mientras que en ciertos pacientes el desarrollo de estos tiene el potencial de alterar severamente los procesos inmunológicos con consecuencias graves.50,55 Algunos estudios mencionan que los ACAA se pueden observar en individuos con mutaciones de los genes activadores de la recombinación, en quienes ocasionan susceptibilidad a infecciones recurrentes y desregulación inmunitaria.56
Por otra parte, el reporte de la homología de un epítopo principal reconocido por los autoanticuerpos anti-IFNγ y la proteína fúngica Noc2 de Aspergillus spp. sugiere que el mimetismo molecular podría ser el mecanismo subyacente al desarrollo de estos ACAA.57 También se puede inducir el desarrollo de ACAA en pacientes como una respuesta al tratamiento con citocinas;58 sin embargo, las causas del desarrollo de ACAA siguen sin estar bien definidas.
Conclusiones
Los ACAA están involucrados en la desregulación inmunitaria, la autoinmunidad y la inmunodeficiencia, ya que tienen el potencial de alterar severamente los procesos inmunológicos con consecuencias graves en algunos casos. Las manifestaciones son muy variadas, como se ha descrito a lo largo de esta revisión; un resumen gráfico de ello se muestra en la Figura 1.
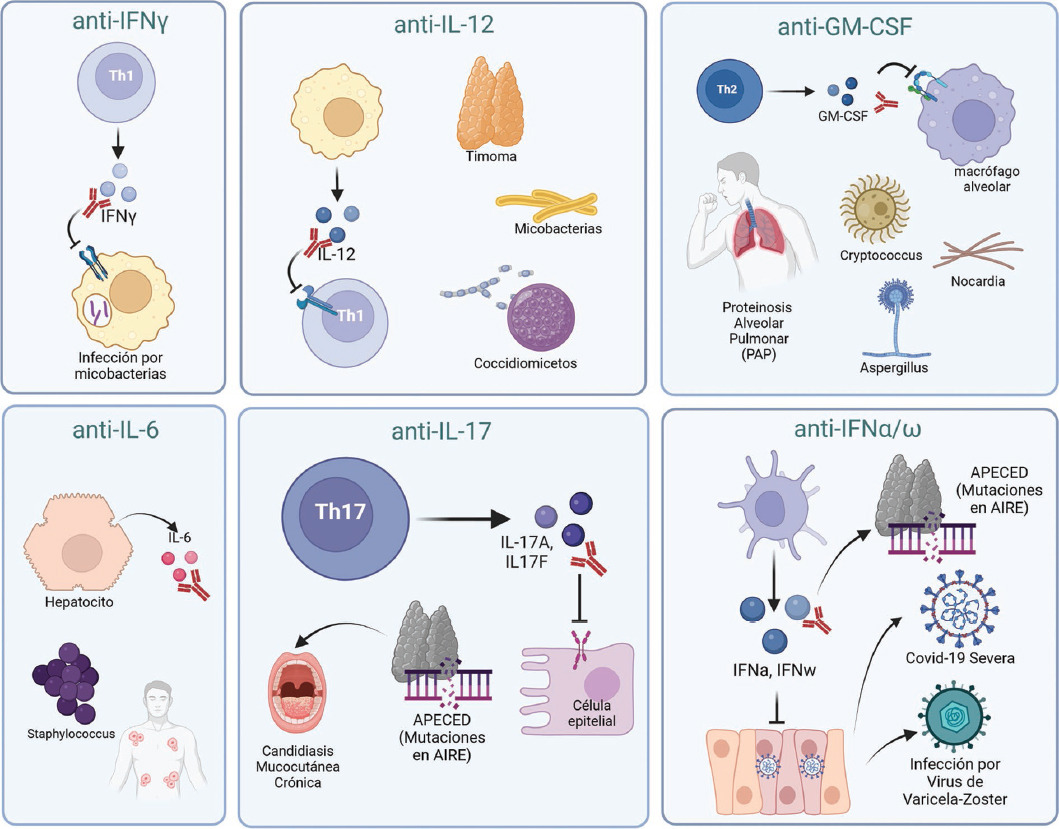
Figura 1 Autoanticuerpos anticitocinas y enfermedades asociadas. Resumen gráfico de las enfermedades relacionadas con la presencia de autoanticuerpos contra diversas citocinas (creado con BioRender.com).
La presencia de ACAA pueden causar susceptibilidad adquirida a infecciones y contribuir al desarrollo de enfermedades autoinmunes. Sin embargo, debido a que los ACAA no se buscan rutinariamente, aún se desconoce si en la mayoría de las condiciones se desarrollan gradualmente o en respuesta a un desencadenante específico. Asimismo, es necesario considerar la evaluación de los pacientes para detectar ACAA en los casos en que la alteración de los procesos inmunitarios normales estuviera contribuyendo a la enfermedad, así como en individuos inmunocompetentes que experimenten infecciones por microorganismos oportunistas o infecciones recurrentes, crónicas o inusualmente graves con patógenos más comunes.
De esta forma, la detección de ACAA podría considerarse un marcador de gran utilidad para propósitos de diagnóstico, para decidir tratamientos y manejos más adecuados e, incluso, personalizados para cada paciente, considerando que estos autoanticuerpos pueden provocar la pérdida del efecto al tratamiento y, probablemente, alteraciones de la función del sistema inmunitario.











 nueva página del texto (beta)
nueva página del texto (beta)


