Introducción
En el organismo existen dos compartimientos de la 5-hidroxitriptamina (5-HT, serotonina): cerebral y periférica.1,2 La 5-HT cerebral representa alrededor de 5 % del total del cuerpo, actúa como factor trófico, neuromodulador y neurotransmisor.1,3 El 95 % restante se produce en los órganos periféricos, la mayoría en las células enterocromafines del intestino; puede actuar localmente o ingresar a la circulación sanguínea.4,5 En la sangre, la 5-HT es captada y almacenada por las plaquetas,6 2 % está libre en el plasma y puede actuar como una hormona.7,8
La 5-HT participa en la fisiología cardiovascular a través de los receptores serotoninérgicos 5-HT1A, 5-HT1B, 5-HT2A, 5-HT3, 5-HT4 y 5-HT7 ubicados en los cardiomiocitos o en las terminales nerviosas.9-13 Los cardiomiocitos capturan 5-HT a través del transportador de membrana celular (SERT),14,15 que participa en la remodelación y desarrollo del corazón.11 SERT no se expresa en el miocardio adulto y solo persiste en las válvulas cardiacas.14 El receptor 5-HT1B regula las resistencias periféricas12 y la actividad fibroblástica del miocardio.16 El receptor 5-HT2A produce vasoconstricción aórtica;17 además, ejerce efecto cronotrópico e inotrópico positivo.18,19 El receptor 5-HT2B se ha asociado a mitogénesis fibroblástica y fibrosis subendocárdica20-22 e interviene en los mecanismos de hipertrofia ventricular.23
Recientemente, se ha demostrado la presencia de la triptófano-5-hidroxilasa (TPH) 1 y 2, SERT y receptores 5-HT1B, 5-HT2A y 5-HT2B en corazones de pacientes que fallecieron por causas ajenas a enfermedad cardiovascular,10 así como en corazones de ratas normales9 y con miocardiopatía diabética.24 Estos resultados apoyan la presencia de un sistema serotoninérgico intrínseco que participa en la fisiología del corazón en los seres humanos.
Tomando en cuenta todos estos hallazgos, nos planteamos si la miocardiopatía hipertrófica induce cambios en las expresiones de TPH1, TPH2, SERT y receptores 5-HT2A, 5-HT2B y 5-HT4 en los cardiomiocitos de la pared libre del ventrículo izquierdo (PLVI) y del septum interventricular (SIV) en comparación con corazones que sirvieron de control.
Métodos
Se realizó un estudio transversal comparativo en cinco bloques de tejido de corazones de pacientes fallecidos por miocardiopatía hipertrófica (MCH) y cinco bloques de corazones de pacientes fallecidos por causas ajenas a enfermedad cardiovascular. Las muestras fueron obtenidas de los archivos de patología del Hospital de Cardiología del Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, y del Hospital General de México, Secretaría de Salud. Se obtuvieron cinco cortes de la PLVI y del SIV de cada uno de los bloques de cada grupo, para determinar las expresiones de TPH1, TPH2, SERT y receptores 5-HT2A, 5-HT2B y 5-HT4 por inmunofluorescencia con anticuerpos específicos para cada molécula; para la observación y cuantificación se utilizó un microscopio confocal invertido Nikon Ti Eclipse equipado con un sistema de imágenes AI, ambos controlados con el programa NIS Elements v.5.50.
Para comparar las expresiones de TPH, SERT y receptores 5-HT2A, 5-HT2B y 5-HT4 en la PLVI y el SIV de ambos grupos, se obtuvieron primero las intensidades de fluorescencia de cada molécula, después se determinaron los promedios y los errores estándar de la media. Posteriormente, fueron normalizadas y, finalmente, los grupos fueron contrastados mediante t de WELCH, con un nivel de significación de p < 0.05.
Resultados
La expresión de TPH1 y TPH2 en la PLVI y el SIV de ambos grupos se muestran en las Figuras 1 y 2. Como se puede ver en las Figuras 1B y 2B, se observó un aumento de la expresión de TPH1 y TPH2 en ambas estructuras en los corazones con MCH en comparación con los controles (p < 0.01).

Figura 1 A: micrografías de la PLVI y el SIV (a, control; b, hipertrófica; c, control; d, hipertrófico) que muestran cardiomiocitos inmunorreactivos a TPH1. Las flechas señalan la inmunorreactividad en el citoplasma. Escala 40×, – 4 μm. B: intensidades de fluorescencia normalizadas de la PLVI y el SIV, cada caja corresponde a la media ± error estándar de la media de cinco determinaciones en cada estructura de cada grupo. La diferencia entre grupos se obtuvo mediante t de WELCH. PLVI, a versus b; SIV, c versus d, **p < 0.01. PLVI: pared libre del ventrículo izquierdo; SIV: septum interventricular.

Figura 2 A: micrografías de la PLVI y el SIV (a, control; b, hipertrófica; c, control; d, hipertrófico) que muestran cardiomiocitos inmunorreactivos a TPH2. Las flechas señalan la inmunorreactividad en el citoplasma. Escala 40×, – 4 μm. B: intensidades de fluorescencia normalizadas de la PLVI y el SIV, cada caja corresponde a la media ± error estándar de la media de cinco determinaciones en cada estructura de cada grupo. La diferencia entre grupos se obtuvo mediante t de WELCH. PLVI, a versus b; SIV, c versus d, **p < 0.01. PLVI: pared libre del ventrículo izquierdo; SIV: septum interventricular.
Las expresiones de los receptores 5-HT2A y 5-HT2B en la PLVI y SIV en ambos grupos se ilustran en las Figuras 3A y 4A. Ambos receptores se expresaron más en los corazones con MCH con relación con los de control (p < 0.01). La Figura 5A muestra la expresión del receptor 5-HT4 en la PLVI y el SIV de ambos grupos. El SIV con MCH mostró un aumento en comparación con el control (p < 0.01). Sin embargo, la PLVI no mostró diferencias en la expresión de 5-HT4 al compararla con la control.

Figura 3 A: micrografías de la PLVI y el SIV (a, control; b, hipertrófica; c, control; d, hipertrófico) que muestran cardiomiocitos inmunorreactivos a 5-HT2A. Las flechas señalan la inmunorreactividad en el citoplasma. Escala 40×, – 4 μm. B: intensidades de fluorescencia normalizadas de la PLVI y el SIV, cada caja corresponde a la media ± error estándar de la media de cinco determinaciones en cada estructura de cada grupo. La diferencia entre grupos se obtuvo mediante t de WELCH. PLVI, a versus b; SIV, c versus d, **p < 0.01. PLVI: pared libre del ventrículo izquierdo; SIV: septum interventricular.

Figura 4 A: micrografías de la PLVI y el SIV (a, control; b, hipertrófica; c, control; d, hipertrófico) que muestran cardiomiocitos inmunorreactivos a 5-HT2B. Las flechas señalan la inmunorreactividad en el citoplasma. Escala 40×, – 4 μm. B: intensidades de fluorescencia normalizadas de la PLVI y el SIV, cada caja corresponde a la media ± error estándar de la media de cinco determinaciones en cada estructura de cada grupo. La diferencia entre grupos se obtuvo mediante t de WELCH. PLVI, a versus b; SIV, c versus d, **p < 0.01. PLVI: pared libre del ventrículo izquierdo; SIV: septum interventricular.

Figura 5 A: micrografías de la PLVI y el SIV (a, control; b, hipertrófica; c, control; d, hipertrófico) que muestran cardiomiocitos inmunorreactivos a 5-HT4. Las flechas señalan la inmunorreactividad en el citoplasma. Escala 40×, – 4 μm. B: intensidades de fluorescencia normalizadas de la PLVI y el SIV, cada caja corresponde a la media ± error estándar de la media de cinco determinaciones en cada estructura de cada grupo. La diferencia entre grupos se obtuvo mediante t de WELCH. PLVI, a versus b, p = no significativa; SIV, c versus d, **p < 0.01. PLVI: pared libre del ventrículo izquierdo; SIV: septum interventricular.
Por otro lado, la Figura 6A muestra la expresión de SERT en la PLVI y el SIV de ambos grupos. Como se puede observar, SERT aumentó en el SIV de los corazones con MCH en comparación con los controles (Figura 6B), p < 0.01); sin embargo, la expresión de SERT en la PLVI no mostró diferencias (Figura 6B).
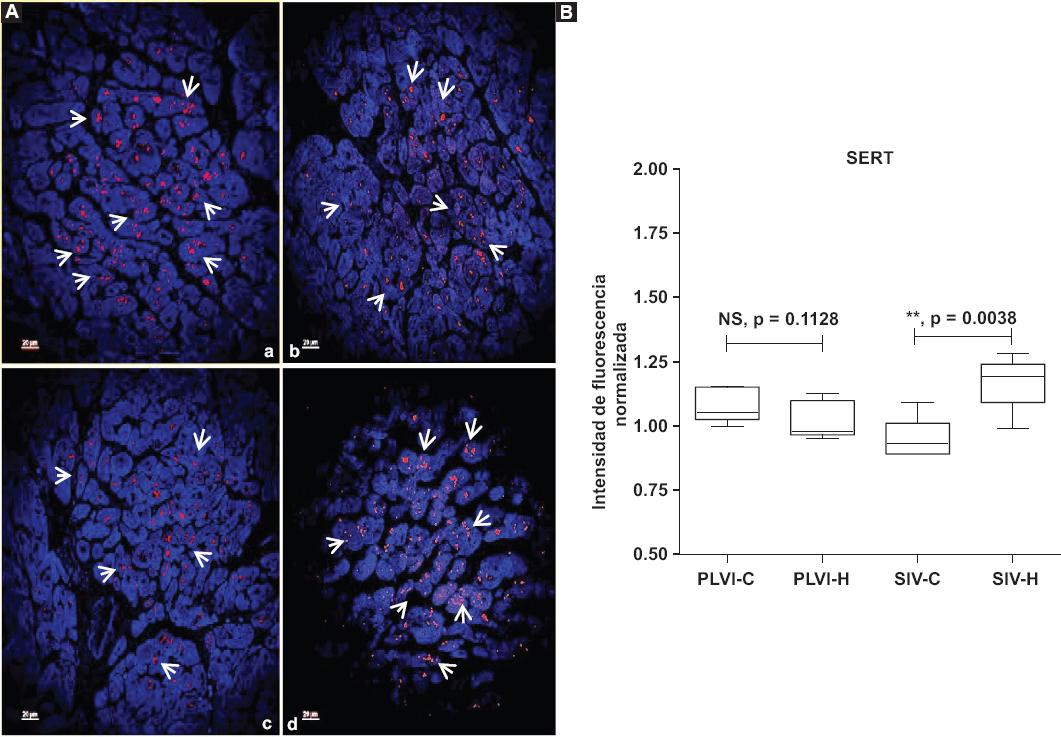
Figura 6 A: micrografías de la PLVI y el SIV (a, control; b, hipertrófica; c, control; d, hipertrófico) que muestran cardiomiocitos inmunorreactivos a SERT. Las flechas señalan la inmunorreactividad en el citoplasma. Escala 40×, – 4 μm. B: intensidades de fluorescencia normalizadas de la PLVI y el SIV, cada caja corresponde a la media ± error estándar de la media de cinco determinaciones en cada estructura de cada grupo. La diferencia entre grupos se obtuvo mediante t de WELCH. PLVI, a versus b, p = no significativa; SIV, c versus d, **p < 0.01. PLVI: pared libre del ventrículo izquierdo; SIV: septum interventricular.
Discusión
En esta investigación, tanto la PLVI como el SIV de los corazones de control y con MCH expresaron TPH, SERT y receptores serotoninérgicos. Estos hallazgos confirman los reportados previamente9,10 y se hacen extensivos a corazones con MCH. La presencia de TPH en los cardiomiocitos, cuya expresión fue mayor en los corazones con MCH, sugiere que probablemente estos cardiomiocitos son capaces de sintetizar suficiente 5-HT para modular la actividad ventricular durante la MCH.9,19,25
También observamos un aumento en la expresión de 5-HT2A y 5-HT2B en PLVI y SIV, y solo se demostró un incremento de 5-HT4 en el SIV en los corazones hipertróficos. Estos hallazgos sugieren que estos receptores pueden participar en los mecanismos moleculares que inducen la hipertrofia miocárdica, dado que regulan el patrón trifásico de la respuesta inotrópica e incrementan la energía de contracción miocárdica ventricular.19,26 También se ha reportado que la sobreexpresión de 5-HT2B produce hipertrofia cardiaca compensada, aspecto que ha sido demostrado en un modelo experimental de la sobreexpresión del receptor 5-HT2B.22 Por lo tanto, el incremento de la expresión de 5-HT2A, 5-HT2B y 5-HT4 en los cardiomiocitos de la PLVI y el SIV, así como de la expresión de SERT en el SIV de los corazones con MCH en comparación con los corazones de control, permiten plantear su posible participación en los mecanismos moleculares y de regulación de la serotonina en los cardiomiocitos durante el desarrollo de la MCH en los seres humanos.
Conclusiones
Los presentes resultados confirman que los corazones con MCH tienen un aumento significativo de la expresión de TPH, SERT y receptores serotoninérgicos en comparación con los corazones de control. Por lo tanto, estos hallazgos en conjunto permiten plantear su posible participación en los mecanismos fisiopatológicos que se presentan durante el desarrollo y evolución de la miocardiopatía hipertrófica en los seres humanos.











 nueva página del texto (beta)
nueva página del texto (beta)


