Introducción
A lo largo de la historia, todas las especies han encontrado diversos obstáculos para su supervivencia y uno de los mayores retos han sido las enfermedades infecciosas. En ningún momento de la humanidad se había contado con tal cantidad de técnicas, estrategias y conocimientos para desarrollar avances científicos, diagnósticos y terapéuticos para una enfermedad, como ha sucedido con COVID-19 y su virus causal, SARS-CoV-2. Aun cuando la tecnología del siglo XXI hace posible la capacidad de interactuar, cooperar y trabajar a distancia, el acceso a toda esa información y conocimiento ha presentado retos: la desinformación y su capacidad de propagación. Actualmente, la seguridad y eficacia de las vacunas contra COVID-19 son un tema de debate en todos los sectores de la población.
En la búsqueda por fortalecer la literatura al respecto, se revisaron algunos aspectos de la respuesta inmune y las vacunas contra COVID-19.
SARS-CoV-2 y la complejidad de los virus ARN
La información acerca de la pandemia sigue generando cientos de reportes en la literatura científica, en los que resaltan los millones de individuos infectados y fallecidos en más de 110 países.1,2
El SARS-CoV-2 es un nuevo betacoronavirus conformado por una cadena simple de ARN+ de ≈ 30 000 nucleótidos que codifican para más de 20 proteínas; de estas, la más estudiada es la proteína de superficie S (spike), que se ha convertido en el principal blanco de moléculas antivirales y anticuerpos neutralizantes.3 Los reportes relativos al virus se están generando y compartiendo a un ritmo sin precedentes, lo que permite su vigilancia en tiempo real4 e identificar, además, las variantes virales para orientar la toma de decisiones y la planificación de estrategias de prevención y control epidemiológico.5,6
Gran incertidumbre ha causado la aparición de nuevas variantes; se esperaba que no le confirieran ventajas evolutivas al virus ni incrementos en la transmisibilidad, patogenicidad e infectividad.5,7 La variante de preocupación alfa fue muy transmisible, la gamma causó una enfermedad grave, incluso en personas previamente infectadas;8,9 en la delta, la combinación de mutaciones parece otorgar una ventaja evolutiva e incrementar la transmisibilidad e infectividad del virus, incluso se ha identificado una potencial evasión inmunitaria; finalmente, ómicron ha acumulado numerosas mutaciones que la han dotado de una infectividad mayor que la variante delta.10-12
Inmunidad y enfermedades infecciosas
En términos simples, la inmunidad es la protección frente a microorganismos infecciosos. El sistema inmunitario tiene sus propios nichos en tejidos especializados que facilitan el crecimiento, maduración y desarrollo de las células inmunitarias.13
Los mecanismos de defensa contra los microorganismos se incluyen en dos categorías, inmunidad innata y adaptativa.14,15 La primera, natural o nativa, se refiere a los mecanismos que están listos para reaccionar frente a las infecciones, incluso antes de que ocurran, por lo que constituye la primera línea de defensa. Está integrada por la piel, células fagocíticas y dendríticas, linfocitos citolíticos naturales y complemento.13-15 En tanto, la inmunidad adaptativa, adquirida y específica, consta de mecanismos capaces de reconocer antígenos específicos del agente infeccioso y se activa con los linfocitos (T, B), células plasmáticas y anticuerpos;13,14 se desarrolla después de la exposición a sustancias extrañas y es más poderosa y eficaz contra las infecciones.15
La ciencia ha encontrado diferentes formas de estimular la respuesta inmune para combatir distintas enfermedades, manipulación a partir de la cual se gesta el concepto de la inmunización, que se define como una estimulación deliberada de la respuesta inmunitaria del huésped.
En general, existen dos tipos de inmunizaciones: la pasiva, que implica la administración de sueros inmunitarios o trasplantes de tejido productor de células inmunocompetentes; y la activa, que implica la administración de antígenos con adyuvantes (vacunas).14-16
Vacunación
Las vacunas son suspensiones de microorganismos muertos o atenuados, proteínas antigénicas, construcciones sintéticas de ADN/ARN u otros derivados biomoleculares administrados para la prevención, mejora o tratamiento de enfermedades infecciosas.16 La vacunación es la administración de vacunas para estimular la respuesta inmunitaria o protectora (inmunización), con la finalidad de disminuir el riesgo de contraer la enfermedad y sus posibles complicaciones.13,17 Así, la vacunación es un evento y la inmunización es el resultado potencial de este, que depende de una compleja coordinación de todas las células corporales.13
La activación del sistema inmunológico innato, la migración de las células clave y los componentes de la vacuna a los ganglios linfáticos se producen en cuestión de horas, seguidos de la maduración de las células B y T en días y semanas.18
Después de la eliminación del patógeno, la respuesta adaptativa generalmente establece la memoria inmunológica, que se caracteriza por la persistencia de anticuerpos neutralizantes y la generación de células de memoria que pueden reactivarse rápidamente tras una reexposición al mismo patógeno,17 y la cual permanece durante meses o años después de la vacunación, lo que brinda protección contra infecciones futuras.18
Memoria inmunológica y vacunas
La memoria inmunológica ha sido ampliamente estudiada.19 Hasta la fecha, el mejor indicador de la protección proporcionada por la vacunación es la inducción de células plasmáticas secretoras de anticuerpos de larga duración y células B de memoria.20 Entonces, los anticuerpos neutralizantes proporcionan la primera capa de defensa contra la reinfección, y las células B de memoria son la segunda capa.21
De esta manera, las vacunas, al igual que las infecciones naturales, inducen una respuesta inmunitaria innata, que a su vez activa una respuesta adaptativa específica de antígeno. De volverse a presentar el contagio o transmisión del agente, se activará la respuesta inmunitaria específica para ese microorganismo, que mitigará eficazmente la infección y prevendrá la forma grave de la enfermedad e, incluso, la muerte.22
Inmunidad de rebaño
Aunque las vacunas son consideradas principalmente como herramientas para la protección individual, también logran proteger a la población no vacunada al disminuir la tasa de transmisión. Esto ocurre porque limitan el riesgo de exposición al promover un mayor aclaramiento microbiano dentro de los hospederos.16 Un ejemplo es la forma como las vacunas reducen las infecciones sintomáticas por SARS-CoV-2, con lo cual se ha observado una carga viral menor entre los individuos con esquema completo de vacunación y que han contraído la infección, en comparación con aquellos no vacunados.23-25
A esta protección indirecta se le denomina inmunidad o protección de rebaño, en la que solo una parte de la población necesita ser inmune (mediante infección natural o vacunación) a un agente infeccioso para evitar grandes brotes.26 Para lograrla, se requiere que 75 a 95 % de la población esté inmunizada. Esto se demuestra con la viruela, contra la cual se alcanzó una cobertura mundial de inmunización > 80 %, que ha reducido las tasas de transmisión a niveles de erradicación;24 en cuanto al sarampión, debe vacunarse a > 90 % de la población para prevenir nuevos brotes,27 mientras que para la poliomielitis, > 80 % debe estar inmunizado contra el polivirus.28 Los anteriores ejemplos ilustran que el rango para la inmunidad colectiva inducida por la vacunación es específico del agente.
De la fase III al mundo real
La eficacia (vaccine efficacy) se define como el porcentaje de reducción de la incidencia de la enfermedad en un grupo vacunado comparado con uno no vacunado; mientras que la efectividad (vaccine effectiveness) es la habilidad o capacidad de prevenir desenlaces de interés en escenarios reales, es decir, el desempeño de la vacuna con la heterogeneidad de la población a la que fue aplicada.29 Para las vacunas contra COVID-19 se presentaron los datos de su eficacia y actualmente se comienzan a reportar estimaciones de su efectividad.22,30,31
Comprender cómo las estimaciones de eficacia de las vacunas contra COVID-19 se traducen en estimaciones de efectividad es crucial, dadas las diferencias en las poblaciones, los intervalos de dosificación y las variantes emergentes.31
Como es de esperar, existen divergencias en la eficacia y efectividad de los productos vacunales, incluso en las vacunas de ARNm y vectores virales se observan diferencias entre variantes virales.22,32 Los reportes abrieron varias interrogantes. Si bien la eficacia y efectividad pueden discrepar, pareciera que la protección generada por la inmunización se empezaba a debilitar conforme transcurría el tiempo, con disminución en el título de anticuerpos neutralizantes y el aumento gradual en el riesgo de infección a los seis meses de la segunda dosis.33,34
Aunque los casos de COVID-19 se incrementaron en los meses subsecuentes a la vacunación,35 es contundente la evidencia de que la vacuna sigue siendo eficiente para prevenir la enfermedad grave y la muerte.22,32,36 Esto es un indicador de que las vacunas están generando una memoria inmunológica lo suficientemente robusta para proveer una respuesta secundaria efectiva. En otras palabras, las células de memoria se reactivan rápidamente y controlan la replicación viral19-21,36 (Figura 1).
Del esquema completo al refuerzo
En este contexto, las vacunas contra COVID-19 han demostrados su eficiencia, si bien esta disminuye con el tiempo.37,38 Por lo anterior, se aprobó el uso de emergencia de la dosis de refuerzo (booster).38-40
El refuerzo se refiere a una dosis adicional que se debe administrar después de que la protección por un primer esquema de vacunación ha comenzado a disminuir. Este fenómeno permite aumentar el título de anticuerpos neutralizantes y mantener la protección por mayor tiempo en comparación con la obtenida con solo las dos primeras dosis,38,40,41 tal como se reportó para BNT162b2, en la cual se estimó una reducción relativa de 93 % y una reducción en la mortalidad de 90 % después del refuerzo.39-43 Esto dio pie a incontables ensayos para determinar la seguridad, eficacia e inmunogenicidad de las terceras dosis, tanto homólogas (del mismo producto vacunal del primer esquema), como heterólogas (un producto distinto). Posiblemente, la presentación de diversos epítopos podría provocar una respuesta inmunitaria más robusta y eficaz, tal como se describe en el ensayo COV-BOOST de la tercera dosis de refuerzo homóloga o heteróloga de todas las vacunas aprobadas.39,41,43-46
Las lecciones de COVID-19
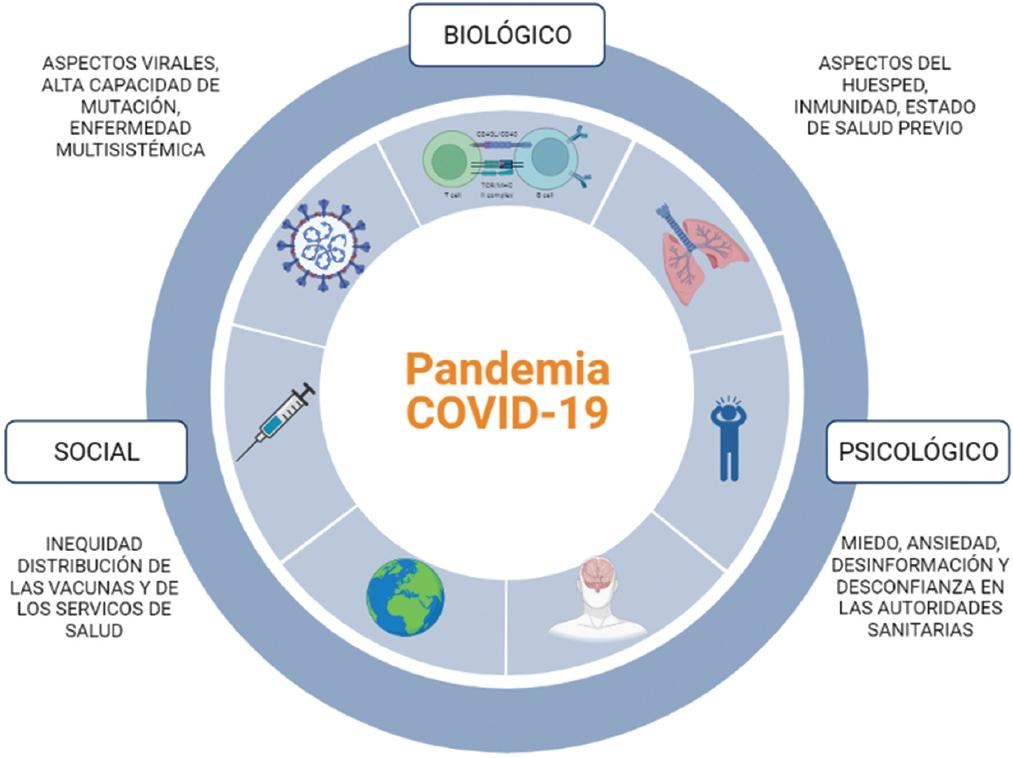
No estábamos preparados para COVID-19, que hizo notorias las grandes inequidades socioeconómicas en el mundo y visibilizó el vínculo inseparable entre los procesos biológicos y sociales y la salud de los individuos (Figura 2).47,48
El comportamiento mundial ante la emergencia sanitaria dejó al descubierto dos vertientes durante las olas de la pandemia: sectores que tienen acceso nulo o limitado a las vacunas y poblaciones que, aun con la capacidad y el fácil acceso, han decidido no vacunarse.49
Las raíces del problema son profundas, desde la dispar distribución de los productos hasta la desinformación, lo cual ha tenido como consecuencia partes del mundo donde los programas de vacunación contra COVID son exitosos y otras donde no tanto; además, hay sectores que consideran que las vacunas son ineficaces e inseguras.49 El resultado es el decremento de la cobertura inmunitaria, lo cual causa sufrimiento prevenible, prolongación innecesaria de la pandemia y el riesgo de padecer variantes resistentes a las vacunas.50,51
Conclusión
La pandemia de COVID-19 es uno de los retos del siglo XXI. La ciencia y la tecnología se pusieron a prueba para desarrollar productos vacunales, fármacos y estrategias diagnósticas en tiempo récord. Además, puso de manifiesto que la desinformación e inequidad en la ciencia son obstáculos mayores. Ante esto, es preciso homogeneizar conceptos generales sobre estos temas, para fortalecer los cimientos con los que se enfrentarán los nuevos desafíos que supone el mundo después de COVID-19.











 nueva página del texto (beta)
nueva página del texto (beta)